
- •Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •1. Зависимость скорости ферментативной реакции от количества ферментов.
- •2. Зависимость скорости ферментативной реакции от температуры среды.
- •3. Зависимость скорости ферментативной реакции от рН среды.
- •4. Зависимость скорости ферментативной реакции от количества субстрата.
- •Выражается уравнением Михаэлиса-Ментена
- •Vmах и Km – кинетические характеристики эффективности фермента.
- •Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
- •3. Роль металлов в ферментативном катализе.
- •Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
- •Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
- •Специфические и неспецифическиеингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
4. Зависимость скорости ферментативной реакции от количества субстрата.
Если конц. ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой.
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта.
Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Концентрация фермента – лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением:

k1 – константа скорости образования фермент-субстратного комплекса;
k -1 – константа скорости обратной реакции, распада фермент-субстратного комплекса;
k2 - константа скорости образования продукта реакции.
Константа Михаэлеса (Km) – соотношение констант скоростей
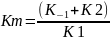
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата
Выражается уравнением Михаэлиса-Ментена
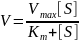
Если концентрация субстрата значительно больше Km (S >> Km), тo увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата.
Следовательно, скорость реакции становится равной макс. скорости: V = Vmax.
В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax – величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
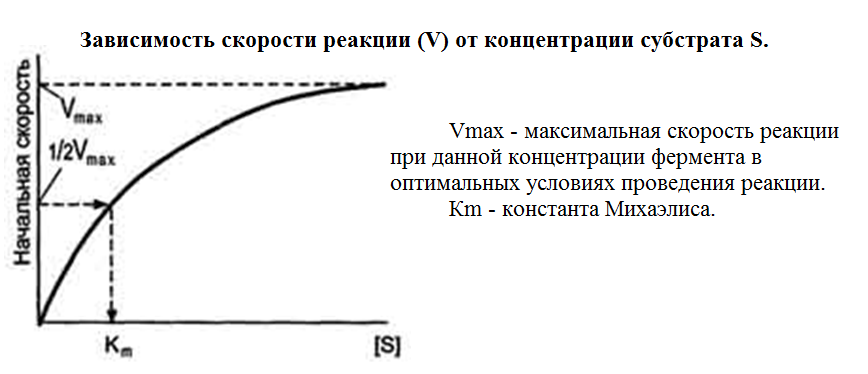
Vmах и Km – кинетические характеристики эффективности фермента.
Vmax дает характеристику каталитической активности фермента и имеет
размерность скорости ферментативной реакции моль/л, т.е. определяет макс. возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата.
Кm характеризует сродство данного фермента к данному субстрату и является
величиной постоянной, не зависящей от концентрации фермента.
Чем меньше Кm, тем больше сродство фермента к данному субстрату,
тем выше начальная скорость реакции
Чем больше Кm, тем меньше начальная скорость реакции,
тем меньше сродство фермента к субстрату.
