
- •Вопрос 16 Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •1. Зависимость скорости ферментативной реакции от количества ферментов.
- •2. Зависимость скорости ферментативной реакции от температуры среды.
- •3. Зависимость скорости ферментативной реакции от рН среды.
- •4. Зависимость скорости ферментативной реакции от количества субстрата.
- •Выражается уравнением Михаэлиса-Ментена
- •Vmах и Km – кинетические характеристики эффективности фермента.
- •Вопрос 17 Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной стр-ры фермента
- •3. Роль металлов в ферментативном катализе.
- •Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
- •Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
- •Специфические и неспецифическиеингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •Вопрос 20 Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования.
- •Вопрос 21 Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ
1. Витамин В6 (пиридоксаль) – предшественник кофермента пиридоксальфосфата (ПФ)
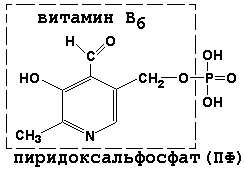
Пример: входит в состав аминотрансферазы, в активном центре которой происходит р.
по механизму «пинг-понг»
Кофермент пиридоксальфосфат (ПФ), связанный с ферментом, принимает
α-аминогруппу от первой аминокислоты (АК1) которая при этом превращается в
α-кетокислоту 1 (КК1) и высвобождается из активного центра фермента.
Далее в активный центр фермента присоединяется α-кетокислота 2 (КК2), которая
забирает аминогруппу от кофермента и превращается в α-аминокислоту (АК2).
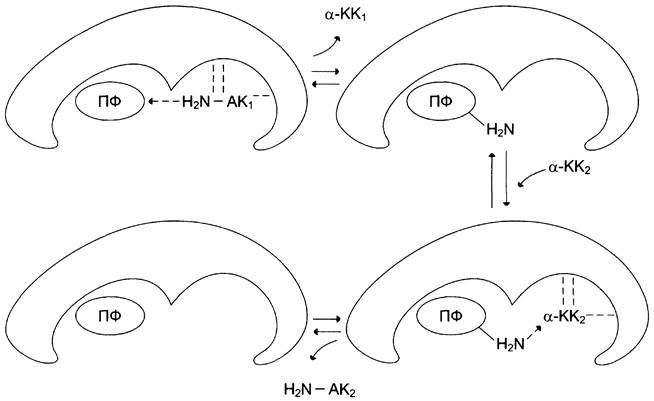
2. Витамин PP (никотинамид) – предшественник коферментов – никотинамид-
адениндинуклеотида (НАД+) и никотинамидадениндинуклеотидфосфата (НАДФ+), входящих в состав дегидрогеназ и редуктаз.
НАД+ и НАДФ+ приобретают коферментные функции после присоединения к
никотинамиду радикала, включающего остаток рибозы, пирофосфат и нуклеотид – аденин. Сам витамин РР такими функциями не обладает.
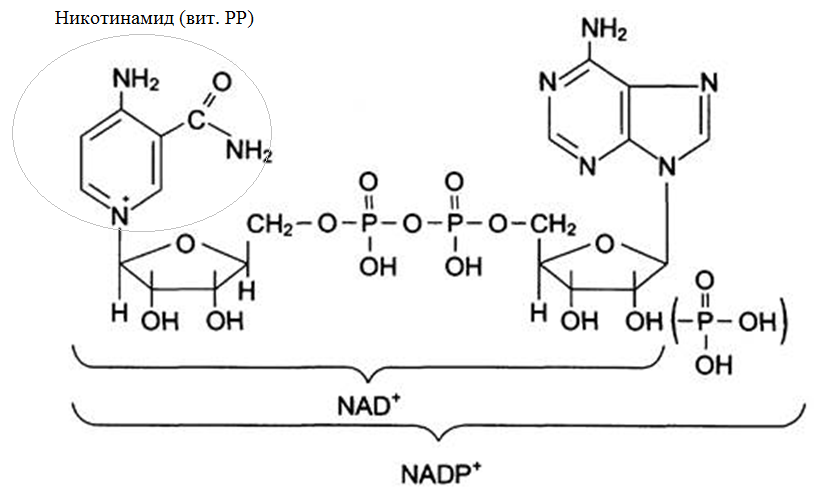
Пример: последовательный механизм р., в реакциях дегидрирования, у ферментов
которых (дегидрогеназ) коферментом являются окисленная и восст. формы НАД+.
Эти реакции сопряжены, но они не идут одна за другой, их связывает только кофермент
В первом случае НАД+ является промежуточным акцептором водорода и
восстанавливается до НАД++ Н+
Во втором случае НАД++ Н+, восстановленный в 1 реакции, будет
использоваться как проежут. донор водорода для обр-я лактата, окисляясь в НАД+
3. Витамин B2 – предшественник коферментов ФМН и ФАД
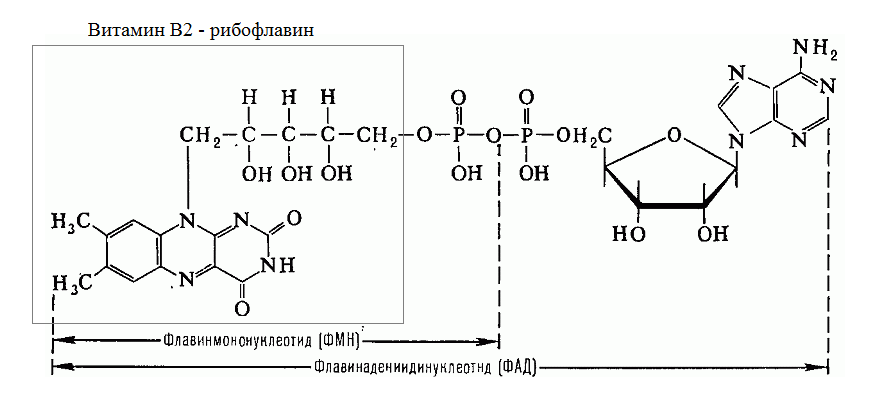
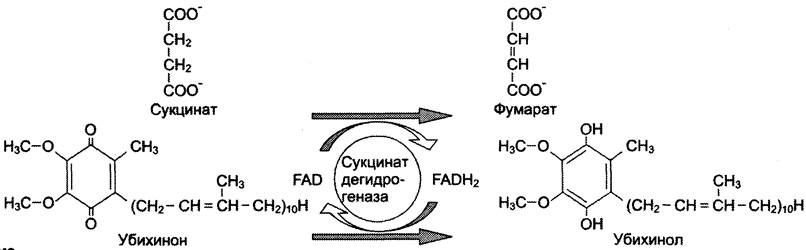
ФМН и ФАД участвуют в ОВР, акцептируя 2е и 2Н+, могут участвовать в реакциях дегидрирования
Пример: сукцинатдегидрогеназная р. с участием кофермента FAD (флавинаденин-
динуклеотид), кот. прочно связан с ферментом, и реакции протекают по механизму «пинг-понг». Первый субстрат – сукцинат, второй – убихинон
Вопрос 18 Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов
Ингибирование ферментативной активности – это снижение каталитической активности ферментов в присутствии определённых веществ – ингибиторов.
В основе действия многих ЛП и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса важно для фармакологии и токсикологии.
По прочности связи с ферментом: обратимое и необратимое ингибирование
По механизму действия: конкурентные и неконкурентные
1. Обратимое ингибирование – ингибиторы связываются с ферментом слабыми
нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
Конкурентное ингибирование: к этому типу относят обратимое снижение
скорости фермент. реакции, вызванное ингибитором, связывающимся с АЦ и препятствующим образованию фермент-субстратного комплекса.
Конкурентный ингибитор – структурный аналог субстрата
В рез-те возникает конкуренция молекул субстрата и ингибитора за место в АЦ фермента.
Либо с ф. взаимод. субстрат, и обр. комплекс фермент-субстрат (ES)
Протекает реакция, образуется продукт: Е + S ⇔ ES → E + P
Либо с ф. взаимод. ингибитор и обр. комплекс фермент-ингибитор (EI).
Тогда р. не протекает и продукт реакции не образуется: E + I ⇔ EI.
Неконкурентное ингибирование – ингибитор взаимодействует с ферментом в
участке, отличном от активного центра.
Неконкурентный ингибитор – не явл. структурным аналогом субстрата
Он может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
2. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается АЦ фермента => фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят: ионы тяж. Ме (Hg2+, Ag+ и As3+), которые в малых конц. блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается.
В больших концентрациях ионы тяж. Ме вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
