
Осмотическое давление раствора
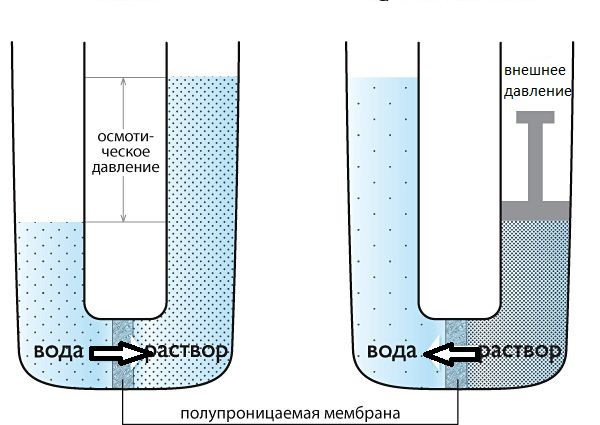
Так, перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Раствор представляет собой гомогенную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объему раствора. Если, например, налить в стакан концентрированный раствор сахарозы, а сверху слой чистой воды, то через некоторое время концентрация молекул сахарозы станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией.

Ввыравнивание концентраций будет происходить только за счет молекул воды, которые в большем количестве диффундируют в раствор, чем обратно. В результате уровень жидкости в трубке повышается, а концентрация раствора уменьшается.
В сосуде с раствором создается давление, под действием которого жидкость поднимается в трубке до тех пор, пока не наступит равновесие между раствором и растворителем (осмос прекращается).
Осмотическим давлением называется то давление, которое необходимо приложить к раствору, чтобы прекратить осмос, т. е. задержать молекулы растворителя от проникновения их в раствор через полупроницаемую мембрану. Осмотическое давление в растворе не существует, оно проявляется только тогда, когда раствор отделен от растворителя полупроницаемой мембраной.
Закон Вант-Гоффа. Сходство в поведении разбавленных растворов неэлектролитов с идеальными газами голландский химик Вант-Гофф выразил в виде закона:
Осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Для количественной характеристики осмотического давления Вант-Гофф воспользовался уравнением газового состояния pV=nRT:
πV = nRT,
где π – осмотическое давление; V – объем раствора; n – число молей растворенного вещества; R – универсальная газовая постоянная; T – абсолютная температура.
Из уравнения найдем
π =
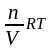 .
.
Но
 ,
где С – концентрация раствора в
моль/л. Тогда
,
где С – концентрация раствора в
моль/л. Тогда
π = СRT.
Закон Вант-Гоффа справедлив для разбавленных растворов электролитов. В концентрированных растворах наблюдаются отклонения от закона Вант-Гоффа, но еще большие отклонения от него дают водные растворы электролитов.
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
π` = i·C·R·T ,
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими. Иными словами изотоническими являются растворы с одинаковым осмотическим давлением. Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Именно осмотическое давление ответственно за поддержание упругости клеток живых организмов, так как клеточная мембрана является полунепроницаемой перегородкой.
Если к раствору, отделенному полунепроницаемой перегородкой приложить давление выше осмотического, то из него будет переходить растворитель. Это явление называется обратным осмосом и используется в технике для опреснения воды.
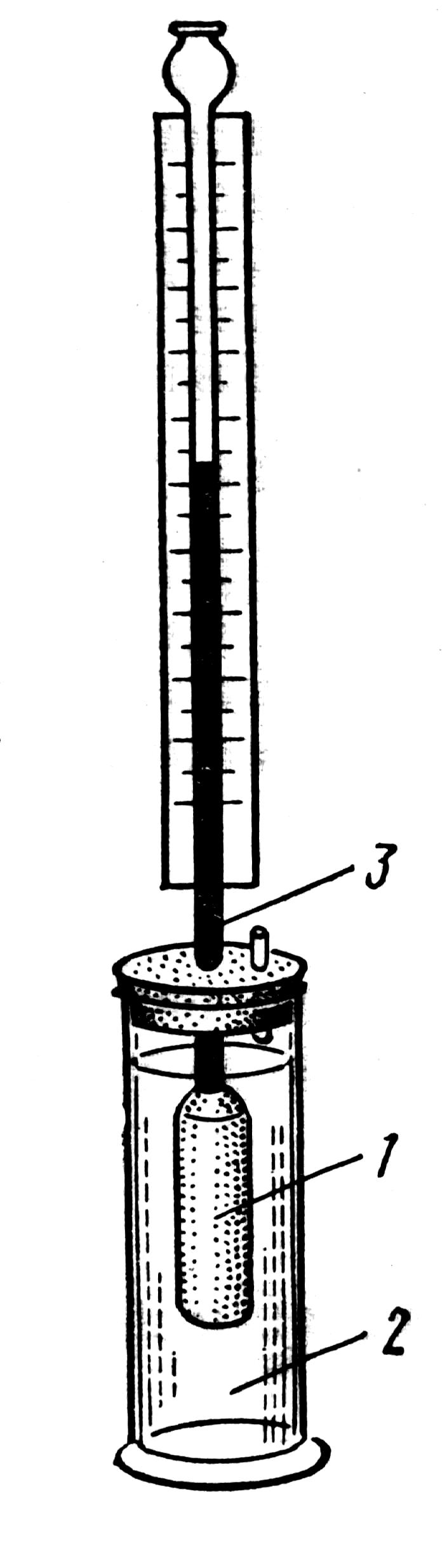
Рис. Схема прибора для
измерения осмотического давления
раствора: 1 – сосуд с
полу-проницаемыми стенками; 2
– сосуд с водой; 3 – трубка
