
теор / Термодинамика и теплопередача, Калинин, Купцов, Лопатин
.pdf
Термодинамика в технологических процессах… |
11 |
Рис. 1.1. Термодинамическая работа обратимого изменения объема в процессе 1 – 2
Разделив правую и левую часть уравнения (1.6) на массу G получим выражение для определения удельной элементарной термодинамической работы обратимого изменения объема δl , Дж/кг
δl = δL = |
p dV |
= p dv . |
(1.7) |
|
|||
G |
G |
|
|
Поскольку термодинамическая работа зависит от пути (вида) процесса, для вычисления интегральных значений полной ( L1,2 ), или удельной (l1,2 ) работы должны
быть заданы уравнения процессов изменения состояния тела в форме, ϕ ( p,V ) = 0
либо его графическое изображение в диаграммах состояния р-V или р-v.
Как следует из соотношений (1.6), (1.7), работа определяется площадью под кривой процесса независимо от вида рабочего тела и его свойств (рисунок 1.1). В силу этого координаты р-V и р-v называются универсальными координатами
работы.
В частном случае для изобарного процесса (p = idem) интегральные значения полной и удельной термодинамической работы определяются по следующим соотношениям:

12 |
Часть 1 |
L1,2 = ∫2 |
p dV = p (V2 −V1) ; |
(1.8) |
1 |
|
|
l1,2 = ∫2 |
p dv = p (v2 − v1 ) . |
(1.9) |
1 |
|
|
Работа расширения считается положительной ( dv > 0 , δl > 0 ), а работа сжатия – отрицательной ( dv < 0, δl < 0).
Эффективная элементарная работа реального процесса δL равна разности обратимой работы δL и работы необратимых потерь δL (δL* =δL−δL ) [3].
Необратимые потери термодинамической работы ( δ L** ) превращаются в теплоту внутреннего теплообмена ( δQ ** ).
Потенциальная (техническая) работа
Потенциальной (технической) работой называется работа по перемещению сплошных масс (газа, пара или жидкости) из области одного давления (p1) в область другого давления (p2), т.е. потенциальная работа – это работа обратимого изменения давления [3, 12].
Элементарная потенциальная работа простого тела определяется из соотношения
δW = −Vdp . |
(1.10) |
Удельная потенциальная работа в элементарном процессе δw определяется по формуле
δw = δW = −vdp . |
(1.11) |
G |
|
Рис. 1.2. Потенциальная работа обратимого изменения давления в процессе 1 – 2
Для определения интегральных значений полной (W1,2 ) или удельной
( w1,2 ) потенциальных работ должны
быть заданы уравнения процесса изменения состояния рабочего тела ϕ(p,V ) = 0 или его графическое изо-
бражение в диаграммах состояния
р-V или р-v.
Как следует из соотношений (1.10), (1.11), потенциальная работа определяется в координатах р-V площадью между кривой процесса и осью абсцисс независимо от вида рабочего тела и его свойств (рисунок 1.2).
Термодинамика в технологических процессах… |
13 |
В частном случае для изохорного процесса (v = idem) интегральные значения полной и удельной потенциальной работы определяются по следующим соотношениям:
W1,2 = − ∫2 |
Vdp = V (p1 − p2 ) ; |
w1,2 = −∫2 vdp = v (p1 − p2 ) . |
(1.12) |
1 |
|
1 |
|
Потенциальная работа считается положительной при снижении давления ( p2 < p1 ) и отрицательной – при повышении давления ( p2 > p1 ).
Эффективная элементарная работа реального процесса δW равна разности обратимой работы δW и работы необратимых потерь δW (δW* =δW−δW ). Необратимые потери потенциальной работы ( δW ** ) превращаются в теплоту внутреннего теплообмена ( δQ ** ).
Термодинамическая работа δL простого тела в замкнутом пространстве и потенциальная работа δW потока непосредственно передаются внешней системе (δLcz или δWcz ) и используются для изменения энергии внешнего положения тела (dEcz)
δL = δLcz + dEcz; δW = δWcz + dEcz . |
(1.13) |
В условиях механических процессов (dEcz=G cЕ dcЕ+G g dz) уравнение распределения термодинамической и потенциальной работ формулируется следующим образом:
|
c |
2 |
|
|
|
|
|
||
δL = δLcz |
+ G d |
|
E |
|
+ G g dz ; |
|
(1.14) |
||
|
|
|
|||||||
|
|
2 |
|
|
|
|
|
||
|
|
|
|
c2 |
|
|
|
||
δW = −Vdp = δWcz + G d |
E |
|
+ G g |
dz , |
(1.15) |
||||
|
|||||||||
|
|
|
|
|
2 |
|
|
|
|
где cE – скорость движения тела, dz – изменение высоты центра тяжести тела
вполе тяготения.
Вреальных процессах уравнение распределения термодинамической и потенциальной работ формулируется следующим образом [3, 16]:
δ L = δ L c z |
+ G d |
|
c |
2 |
|
+ G g d z + δ L ; |
(1.15а) |
|
|
|
E |
|
|||||
2 |
||||||||
|
|
|
|
|
|
|||
|
|
c |
2 |
|
+ G g d z + δ W . |
|
|
δ W = − V d p = δ W cz |
+ G d |
|
E |
|
(1.15б) |
||
2 |
|||||||
|
|
|
|
|
|||
Внутренняя энергия тела
Внутренняя энергия представляет собой полный запас энергии тела и состоит из энергии поступательного и вращательного движения молекул, энергии

14 |
Часть 1 |
внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной энергии.
Внутренняя энергия U является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в джоулях (Дж), а удельная внутренняя энергия (u) – в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р,T; р,v или T,v).
Теплота
Теплота – количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты Q , получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты δQ не является
полным дифференциалом.
Количество теплоты Q измеряется в джоулях (Дж), а удельное количество теплоты q =Q /G в Дж/кг.
Теплоемкость
Истиной теплоемкостью называется количество теплоты, которое надо сообщить единице количества вещества в термодинамическом процессе (z=idem.), чтобы его температура повысилась на 1 градус.
cz |
= δqz . |
(1.16) |
|
dt |
|
Различают массовую теплоемкость с, измеряемую в Дж/(кг К), молярную c – Дж/(кмоль К) и объемную с' – Дж/(м3 К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
|
= c ; |
c′ = ρ c . |
(1.17) |
c |
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме v = idem (изохорная теплоемкость cv) и постоянном давлении p = idem p (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Термодинамика в технологических процессах… |
15 |
Из уравнения (1.16) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
q1,2 = ∫2 cz dt = czm (t2 |
− t1) . |
(1.18) |
|||
|
1 |
|
|
|
|
Отсюда следует выражение для средней теплоемкости газа |
|
||||
czm = |
q1,2 |
= |
1 |
∫2 cz dt . |
(1.19) |
(t2 − t1 ) |
|
||||
|
|
(t2 − t1 ) 1 |
|
||
Для большинства газов и жидкостей значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур изменение истинной теплоемкости подчиняется линейному закону
|
cz = az |
+ bz t . |
|
|
|
(1.20) |
||
Подставив выражение (1.20) в уравнение (1.19), получим |
|
|||||||
czm = |
∫2 (az + bzt) dt |
= az + bz |
|
(t1 + t2 ) |
|
|
||
1 |
|
, |
(1.21) |
|||||
(t2 − t1) |
2 |
|||||||
|
|
|
|
|
||||
где сzm – первая средняя теплоемкость. Она численно равна истинной теплоемкости тела при среднеарифметической температуре процесса.
1.2. Физическое состояние вещества
Различают три агрегатных состояния простых систем: твердое, жидкое и газообразное.
Фазовая диаграмма чистого вещества
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое.
Рассмотрим диаграмму фазовых состояний чистого вещества, которая представлена на рисунке 1.3.
Фазами системы называются области, ограниченные поверхностями раздела. Линии фазовых превращений (испарение – I, плавление – II, сублимации – III) отображают термодинамическое равновесие двухфазных систем и делят диа-
грамму на области различных агрегатных состояний.
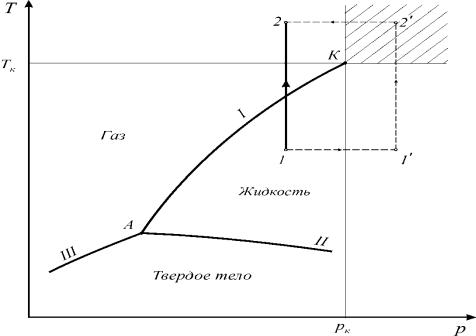
16 |
Часть 1 |
Рис. 1.3. Диаграмма фазовых состояний чистого вещества
На линиях фазовых превращений существует однозначная зависимость между давлением и температурой. Эти линии пересекаются в тройной точке, где вещество одновременно находится в трех агрегатных состояниях. Параметры тройной точки принадлежат к термодинамическим константам вещества.
Энергетической границей между жидкостью и паром является теплота испарения, а между твердым телом и жидкостью – теплота плавления. Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода обозначается символом r .
Наибольший интерес для проведения технических расчетов в термодинамике представляют газ и жидкость. При увеличении давления термодинамическое различие в их свойствах заметно уменьшается и в критической точке исчезает полностью.
Критические параметры являются важнейшими термодинамическими постоянными вещества. Понятие критической температуры введено Д. И. Менделеевым.
Критическая температура Tк – это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление pк – это такое давление, при котором и выше которого жидкость
невозможно перевести в газообразное состояние, а критический объем представляет собой максимальный объем данного количества вещества в жидком состоянии.
Термодинамика в технологических процессах… |
17 |
В закритической области ( p > pк ; T > Tк ) вещество может находиться только
в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии 1−1′ − 2′ − 2 (рисунок 1.3).
Условным признаком непрерывности однофазного состояния вещества является возможность перехода его из любого однофазного исходного состояния в другое однофазное состояние путем непрерывных изменений параметров состояния, минуя фазовые энергетические барьеры.
Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния F(p, v, T) = 0 , описывающее любое однофазное
состояние вещества.
Уравнения состояния
В термодинамических системах в качестве рабочего тела часто рассматривается идеальный газ. Идеальными называются газы, у которых молекулы представляют собой материальные точки и между молекулами отсутствуют силы взаимодействия.
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Уравнением состояния идеального газа является уравнение Клапейрона (1834 г.) для произвольной массы и 1 кг:
pV = GRT ; |
(1.22) |
pv = RT , |
(1.23) |
где R – характеристическая постоянная газа; Т – абсолютная температура газа
T = |
pv |
= t + |
1 |
= (t + 273,15), K . |
(1.24) |
|
α |
||||
|
R |
|
|
||
|
|
|
0 |
|
|
Физический смысл характеристической газовой постоянной можно определить продифференцировав уравнение Клапейрона при постоянном давлении. Получим: δlp = pdv = RdT и отсюда следует
R = |
δlp |
. |
(1.25) |
|
|||
|
dT |
|
|
Это значит, что характеристическая газовая постоянная R – термодинамическая работа 1 кг газа в изобарном процессе (p = idem) при изменении температуры на один градус.

18 |
Часть 1 |
Газовые постоянные для различных тел определяются молярными массами. Умножив на молекулярную массу обе части уравнений (1.22) и (1.23) полу-
чим уравнение Клапейрона – Менделеева
|
|
|
|
|
pV = |
|
|
|
|
|
|
|
|||
|
|
для G |
кмолей газа |
GRT , |
(1.26) |
||||||||||
|
|
для 1 кмоля газа |
|
|
|
|
|
||||||||
|
|
= RT ; |
(1.27) |
||||||||||||
pv |
|||||||||||||||
где |
|
= v – молярный объем, при |
нормальных физических |
условиях |
|||||||||||
v |
|||||||||||||||
(р = 0,1013 МПа и t = 0 оC) v = 22,4 м3/кмоль; R = R = 8314 Дж/(кмоль К) –
универсальная газовая постоянная.
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния [10].
Наиболее простым, качественно отображающим поведение реальных газов
является уравнение состояния Ван-дер-Ваальса |
|
||||
|
a |
(v − b) = RT , |
|
||
p + |
|
|
|
(1.28) |
|
v |
2 |
||||
|
|
|
|
|
|
где a и b – экспериментально полученные константы; a/v2 – поправка на силы молекулярного сцепления; b – поправка на объем молекул.
В технических расчетах используются различные уравнения состояния (раздел 1.15). Одно из простых базируется на уравнении состояния идеального газа с введением поправочного коэффициента z, называемого коэффициентом сжимаемости
pv = zRT . |
(1.29) |
Коэффициент сжимаемости учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Коэффициент сжимаемости является функцией давления, температуры и зависит от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный
Ван-дер-Ваальсом. |
|
|
|
|
|
|
|
|
Принцип «соответственных» состояний утверждает, что критическое со- |
||||||||
стояние действительно является одинаковым для всех веществ. |
|
|
|
|
||||
В критической точке для всех веществ r = 0, |
∂2 p |
= 0 , |
|
∂p |
= 0 , |
|||
|
|
|
|
|
|
|||
|
2 |
|||||||
|
∂T |
|
v |
|
|
∂v v |
|
|
∂2 p |
= 0 . Вещества находятся в соответственных состояниях при одинаковом |
||
|
∂v |
2 |
|
|
T |
|
|
удалении от критической точки.

Термодинамика в технологических процессах… |
19 |
Степень удаления от критической точки определяется с помощью приведенных параметров:
•приведенного давления π = р / рк ;
•приведенной температуры τ = Т /Тк ;
•приведенного объема w = v/vк .
Состояния вещества, в которых они имеют одинаковые π и τ называются соответственными. Зная приведенные давление π и температуру τ по данным рисунка 1.4 можно оценить коэффициент сжимаемости газов.
Рис. 1.4. Зависимость коэффициента сжимаемости углеводородных газов от приведенных параметров
Для более точных оценок коэффициентов сжимаемости газов необходимо использовать специальные таблицы и формулы (раздел 1.15).
Уравнение состояния, записанное в виде F ( w,π,τ ) = 0, называется приведенным уравнением состояния. Оно не содержит индивидуальных констант вещества.

20 |
Часть 1 |
1.3. Смеси жидкостей и газов
Термодинамическая система – объект исследования термодинамики, может представлять собой смесь химически не взаимодействующих между собой чистых веществ.
Предполагается также, что структура отдельных компонентов смеси в процессе смесеобразования и стабилизации смеси не изменяется.
Общие соотношения
Из закона сохранения материи следует, что масса смеси G равна сумме масс составляющих ее компонентов Gi
n |
|
G = ∑Gi , |
(1.30) |
i=1
а число киломолей смеси G равно сумме числа киломолей всех компонентов смеси Gi
n |
|
G = ∑Gi , |
(1.31) |
i=1
где n – число компонентов в смеси.
Одной из важнейших характеристик смеси является ее состав. Он задается массовыми или молярными концентрациями (долями) компонентов.
Массовой концентрацией или массовой долей mi называется отношение мас-
сы компонента к массе всей смеси |
|
|
|
||
m = |
Gi |
= |
Gi |
. |
(1.32) |
|
n |
||||
|
G |
∑Gi |
|
||
i=1
Молярной концентрацией или молярной долей i-го компонента ri называется
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отношение количества киломолей этого компонента Gi |
к общему числу кило- |
|||||||||||||
молей смеси |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
r = |
Gi |
= |
Gi |
. |
(1.33) |
|||||||||
|
|
|
|
|||||||||||
|
||||||||||||||
i |
|
|
|
|
|
n |
|
|||||||
|
G |
|
∑ |
|
i |
|
||||||||
|
|
G |
|
|||||||||||
i=1
Очевидно, что для термодинамических смесей справедливы следующие соотношения:
n
∑mi =1,
i=1
n |
|
∑ri =1. |
(1.34) |
i=1
