
теор / Термодинамика и теплопередача, Калинин, Купцов, Лопатин
.pdf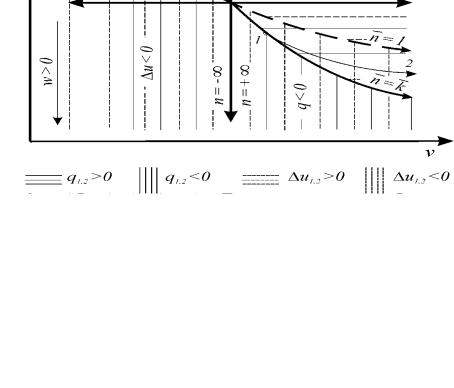
Термодинамика в технологических процессах… |
41 |
Рис. 1.10. Процессы изменения состояния идеального газа

Термодинамика в технологических процессах… |
42 |
Термодинамика в технологических процессах… |
43 |

44 |
Часть 1 |
Термодинамика в технологических процессах… |
45 |
Процессы изменения состояния идеального газа |
|
При изучении процессов изменения состояния идеальных газов, |
наряду |
с общими соотношениями по расчету термодинамических процессов (1.92) – (1.134), следует использовать уравнение Клапейрона (1.23) и закон Джоуля (1.77), в соответствии с которыми для идеального газа справедливы следующие выражения:
если pv = idem , то T = idem ; |
(1.135) |
h = u + pv = u + RT = h(T ) ; |
(1.136) |
du = cvdT ; |
(1.137) |
dh = cpdT . |
(1.138) |
Из уравнений (1.135)÷(1.138) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетический (u= idem) и изоэнталыпийный (h = idem) тождественны и, следовательно, показатели этих процеcсов равны
npv = nT = nu = nh = 1. |
(1.139) |
Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур
τ = |
p2v2 |
= |
T2 |
. |
(1.140) |
|
|||||
1,2 |
p1v1 |
|
T1 |
|
|
|
|
|
|||
Изменения удельных значений внутренней энергии и энтальпии идеального газа в процессе в соответствии с законом Джоуля находится по следующим формулам:
u1,2 |
= cvm (T2 |
− T1 ); |
(1.141) |
h1,2 |
= cpm (T2 |
−T1). |
(1.142) |
Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
|
δw |
|
|
∂h |
|
|
cp |
|
|
|
p |
|
|
|
|
|
|
|
c |
. |
(1.143) |
||||||||
k = ns = |
|
|
= |
|
|
= |
|
= |
|
|
|
|
||
|
|
|
|
|
|
|
||||||||
|
δl |
δq=0 |
|
∂u |
δq=0 |
|
c |
|
|
c |
|
|
|
|
|
|
|
|
|
v |
|
|
v |
|
|
||||

46 |
Часть 1 |
На основании закона Майера (cp − cv = R ) показатель адиабаты для идеального газа может быть определен из следующего соотношения:
k = |
|
c |
p |
= |
|
c |
v |
+ |
R |
|
= 1+ |
|
|
R |
|
>1. |
(1.144) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
||||||||||||||||
|
|
cv |
|
|
|
cv |
|
|
|
cv |
|
||||||||
Для идеального газа показатель изоэнергетического процесса nu =1 и поэто-
му удельное количество теплоты в элементарном процессе может быть определено по формуле
δq = |
k − n |
δl . |
(1.145) |
|
k −1 |
||||
|
|
|
На примере идеального газа произведем анализ термодинамических процессов (рисунок 1.10).
Адиабата (δq = 0) является линией перемены знака теплообмена. При расши-
рении газа термодинамическая работа δl > 0 и тогда любая политропа, расположенная правее адиабаты (n < k), находится в области подвода теплоты ( δ q > 0). Если политропа расширения будет находиться слева от адиабаты (n > k), то этот процесс будет характеризоваться отводом теплоты ( δ q < 0).
Таким образом, все термодинамические процессы, проходящие выше адиабаты, осуществляются с подводом теплоты и наоборот.
1.6. Круговые процессы (циклы)
Тепловые машины
Тепловыми машинами в термодинамике называются тепловые двигатели и холодильные машины. Все тепловые машины работают циклически.
Круговыми процессами или циклами тепловых машин называются замкнутые процессы, характеризующиеся возвратом системы (рабочих тел) в исходное состояние.
Различают прямые (циклы тепловых двигателей) и обратные (циклы холодильных машин) круговые процессы (рисунок 1.11).
Поскольку в результате кругового процесса система (рабочее тело) возвращается в исходное состояние, т.е. возвращаются в исходное состояние все параметры состояния, интегральное изменение любой функции состояния системы будет равно нулю
∫dz = 0, |
(1.146) |
где z =p; V(v); Т; U(и); H(h) и т.п.
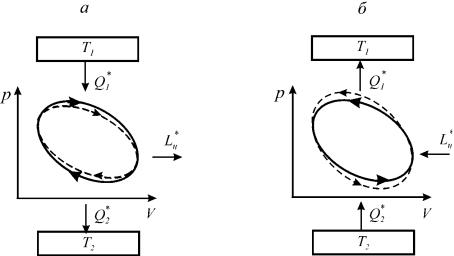
Круговые процессы, в результате реализации которых получена полезная работа, осуществляются в тепловых двигателях, называются прямыми циклами и в координатах p −V, T − s, h − s направлены по часовой стрелке (рисунок 1.11а).

Термодинамика в технологических процессах… |
47 |
Рис. 1.11. Прямой (а) и обратный (б) циклы тепловых машин
Круговые процессы, в результате которых происходит охлаждение рабочих тел до температуры ниже температуры окружающей среды, осуществляются в холодильных машинах. Такие циклы называются обратными и направлены против часовой стрелки (рисунок 1.11б).
Выражение первого начала термодинамики по внешнему балансу для цикла записывается в следующем виде:
∫δQ* = ∫dU + ∫δL* . |
(1.147) |
В связи с тем, что для цикла ∫dU = 0, получаем следующее выражение первого начала термодинамики для цикла
∫δQ* = ∫δL* . |
(1.148) |
Циклы тепловых машин состоят из отдельных конечных процессов: нагрева, расширения, отвода теплоты и сжатия рабочего тела. Если на графике цикла добавить две касательные адиабаты 1–2 и 3–4, то можно получить границы процессов подвода и отвода теплоты (рисунок 1.11). Подвод теплоты происходит в процессе C-A-D в прямом цикле и в процессе D-B-C в обратном цикле. Процессы, сопровождающиеся отводом теплоты – это процесс D-B-C в прямом цикле и процесс C-A-D в обратном цикле.

48 |
Часть 1 |
Интегральное значение количества теплоты, получаемое рабочим телом в цикле ( ∫δQ* ), и работа в цикле (∫δL* ) могут быть представлены в виде сле-
дующих соотношений:
∫δQ* =Q1* −Q2* ; |
(1.149) |
∫δL* = L*ц = L*расш − L*сж . |
(1.150) |
С учетом соотношений (1.149), (1.150) выражение первого начала термодинамики по внешнему балансу для цикла записывается в следующем виде:
Q* −Q* = L* |
. |
(1.151) |
||
1 |
2 |
ц |
|
|
В циклах тепловых двигателей работа положительна ( L*ц > 0 ), а в циклах холодильных машин – работа цикла отрицательна ( L*ц < 0 ); при этом для них справедливо условие Q1* > Q2* .
Различают три вида циклов тепловых машин: обратимые, термодинами-
ческие и реальные.
В обратимых циклах тепловых машин отсутствует внешняя и внутренняя
необратимости.
В термодинамических циклах тепловых машин, в отличие от обратимых циклов, рассматривается не вся система, включающая внешние источники теплоты, а только рабочее тело. При этом в процессах термодинамических циклов отсутствует внутренняя необратимость, то есть все процессы таких циклов являются обратимыми (δQ = δL = 0 ).
В реальных циклах тепловых машин имеют место внешняя и внутренняя
необратимости.
Внешняя необратимость определяется конечной разностью температур между рабочим телом и источниками теплоты. Этим объясняется то, что реальный цикл теплового двигателя располагается внутри границ температур внешних источников, а реальный цикл холодильной машины – вне границ температур внешних источников (рисунок 1.12).
Внутренняя необратимость обусловлена потерями энергии, связанными с трением, завихрениями и т.д. в процессах цикла.
Эффективность любого цикла теплового двигателя определяется коэффициентом полезного действия (КПД).
Коэффициент полезного действия обратимого цикла теплового двигателя численно равен отношению полученной работы к подведенному количеству теплоты и определяется следующим образом:
η = |
|
|
Lц обр |
|
. |
(1.152) |
|
|
|||||
|
|
|
|
|||
обр |
|
Q1 обр |
|
|
|
|
|
|
|
|
|
|
|
Термодинамика в технологических процессах… |
49 |
Рис. 1.12. Термодинамические схемы теплового двигателя (а) и холодильной машины (б): – обратимый цикл,
– обратимый цикл,  – реальный цикл
– реальный цикл
Термический коэффициент полезного действия термодинамического цикла теплового двигателя находится из соотношения
ηt |
= |
|
Lц |
= |
|
|
Q1 |
|
|
− |
|
|
Q2 |
|
|
= 1− |
|
|
|
Q2 |
|
|
|
|
. |
(1.153) |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
Q1 |
|
|
|
|
|
|
Q1 |
|
|
|
|
|
|
Q1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Коэффициент полезного действия реальных циклов тепловых двигателей численно равен отношению полученной работы к подведенному извне количеству теплоты
|
|
|
L* |
|
|
|
Q* |
− |
Q* |
|
|
|
|
Q* |
|
|
|
|
|
η = |
|
|
ц |
|
|
= |
1 |
|
|
2 |
|
=1− |
|
|
2 |
|
|
. |
(1.154) |
|
|
|
|
|
|||||||||||||||
|
|
* |
|
|
|
* |
|
|
|
|
|
* |
|
|
|||||
|
|
|
|
|
|
||||||||||||||
|
|
|
Q1 |
|
|
|
|
Q1 |
|
|
|
|
|
|
Q1 |
|
|
|
|
Эффективность циклов холодильных машин оценивается холодильным коэффициентом χ . Холодильный коэффициент численно равен отношению коли-
чества теплоты, отводимой от холодного источника, к затраченной работе.
Для реального цикла холодильной машины холодильный коэффициент определяется соотношением
|
|
|
Q* |
|
|
|
|
Q |
|
|
|
χ = |
|
|
2 |
|
= |
|
2 |
|
, |
(1.155) |
|
|
|
|
|
|
|
||||||
|
|
L* |
|
Q |
− |
Q |
|||||
|
|
|
|
|
|
||||||
|
|
ц |
|
|
1 |
|
|
2 |
|
|
|
50 |
Часть 1 |
для обратимого цикла холодильной машины
χобр = |
|
|
Q2обр |
|
|
= |
|
|
Q2обр |
|
|
, |
(1.156) |
||
|
|
|
|
||||||||||||
|
|
Lц обр |
|
|
Q1обр |
− |
Q2обр |
||||||||
|
|
|
|
|
|
|
|
||||||||
а для термодинамического цикла холодильной машины
|
|
|
Q |
|
|
|
Q2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
χt |
= |
|
2 |
|
= |
|
|
|
. |
(1.157) |
|
Lц |
|
Q1 |
− |
Q2 |
|||||
|
|
|
|
|
|
|
При механическом сопряжении обратимых теплового двигателя и холодильной машины, соблюдая равенство абсолютных значений работ цикла, подводимой и отводимой теплоты, можно получить математическое условие обратимости цикла
χобр = |
Q2обр |
= |
Q1обр |
− |
Lц обр |
= |
|
Q1обр |
|
−1 = |
1 |
−1 |
(1.158) |
||
Lц обр |
|
Lц обр |
|
|
Lц обр |
|
ηобр |
||||||||
или |
|
|
ηобр = (χобр +1)=1. |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
(1.158а) |
||||||||
Особое значение в термодинамике играет цикл Карно, являющийся основой теории тепловых машин.
Цикл Карно
Французский инженер Сади Карно в 1824 г. предложил обратимый цикл тепловой машины, рабочим телом в котором является идеальный газ. Цикл Карно осуществляется между двумя внешними источниками постоянных температур Т1 и Т2 и состоит из двух адиабат и двух изотерм (рисунок 1.13).
Подвод теплоты от горячего источника производится на изотерме А-В при температуре Т1, при этом рабочее тело – идеальный газ расширяется и совершается полезная работа. В процессе дальнейшего расширения по адиабате В-С до температуры Т2 также совершается полезная работа. Для осуществления последующих процессов – сжатия C-D по изотерме Т2 с отводом теплоты к холодному источнику и адиабатного сжатия D-A до начальной температуры Т1 работа затрачивается.
В силу того, что в цикле используется идеальный газ, для которого ранее было установлен принцип существования энтропии, этот цикл можно также изобразить и в координатах T-S (рисунок 1.13б).
Графически цикл Карно в T-S координатах представляет собой прямоугольник, так как изотермы и адиабаты в этих координатах изображаются прямыми линиями.
