
теор / Термодинамика и теплопередача, Калинин, Купцов, Лопатин
.pdf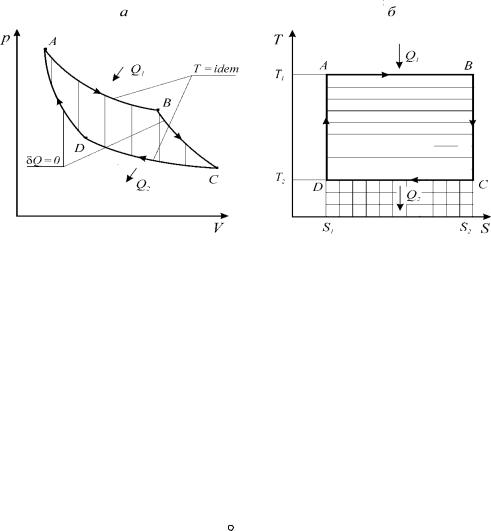
Термодинамика в технологических процессах… |
51 |
Рис. 1.13. Цикл Карно для теплового двигателя
Согласно принципу существования энтропии для идеальных газов (1.88) интегральные количество подведенной и отведенной теплоты в цикле Карно может быть определено из следующих соотношений:
|
|
|
B |
B |
|
|
Q1 |
|
= ∫T1dS = T1∫dS = T1 (SB − SA ); |
(1.159) |
|
|
|
||||
|
|
|
|||
AA
|
|
|
C |
C |
|
|
Q2 |
|
= ∫T2dS = T2 ∫dS = T2 (SC − SD ) . |
(1.159а) |
|
|
|
||||
|
|
|
|||
DD
Для замыкания цикла необходимо, чтобы итоговое изменение энтропии (как функции состояния) в цикле было равно нулю
∫dS = 0, |
(1.160) |
следовательно |
|
SB − SA = SC − SD = S2 − S1 = S . |
(1.161) |
Количества подведенной и отведенной теплоты равны соответственно:
|
|
|
|
|
|
|
|
Q1 |
|
|
|
= T1 |
S , |
(1.162) |
||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
Q2 |
|
|
= T2 |
S , |
(1.163) |
|||||
|
|
|
|
|
|
|
|
|
||||||||||
а работа цикла составляет |
|
|
|
|
|
|
|
|||||||||||
|
Lц |
|
= |
|
Q1 |
|
− |
|
Q2 |
|
= (T1 − T2 ) S . |
(1.164) |
||||||
|
|
|
|
|
|
|||||||||||||
52 |
Часть 1 |
Согласно определению КПД термодинамического цикла тепловых двигателей (1.153) выражение коэффициента полезного действия цикла Карно можно представить в следующем виде:
K |
|
|
Lц |
|
(T − T ) S |
|
T |
|
|||
ηt |
= |
|
|
|
= |
1 |
2 |
= 1− |
2 |
. |
(165) |
|
Q1 |
|
T1 |
|
|
||||||
|
|
|
|||||||||
|
|
|
|
|
S |
|
T1 |
|
|||
Соответственно, холодильный коэффициент обратного цикла Карно для холодильной машины определяется соотношением
χtK = |
|
T2 |
. |
(1.166) |
|
|
|||
T1 |
− T2 |
|
||
Полученные соотношения (1.165) и (1.166) свидетельствуют о том, что КПД и холодильный коэффициент обратимого цикла Карно зависят только от соотношения абсолютных температур горячего Т1 и холодного Т2 источников теплоты.
Анализ соотношения (1.165) показывает, что КПД цикла Карно возрастает с увеличением температуры горячего и при понижении температуры холодного источников.
Цикл Карно для теплотехники имеет большое значение. Он позволяет определить наивысшее значение термодинамического КПД теплового двигателя, работающего в диапазоне значений температуры рабочего тела в процессах подвода Т1 и отвода T2 теплоты.
При этом цикл Карно является эталоном: с КПД цикла Карно сравнивают КПД циклов реальных тепловых двигателей и определяют их термодинамическое совершенство.
1.7. Второе начало термодинамики
Как отмечалось выше, первое начало термодинамики представляет собой количественное выражение закона сохранения и превращения энергии, оно позволяет составить энергетический баланс исследуемых процессов, но не определяет направление их протекания.
Условия осуществления и направленности протекания процессов определяются на основании второго начала термодинамики.
В совокупности первое и второе начало термодинамики являются фундаментом в построении теории тепловых машин и технической термодинамики в целом.
Второе начало классической термодинамики обычно формулируется как объединенный принцип существования и возрастания некоторой функции состояния тел и сложных систем, названной энтропией.
Термин энтропия предложен Р. Клаузиусом: еn – в, внутрь и trope или tropos – обращение, путь; в целом – обращение внутрь, мера обесценения энергии.
Термодинамика в технологических процессах… |
53 |
Математическое выражение второго начала классической термодинамики может быть представлено в виде следующего выражения:
dSизол = δQ ≥ 0 . |
(1.167) |
T |
|
Н.И. Белоконь справедливо заметил, что принципы существования и возрастании энтропии различны по содержанию и значимости и предложил рассматривать эти принципы раздельно [3].
Принцип существования энтропии справедлив для равновесных термодинамических систем и распространяется на любые процессы – обратимые и необратимые.
Принцип существования энтропии и абсолютной температуры как термодинамических функций состояния равновесных систем, по терминологии проф. Н.И. Белоконь, был назван вторым началом термостатики.
Принцип возрастания энтропии характеризует только наиболее вероятное направление течения реальных процессов и, следовательно, имеет, несомненно, меньшую область применения, чем принцип существования энтропии.
Принцип возрастания энтропии изолированных систем при протекании в них реальных процессов Н.И. Белоконь назвал вторым началом термодинамики.
Второе начало термостатики
В качестве постулата второго начала термостатики используется утверждение, что «температура есть единственная функция состояния, определяющая
направление самопроизвольного теплообмена».
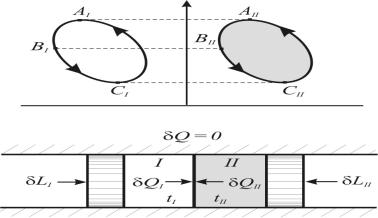
Для вывода математического выражения второго начала термостатики рассмотрим адиабатно изолированную систему, состоящую из термически сопряженных тел (рисунок 1.14).
Первое тело (I) – любое тело (например, реальный газ), совершает произвольные процессы – обратимые и необратимые, второе тело (II) – контрольное тело – идеальный газ, совершает обратимый круговой процесс.
Оба тела в каждый момент имеют одинаковую температуру tI = tII = t.
Рис. 1.14. Адиабатно изолированная система двух термически сопряженных тел

54 |
Часть 1 |
Первое и второе тело осуществляют разнообразные процессы изменения состояния, к ним извне подводится (или отводится) работа, между телами происходит теплообмен, но для адиабатно изолированной системы выполняется обязательное условие
δQ = δQI + δQII = 0 . |
(1.168) |
Разделим уравнение (1.168) на некоторую функцию, зависящую только от температуры τ(t). Для идеального газа эта функция равна абсолютной температуре τ(tII) = TII . С учетом равенства температур двух тел получаем
δQI |
+ |
δQII |
= 0 . |
(1.169) |
τ(tI ) |
τ(tII ) |
Так как тела I и II возвращаются в исходное состояние одновременно (согласно теореме теплового равновесия тел в равновесных круговых процессах) последнее уравнение можно интегрировать по замкнутому контуру
∫ |
δQI |
+ ∫ |
δQII |
= 0. |
(1.170) |
|
τ(tI ) |
τ(tII ) |
|||||
|
|
|
|
Второй интеграл по замкнутому контуру для идеального газа, как интеграл функции состояния, равен нулю
∫ |
δQII |
= ∫dSII = 0. |
(1.171) |
|
τ(tII ) |
||||
|
|
|
Поэтому и первый круговой интеграл в уравнении (1.171) также равен нулю
∫ |
δQI |
= 0 . |
(1.172) |
τ(tI ) |
Если круговой интеграл равен нулю, то это значит, что подынтегральное выражение представляет из себя полный дифференциал некоторой функции состояния, названной энтропией ( S ), а функция τ(tI) является интегрирующим делителем
δQI |
= |
δQI |
= dSI . |
(1.173) |
τ(tI ) |
TI |
Так как тело I – любое тело и свойства тел I и II независимы, полученное выражение (1.173) распространяется на все равновесные процессы изменения состояния любых систем.
Выбранная функция τ(t), которая не зависит от вида тел, называется абсолютной температурой τ(t)= Т, а температурная шкала называется абсолютной термодинамической.
Термодинамика в технологических процессах… |
55 |
Таким образом, получаем математическое выражение второго начала термостатики – принципа существования энтропии и абсолютной температуры для любых равновесных систем
dS = |
δQ |
= |
δQ* + δQ** |
|
(1.174) |
TT
и для 1 кг системы
ds = |
δq |
= |
δq* + δq** |
|
|
|
|
. |
(1.175) |
||
|
|
||||
TT
Второе начало термостатики утверждает принцип существования энтропии и абсолютной температуры как функции состояния любой равновесной термодинамической системы, совершающей обратимые или необратимые процессы.
Следствия второго начала термостатики
Следствия второго начала термостатики широко применяются в термодинамических расчетах и формулируются на основе анализа его математического выражения (1.174), (1.175).
Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ
du |
|
T ds=cv dT+ |
|
dv T
+ p dv
|
dh |
|
dp . |
(1.176) |
|
=cp dT+ |
|
|
− v |
||
|
|||||
dP T |
|
|
|
||
Следствие II. Координаты Т – S являются универсальными координатами термодинамического теплообмена.
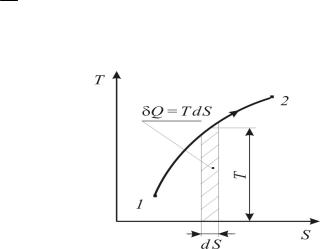
Рассмотрим термодинамический процесс 1-2 в координатах Т-S и выделим на нем элементарный участок с температурой Т и изменением энтропии dS (рисунок 1.15).
Исходя из математического выражения второго начала термостатики площадь под кривой элементарного участка процесса равна подводимому (отводимому) количеству теплоты
δQ = T dS. |
(1.177) Рис. 1.15. Термодинамический процесс |
|
в координатах T-S |
При этом полное количество теплоты, подведенной или отведенной от системы в процессе 1-2, определяется следующим образом:

56 |
Часть 1 |
2 |
|
Q1,2 = ∫T dS . |
(1.178) |
1 |
|
Если из-под знака интеграла в соотношении (1.178) вынести среднюю температуру конечного процесса Tm , то количество теплоты в процессе может быть определено по соотношению
Q1,2 = Tm (S2 – S1). |
(1.179) |
Как видно из выражения (1.179) и рисунка 1.16, знак теплообмена определяется знаком изменения энтропии. Процессы, протекающие с увеличением энтропии, сопровождаются подводом теплоты. Процессы, протекающие с уменьшением энтропии – отводом теплоты. Независимо от природы рабочего тела площадь под кривой процесса в координатах Т-S равна количеству подведенной или отведенной теплоты.
Рис. 1.16. Теплообмен в термодинамических процессах
Следствие III. Адиабатный процесс является процессом изоэнтропийным. Так как в адиабатном процессе теплообмен отсутствует (δQ = 0), то, соглас-
но второму началу термостатики (1.174), в таком процессе изменение энтропии dS = 0 (S = idem). Согласно этому следствию, показатель адиабатного процесса k равен показателю изоэнтропийного процесса ns
k = ns . |
(1.180) |
Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.

Термодинамика в технологических процессах… |
57 |
Рассмотрим термодинамические циклы в координатах Т-S: прямой цикл (цикл теплового двигателя) 1-А-2-В-1 (а) и обратный цикл (цикл холодильной машины) 1-А-2-B-1 (б) (рисунок 1.17).
В процессе 1-А-2 теплота подводится к рабочему телу. Количество подводимой теплоты соответствует на диаграмме горизонтально заштрихованной площади. Вертикально заштрихованная площадь соответствует количеству отведенной теплоты от рабочего тела в процессе 2-В-1.
Рис. 1.17. Прямой и обратный циклы в координатах Т-S
Средние температуры рабочего тела в процессах подвода и отвода теплоты в цикле теплового двигателя обозначим Тm1 и Тm2 соответственно (рисунок 1.17а). Согласно выражению (1.179), количества подведенной и отведенной теплоты определяется по следующим соотношениям:
2 |
|
|
|
Q1 = ∫TdS = Tm1 (S2 |
– S1) = Tm1 |
S1,2 ; |
(1.181) |
1 |
|
|
|
2 |
|
|
|
Q2 = ∫TdS = Tm2 (S2 |
– S1) = Tm2 |
S1,2 , |
(1.182) |
1 |
|
|
|
а коэффициент полезного действия любого термодинамического цикла теплового двигателя может быть найден из выражения
ηt =1− |
|
|
Q |
|
|
Tm2 |
S1,2 |
|
|
T |
|
|||
|
|
|
|
|
|
|
||||||||
|
2 |
|
|
= 1− |
|
|
|
|
=1 – |
m2 |
. |
(1.183) |
||
|
|
Q1 |
|
|
Tm1 |
|
|
|
|
|||||
|
|
|
|
|
|
|
S1,2 |
|
|
Tm1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В результате аналогичных рассуждений получаем выражение для определения холодильного коэффициента термодинамического цикла холодильной машины (рисунок 1.17б)
58 |
Часть 1 |
χt = |
|
|
|
|
Q |
|
|
|
Tm2 |
S1,2 |
|
|
|
T |
|
|||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
m2 |
|
||||
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
= |
|
. |
(1.184) |
|||
|
Q1 |
|
− |
|
Q2 |
|
(Tm1 − Tm |
2 ) |
|
|
S1,2 |
|
Tm1 − Tm2 |
|||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полученные выражения (1.183), (1.184) свидетельствуют о том, что КПД и холодильный коэффициент термодинамических циклов тепловых машин определяются только средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.
Из уравнений (1.183), (1.184) следует также, что для любого термо-дина- мического цикла тепловых машин выполняется следующее соотношение:
ηt (χt +1) = 1) . |
(1.185) |
Следствие V. Коэффициент полезного действия и холодильный коэффициент цикла Карно всегда выше этих коэффициентов эффективности для любых других термодинамических циклов тепловых машин, осуществляемых в одинаковом диапазоне предельных температур рабочего тела (T1, T2 ).
Это следствие вытекает из анализа соотношений по определению КПД цикла Карно (1.165) и любого термодинамического цикла (1.183) теплового двигателя.
Вследствие того, что Т1 >Тm1 и Т2 < Тm2 (рисунок 1.17а), |
|
ηtK > ηt . |
(1.186) |
Аналогичный вывод можно сделать и при сравнении холодильных коэффициентов обратных циклов
χtK > χt . |
(167) |
Рассматриваемое следствие утверждает, что цикл Карно является эталонным циклом, по сравнению с которым можно определить термодинамическое совершенство любого цикла, осуществляемого в заданном интервале предельных значений температур рабочего тела.
Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии).
Количество теплоты, полученное в элементарном процессе системой, состоящей из r тел, можно определить из соотношения
|
|
|
r |
|
|
|
|
|
δQ = ∑δQi , |
|
(1.188) |
||
|
|
|
i=1 |
|
|
|
что и подтверждает справедливость сформулированного следствия |
|
|||||
|
1 |
r |
r |
r |
|
|
dS = δQ = |
∑δQi |
= ∑δQi |
= ∑dSi . |
(1.189) |
||
|
||||||
T T i=1 |
i=1 T |
i=1 |
|
|||
Термодинамика в технологических процессах… |
59 |
Второе начало термодинамики и его следствия
Все явления природы, связанные с превращением энергии имеют необратимый характер. Обобщающим законом необратимости процессов в природе является принцип возрастания энтропии изолированных систем. В основу второго начала термодинамики положен постулат, утверждающих необратимость реальных процессов и имеющий ряд равнозначных формулировок:
•теплота не может самопроизвольно передаваться от холодного тела к более нагретому (Р. Клаузиус, 1850 г.);
•невозможно построить периодически действующую машину, вся деятельность которой сводилась бы к выполнению механической работы и охлаждению теплового источника (В. Томсон – Кельвин, 1852 г.);
•любой реальный самопроизвольный процесс является необратимым (М. Планк, 1922 г.);
•работа может быть непосредственно и полностью превращена в теплоту путем трения или электронагрева.
Эти формулировки подчеркивают специфичность теплоты при ее превращениях. В теплоту полностью превращаются все виды энергии.
Превращения же теплоты всегда сопровождаются процессами, компенсирующими эти превращения. В тепловом двигателе такой компенсацией является передача некоторой части теплоты источнику низшей температуры (холодному источнику); в холодильных машинах такой компенсацией являются затраты работы.
Анализ различных формулировок постулата второго начала термодинамики приводит к некоторым весьма важным следствиям.
Следствие I. Невозможно осуществление полного превращения теплоты работу, т.е. нельзя создать вечный двигатель второго рода (Perpetuum mobile II рода) с коэффициентом полезного действия равным единице.
Это следствие вытекает из постулата в формулировке Томсона-Кельвина, согласно которой всякий тепловой двигатель должен иметь как минимум два источ-
ника теплоты с различной температурой Т1 и Т2. Следовательно, всегда Q2* > 0 и поэтому
|
|
|
* |
|
|
|
|
η = 1− |
|
|
Q2 |
|
|
<1. |
(1.190) |
|
|
||||||
|
|
* |
|
|
|||
|
|
|
Q1 |
|
|
|
|
Следствие II. КПД реального теплового двигателя и холодильный коэффициент реальной холодильной машины, в которых осуществляются циклы при температурах внешних источников Т1 и Т2, всегда меньше КПД и холодильного коэффициента обратимых тепловых машин, циклы в которых осуществляются между теми же внешними источниками:
η < ηобр ; χ < χобр . |
(1.191) |
60 |
Часть 1 |
Снижение КПД и холодильного коэффициента реальных тепловых машин по сравнению с ηобр и χобр обратимой тепловой машины обусловлено прямым превращением части работы в теплоту (необратимые потери работы) и наличием конечной разности температур между внешними источниками теплоты и рабочим телом.
Следствие III. Абсолютный нуль по термодинамической абсолютной шкале температур (шкала Кельвина) недостижим (T ≠ 0 K ).
Это следствие вытекает из анализа соотношения по определению КПД цикла Карно (1.165) и постулата второго начала термодинамики в формулировке Том- сона-Кельвина.
Поскольку КПД любого теплового двигателя и даже работающего по эталонному циклу Карно всегда меньше 1
ηtК = 1− |
T2 |
<1, |
(1.192) |
|
T1 |
||||
|
|
|
и в случае, если горячий источник теплоты имеет положительную температуру по термодинамической абсолютной шкале температур (T1 > 0 ), справедливо утверждение
T2 > 0 . |
(1.193) |
Математическое выражение второго начала термодинамики
Наиболее наглядно принцип возрастания энтропии доказывается на основе изучения круговых процессов тепловых машин.
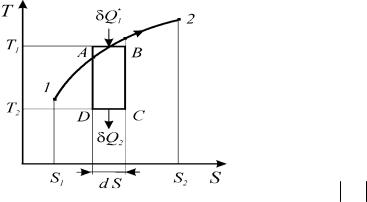
Рассмотрим реальный процесс 1-2 на диаграмме Т-S (рисунок 1.18). Выделим на кривой процесса эле-
ментарный участок А-В и к нему добавим три обратимых процесса: адиабату расширения В-С, изотерму отвода теплоты С-D и адиабату сжатия D-А.
Полученный цикл А-В-С-D, в целом, необратим из-за реального процесса 1-2, а следовательно его КПД меньше, чем у цикла Карно
η = 1− |
|
|
δQ2 |
|
|
≤1− |
T2 |
. (1.194) |
|
|
|
|
|||||
|
|
|||||||
|
|
δQ* |
|
|
T |
|||
|
|
|
|
|
|
|
||
|
|
1 |
1 |
|
||||
Рис. 1.18. К доказательству второго начала термодинамики
В выражении (1.194) справедлив знак неравенства, если рассматриваемый цикл (А-В-С-D) необратим, и знак равенства, если рассматривается обратимый цикл.
