
Биоинженерия / Polioxialkanoaty_POA__biorazrushaemye_polimery_dlya_meditsiny
.pdf
аспектам биотехнологии и материаловедения полиоксиалканоатов сотрудничает с Институтом физики им. Л. В. Киренского СО РАН, Институтом химии и химической технологии СО РАН, Красноярским государственным университетом, Сибирским технологическим университетом, НИИ ортопедии и медицинского материаловедения Томского научного центра СО РАМН, Научно-исследовательским Институтом трансплантологии и искусственных органов МЗ РФ, Гематологическим научным центром РАМН, Институтом микробиологии Мюнстерского университета (Германия), Лабораторией мембранной технологии университета Страйкланда (Великобритания) и другими.
2.2. Разнообразие полиоксиалканоатов
После открытия в 1974 г. в активном иле полимера, отличающегося по структуре и свойствам от известного полиоксибутирата (Wallen, Rohwedder, 1974), были развернуты широкие исследования по выявлению новых полиоксиалканоатов, изучению условий их синтеза и свойств. К настоящему времени известно более 100 различных по структуре полимеров, синтезируемых природными, а также генетически модифицированными микроорганизмами. Этому направлению исследований уделяется большое внимание в связи с тем, что даже при незначительном изменении соотношения мономерных единиц в ПОА могут принципиальным образом изменяться их свойства, в том числе термомеханические, что является важным для практики.
Наиболее полное представление о разнообразии полиоксиалканоатов дано в обзоре Стейнбухеля и Валентина (Steinbüchel, Valentin, 1995b), в котором собраны данные об известных типах ПОА, механизме их образования и природе микроорганизмов-продуцен- тов. Среди охарактеризованных к настоящему времени полиоксиалканоатов выделено несколько групп полимеров (таблица 2.1).
Основные структуры полиоксиалканоатов можно иллюстрировать следующим образом (Lee, 1996a):
n = 1 R = водород |
– поли (3-гидроксипропионат), |
R = метил |
– поли (3-гидроксибутират), |
R = этил |
– поли (3-гидроксивалерат), |
R = пропил |
– поли (3-гидроксигексаноат), |
R = пентил |
– поли (3-гидроксиоктаноат), |
50
|
R = нонил |
– поли (3-гидроксидодеканоат), |
n = 2 |
R = водород |
– поли (4-гидроксибутират), |
n = 3 |
R = водород |
– поли (5-гидроксивалерат). |
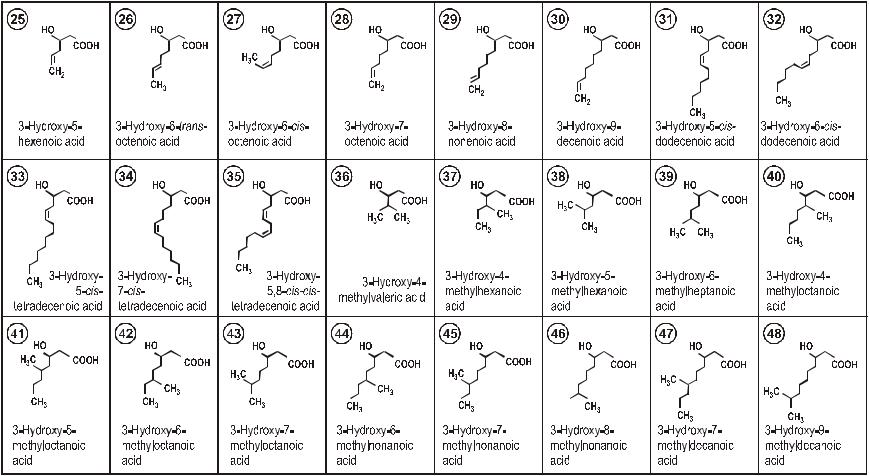
Большинство из известных типов оксикислот, образующих полимеры, детектированы в качестве составляющего продукта биосинтеза полиоксиалканоатов. Среди них – полимеры различного состава, содержащие:
А) 3-оксикислоты с различной длиной 3-оксиуглеродной цепи, от 3-оксипропионовой до 3-оксигексадекановой кислоты (в таблице, соответственно, позиции от #1 до #12);
Б) ненасыщенные 3-оксиалкеновые кислоты с одной (от #22 до
#34, #49, #73, #76, #90) или двумя (#35) двойными связями в R- бо-
ковой группе;
В) метиловые группы в различном положении R-боковых групп в полимере (от #36 до #49, #90);
Г) не содержащие 3-оксикислот, а образованные из 4-оксимас- ляной кислоты (#13), 4-оксивалериановой (#14), 4-оксигексановой (#15), 4-оксигептановой (#16), 4-оксиоктановой (#17), 4-оксидекано- вой (#18), 5-оксивалериановой (#19), 5-оксигексановой (#20), и 6- оксидодекановой (#21);
Д) 3-оксикислоты с различными функциональными группами, образованными в R-боковых группах, включая свободные карбоксильные группы, такие как яблочная кислота (#50), карбоксильные группы, этерифицированные с алкильными группами (от # 51 до #58) или бензойную кислоту (#59); ацетоокси группы (#60, #61), связанные с R-боковыми группами и феноксигруппами (от #62 до#65), para- цианофенокси группы (от #66 до #68) или para-нитрофенокси группы (#69), связанные с R-боковыми группами (#70) или циклогексильной группой (#71) с основной углерод-углеродной связью. Кроме того, обнаружены оксикислоты со второй оксигруппой ((#72, #73) или с эпокси группой (от#74 до #76), а также другие типы ПОА, содержащие ω-углеродный атом оксикислоты с включенной цианогруппой (#77, #78) или атомы галогенов – такие, как флюорин (#79, #80), хло-
рин (#81, #82) или бромин (от #83 до #85);
Е) оксикислоты с модифицированными боковыми группами, среди них 3-оксиалкеновые кислоты с двойными связями, например, 3-окси-2-бутеновая кислота ((#86) (#87), и ряд 3-оксикислот с метиловыми группами у α-углеродного атома (от #88 до #90).
В связи с тем, что состав мономеров, акцептируемый ПОАсинтазой, зависит от субстратной специфичности синтаз, а также способности микроорганизмов утилизировать разнообразные соединения углерода, безусловно, имеется реальная основа для идентификации в будущем новых типов ПОА. Например, определена спо-
51
собность ряда микроорганизмов использовать в качестве субстрата для синтеза полиоксиалканоатов яблочную кислоту (#91).
Среди охарактеризованных ПОА есть группа соединений, которые детектированы не в условиях лабораторных чистых микробных культур, а в местах, богатых углеродным субстратом с высокой концентрацией природных микроорганизмов, которые синтезируют помимо оксимасляной кислоты (#2), многие другие оксикислоты. Так, из активного ила сточных вод плантации в Пиории выделены ПОА, содержащие, помимо оксибутирата (#2), 3-оксивалерат (#3), 3-гексано- ат (#4) и в следовых количествах – 3-оксигептановую кислоту (#5) (Wallen and Rohwedder, 1974). В активном иле сточных вод Веберда (Швеция) выделен ПОА, содержащий оксибутират (#2), оксигексаноат (#4), оксиоктаноат (#6) (Odham et al., 1986). В сточных водах на одной из домашних плантаций в окрестностях Токио выделен и охарактеризован ПОА, содержащий 3-оксибутират (#2), 3-оксивалерат (3), 3-окси-2-метилмасляную кислоту (#88) и 3-окси-2-метилвалерат (#89). В речной эстуарии обнаружен полимер, содержащий, помимо 3-оксибутирата, в качестве сополимеров еще 5 других оксикислот: 3- оксивалерат ((#3), 3-оксигептаноат (#5), 3-оксиоктаноат (#6), 3-окси- 6-метилгептаноат (#39) и 3-окси-7-метилоктаноат (#43) (Findlay and White, 1983). Эти данные свидетельствуют о том, что консорциумы микроорганизмов, развивающиеся в условиях комплексного углеродного субстрата, способны к синтезу сложных, в т. ч. необычных полиоксиалканоатов.
На момент написания этой обзорной работы (Steinbüchel, Valentin, 1995b) по многообразию полиоксиалканоатов профессор А. Стейнбюхель намеренно остaвил незаполненными ячейки в таблице 2.1, полагая, что список полимеров этого класса будет пополняться. И он был прав. К настоящему моменту обнаружены и идентифицированы новые представители полиоксиалканоатов. Среди них – оптически активный этил 4-хлоро-3-оксибутират (Suzuki et al., 1996); метил (R)-4-хлоро-3-оксибутират и (S)-3-окси-γ-бутуролактон (Suzuki et al., 1998); сульфосодержащие полимеры с тиоэфирными связями (Takagi et al.,1999); сополимеры 3-оксибутирата и 3-
меркатопропионата P(3-HB-co-3MP) (Lütke-Eversloh et al., 2001).
При анализе всего многообразия полиоксиалканоатов установлено, что полимеры, синтезированные биологическим путем, имеют R-конфигурацию и не имеют L- конфигурации. Оксикислоты в гидроксигруппах в α-положении обнаружены только для яблочной кислоты, включенной в ПОА в условиях биосинтеза in vitro (#91) и в положении у 6-оксидодеканоата(#21).
52

Таблица 2.1
Известные типы полиоксиалканоатов (по данным Steinbüchel, Valentin, 1995b)
53
54
Таблица 2.1 – продолжение

Таблица 2.1 – продолжение
55

56
Таблица 2.1 – окончание

57
Таблица 2.2
Возможные типы полиоксиалканоатов*
длина гидроксиалкановых кислот
|
C1 |
C2 |
C3 |
C4 |
C5 |
C6 |
C7 |
C8 |
C9 |
C10 |
C11 |
C12 |
C13 |
C14 |
C15 |
C16 |
C17 |
C18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1–OH |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2–OH |
– |
глико- |
лактат |
2HB |
2HV |
2HHx |
2HHp |
2HO |
2HN |
2HD |
2HUD |
2HDD |
2HTriD |
2HTD |
2HPD |
2HHxD |
2HHpD |
2HOD |
лат |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3–OH |
– |
– |
3HP |
3HB |
3HV |
3HHx |
3HHp |
3HO |
3HN |
3HD |
3HUD |
3HDD |
3HTriD |
3HTD |
3HPD |
3HHxD |
3HHpD |
3HOD |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4–OH |
– |
– |
– |
4HB |
4HV |
4HHx |
4HHp |
4HO |
4HN |
4HD |
4HUD |
4HDD |
4HTriD |
4HTD |
4HPD |
4HHxD |
4HHpD |
4HOD |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5–OH |
– |
– |
– |
– |
5HV |
5HHx |
5HHp |
5HO |
5HN |
5HD |
5HUD |
5HDD |
5HTriD |
5HTD |
5HPD |
5HHxD |
5HHpD |
5HOD |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6–OH |
– |
– |
– |
– |
– |
6HHx |
6HHp |
6HO |
6HN |
6HD |
6HUD |
6HDD |
6HTriD |
6HTD |
6HPD |
6HHxD |
6HHpD |
6HOD |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7–OH |
– |
– |
– |
– |
– |
– |
7HHp |
7HO |
7HN |
7HD |
7HUD |
7HDD |
7HTriD |
7HTD |
7HPD |
7HHxD |
7HHpD |
7HOD |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*Steibüchel, Valentin, 1995 b: выделены гидроксиалкановые кислоты, которые постоянно определяются как элементы ПОА биосинтеза (остальные – не всегда). Кислоты: HB – оксимасляная, HV – оксивалериановая, HHX – оксигексановая, HHP – оксигептановая,
HO – гидроксиоктановая, HN – гидроксинонановая, HD – гидроксидекановая, HUD – гидроксиундекановая, HDD – гидроксидодекановая, HtriD – гидрокситридекановая, HTD – гидрокситетрадекановая, HPD – гидроксипентановая, HHxD – гидроксигексадекановая,
HHpD – гидроксигептадекановая, HOD – гидроксиоктадекановая. HASCL, HAMCL, HALCL, соответственно, коротко – , средне – и длинноцепочечные ПОА.
В целом, исходя из длины углеродной цепи оксикислот, образующих полимеры, полиоксиалканоаты подразделяют на три основные группы (таблица 2.2):
1)короткоцепочечные (short-chain-length, SCL), состоящие из кислот с длиной углеродной цепи от 3-х до 5-ти углеродных атомов;
2)среднецепочечные (medium-chain-length, MCL), в составе которых от 6 до 14 атомов углерода;
3)длинноцепочечные (long-chain-length, LCL) с содержанием ки-
слот С17 и С18.
Данное разделение полимеров на группы базируется на существующем представлении о субстратной специфичности ПОАсинтаз, акцептирующих определенные оксикислоты при строительстве полимерной цепи в процессе полимеризации (Anderson, Dawes, 1990). Ранее считалось, что ПОА синтаза A. eutrophus и других природных штаммов способна полимеризовать оксикислоты, состоящие из 3–5 углеродных атомов, но не взаимодействует с оксикислотами с длиной углеродной цепи 6 и более. Поэтому представлялось невозможным получение коротко- и среднецепочечных ПОА природными штаммами Alcaligenes. Однако к настоящему моменту подтверждена более широкая субстратная специфичность PHA-синтез у природных штаммов, включая Ectothiorhodospira shaposhnikovii (Chen et al., 2001), Ralstonia eutropha (Волова со соавт., 1998; Grenn et al., 2002) и
продемонстрирована способность данных организмов к одновременному синтезу коротко- и среднецепочечных ПОА.
Синтазы из различных штаммов P. oleovorans, обладающие более широкой субстратной специфичностью, акцептируют оксикислоты, содержащие от 6 до 14 атомов углерода, поэтому способны синтезировать разнообразные, как средне-, так и длинноцепочечные ПОА (Doi, 1990; Steinbüchel, 1991; 2001; Byron, 1992, Steinbüchel, Valentin, 1995).
Последовательность реакций синтеза полиоксиалканоатов иллюстрирует схема (рис. 2.1). Процесс можно подразделить на три этапа: на первом происходит транспорт источника углерода, необходимого для синтеза полимеров, из внешней среды в клетку, который катализируется специфическими ферментными транспортными системами, локализованными в цитоплазматической мембране или расположенными диффузно внутри клетки. Вторая фаза, включающая комплекс анаболических и катаболических реакций, конвертирует компоненты в гидроксиацил коэнзим-А, тиоэфир которого является субстратом для ПОА-синтазы. На третьем этапе, ПОА синтаза (ключевой фермент биосинтеза данных полимеров), использует тиоэфиры как субстраты и катализирует образование эфирных связей между ними при участии КоА. Данное представление не допускает, что ПОА синтаза для образования полимеров также использует другие
58

Рис. 2.1. Этапы синтеза ПОА в бактериях (Steinbüchel, Valentin, 1995b).
тиоэфиры гидроксикислот. Вторая фаза – очень существенна для процесса в целом, т. к. во время нее источник углерода конвертируется в субстраты, необходимые для синтеза ПОА. Многие бактерии способны превращать КоА последовательно в ацетацетил КоА и далее – в D(-)-3-гидроксибутирил-КоА, дающий начало полиоксибути-
рату (Anderson, Dawes, 1990).
Охарактеризованные к настоящему моменту типы ПОА теоретически могут дать возможность для получения нескольких миллионов вариантов полимеров. Комбинирование генов систем биосинтеза коротко-, средне- и длинноцепочечных ПОА и варьирование условий выращивания микроорганизмов уже сейчас позволяет получать полиоксиалканоаты разнообразнейших структур: полиоксибутират, полиоксивалерат, полиоксигексаноат, полиоксиоктаноат и двух-, трех- и четырехкомпонентные смеси с различным набором и соотношением гидроксибутирата и гидроксивалерата, гидроксигексаноата и гидроксиоктаноата
(Tim et al., 1992; Steinbüchel, Valentin, 1995b; Braunegg et al., 1998).
2.3. Биохимические пути синтеза полиоксиалканоатов
Полиоксиалканоаты синтезируются в ходе сложного многоступенчатого биосинтетического процесса, каждую стадию которого катализируют специфические ферменты. Знание закономерностей структурно-функциональной организации внутриклеточного цикла ПОА дает возможности управления этим процессом и основу для синтеза полимеров с новыми свойствами.
На примере наиболее изученного из полиоксиалканоатов – полимера β-оксимасляной кислоты, установлено, что пути его синтеза
59
