
- •2. Распределение электронов в атоме. Периодическая система элементов д. И. Менделеева.
- •2. Классификация элементарных частиц, лептоны, адроны. Свойства элементарных частиц (заряд, спин и т.Д.). Античастицы. Кварковая модель адронов.
- •2. Квантовые числа (главное, орбитальное, спиновое). Распределение электронной плотности в атоме, орбитали, заполнение электронов в элементах периодической таблицы.
- •2. Понятие оператора физической величины, собственных значений. Оператор импульса, кинетической энергии. Уравнение Шрёдингера.
- •2. Радиоактивность, виды. Единицы радиоактивности (Рентген, Зиверт, Кюри…). Прохождение частиц и гамма-излучения через вещество, защита от радиации. Радионуклидный анализ.
- •2. Тепловое излучение. Понятие абсолютно черного тела, серого тела. Закон Стефана-Больцмана, закон излучения Кирхгоффа. Закон смещения Вина. Формула Планка для излучения абсолютно черного тела.
- •Принцип действия
- •Принципиальное устройство синхротрона
- •2. Тонкая структура спектров. Спин электрона. Опыт Штерна-Герлаха.
- •2. Внешний фотоэффект и его законы. Уравнение Эйнштейна. Внутренний и вентильный фотоэффекты. Практическое применение фотоэффекта.
- •2. Рентгеновские спектры. Закон мозли.
2. Квантовые числа (главное, орбитальное, спиновое). Распределение электронной плотности в атоме, орбитали, заполнение электронов в элементах периодической таблицы.
Электроны могут находиться в атоме водорода, только имея определенные значения энергии. Состояния с другими значениями трактуются как неустойчивые (нестационарные), поэтому при E≠En, электрон должен излучать или поглощать энергию, с тем, чтобы перейти в одно из состояний, дозволенных для него при данных условиях.
Решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней (как и в случае с потенциальной ямой).
Собственные
функции уравнения содержат три
целочисленных параметра n,
l
и m.
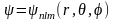 .
Таким образом существует столько
квантовых чисел, сколько степеней
свободы имеет электрон — три квантовых
числа определяют поведение волновой
функции Ψ в пространстве.
.
Таким образом существует столько
квантовых чисел, сколько степеней
свободы имеет электрон — три квантовых
числа определяют поведение волновой
функции Ψ в пространстве.
Главное квантовое число n.
Уровни энергии, соответствующие различным квантовым состояниям, зависят только от n:
Параметр n называют главным квантовым числом, которое отражает удаленность электронного слоя от ядра и запас энергии электронов в этом слое. Чем больше значение n, тем «размазаннее» электронное облако и больше энергия электронов.
Орбитальное квантовое число l.
Совместно с n определяет форму орбиты.
Поскольку каждому возможному значению энергии соответствует в возбужденном состоянии несколько орбит, состояния получили названия вырожденных. Все состояния за исключением низшего вырождены.
Параметр l называют орбитальным или азимутальным квантовым числом, характеризующим форму электронного облака и определяющим момент количества движения по орбите L:
Число l принимает значения 0, 1, 2…(n-1), т.е. для данного значения главного квантового числа n существует n значений орбитального числа l=0,1,2…(n-1).
М
 агнитное
квантовое число m.
агнитное
квантовое число m.
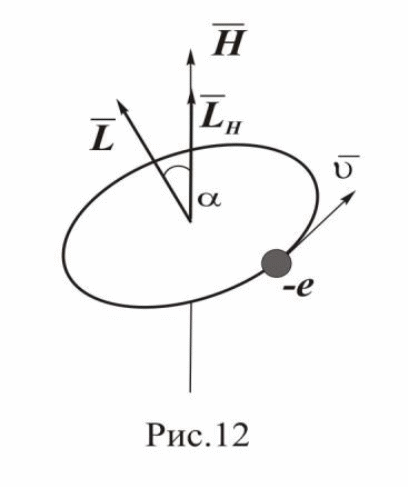
Магнитное квантовое число определяет ориентацию электронной орбиты относительно направления магнитного поля. В квантовой механике строго доказано, что существует пространственное квантование: вектор момента импульса L электрона имеет лишь такие ориентации в пространстве, при которых проекция LH вектора L на направление внешнего магнитного поля H принимает квантованные, целочисленные значения, кратные ħ=h/2π: LH=mh/2π, где m — магнитное квантовое число, которое может принимать значения 0,±1,±2…±l (l — орбитальное квантовое число).
Квантовые числа n, l и m создают различные квантовые состояния атома водорода, для которых получается различное распределение электронной плотности. Боровские орбиты электрона представляют собой геометрические места точек, в которых с наибольшей вероятностью может быть обнаружен электрон.
Спиновое квантовое число s.
Четвертое спиновое квантовое число определяется ориентацией собственного момента количества движения электрона относительно орбитального момента L.
Спин
является квантуемой величиной
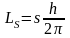 ,
где s=±1/2
квантовое число собственного механического
момента электрона.
,
где s=±1/2
квантовое число собственного механического
момента электрона.
4. 1. Принцип неопределенности Гейзенберга. Волновая функция, вероятность нахождения частицы, определение среднего значения величины.
Своеобразие свойств микрочастиц проявляется в том, что не для всех переменных получаются при измерениях определенные значения. Так, например, электрон (и любая другая микрочастица) не может иметь одновременно точные значения координаты х и импульса р.
Неопределенности координат и импульса удовлетворяют соотношению В. Гейзенберга:
![]()
где х и р — неопределенности значений х и р, являющиеся среднеквадратичными отклонениями.
Это выражение называется соотношением неопределенностей или принципом неопределенности.
Этот принцип утверждает, что если частица локализована в пространстве со среднеквадратичным отклонением х, то ее импульс может принимать значения, находящиеся в пределах «ширины» р.
Физический смысл принципа неопределенности состоит в том, что невозможно одновременно определить
значения координаты и импульса частицы.
Электроны, фотоны, нейтроны и другие микрочастицы в одних случаях ведут себя как частицы, в других проявляют свои волновые свойства. Это значит, что объекты микромира не являются ни классическими частицами, ни классическими волнами, и для изучения их свойств не применимы классические методы описания частиц и волн.
Соотношение неопределенности Гейзенберга показывает, что в микромире для квантовых объектов, чем точнее определено значение координаты частицы, тем менее точно определено значение импульса частицы и наоборот.
Δx·Δpx≥h
Микрочастицы не имеют одновременно точного значения координаты и соответствующей проекции импульса. Соотношение неопределенностей позволяет оценить, в какой мере можно применять к микрочастицам понятия классической механики. Оно показывает, что к микрообъектам неприменимо классическое понятие траектории (т.к. движение по траектории характеризуется в любой момент времени определенными значениями координат и скорости).
