
Бабурін Д.А. Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. З поясненнями та розв’язанням
..pdfАналіз тестових завдань за 2011 р |
91 |
|
|
Аерозолі сульфатної та сульфітної кислот становлять близько 2/3 кислотних опадів. Інше припадає на частку аерозолів нітратної та нітрітної кислот, що утворяться під час узаємодії нітроген(ІV) оксиду з водяною парою атмосфери:
2NO2 + H2O → HNO3 + HNO2
Завдання 32
Синтетичне волокно — це: |
|
а) вовна; |
в) віскоза; |
б) бавовна; |
г) капрон. |
Правильна відповідь: г. |
|
Коментар до тестового завдання. Синтетичні волокна виробляють з органічних сполук, здійснюючи хімічні реакції. До них належать капрон, найлон, лавсан та ін.
Капрон є поліамідним волокном. Він дуже міцний, витримує низькі температури, легко забарвлюється та має високу хімічну стійкість (руйнується тільки під дією концентрованих неорга нічних кислот). Капронові нитки використовують для виготов лення канатів, риболовних сіток, різних тканин, трикотажних виробів.
Капрон одержують реакцією поліконденсації з ε-амінокапро нової кислоти:
nH2N − (CH2 ) − COOH → −NH − (CH2 ) |
− CO − |
|||
5 |
−nH2O |
|
5 |
n |
ε−амiнокапронова кислота |
|
|
капрон |
|
Завдання 33 |
|
|
|
|
Який із чотирьох металів найменш активний? |
|
|||
а) Магній; |
в) нікель; |
|
|
|
б) мідь; |
г) свинець. |
|
|
|
Правильна відповідь: б. |
|
|
|
|
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно звернутися до ряду активності металів напри кінці тестового зошита. З нього чітко видно, що мідь (Сu) серед усіх запропонованих металів є найменш активною.
Завдання 34
Укажіть хімічну формулу речовини, водно-спиртовий розчин якої використовують для проведення якісної реакції на крохмаль:
92 |
Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. |
|
|
а) Br2; |
в) CuSO4; |
б) I2; |
г) FeCl3. |
Правильна відповідь: б.
Коментар до тестового завдання. Якщо в колоїдний розчин крох малю додати водно-спиртовий розчин йоду I2, то його буре забарв лення зміниться на темно-синє. Цю реакцію застосовують для про ведення якісної реакції на крохмаль.
Завдання 35
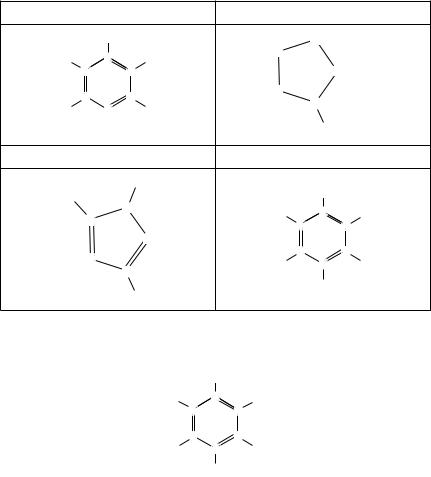
Укажіть структурну формулу ароматичного вуглеводню:
|
а |
|
Б |
|
H |
|
СH2 |
H |
C |
H |
H2С |
C |
C |
|
СH – CH3 |
C |
C |
|
H2С |
H |
C |
H |
СH2 |
|
|
OH |
OH |
|
|
в |
|
г |
|
|
|
СH3 |
|
СH3 |
|
|
H3С |
СH2 |
|
|
||
H |
C |
H |
|||
|
|||||
|
С |
C |
C |
|
|
|
СH |
|
|||
|
C |
C |
|
||
|
HС |
|
|||
|
H |
C |
H |
||
|
С |
||||
|
|
|
|
||
|
CH3 |
|
H |
|
|
|
|
|
|
Правильна відповідь: г.
Коментар до тестового завдання. Представником ароматичних вуглеводнів є тільки толуен (толуол), структурна формула якого:
|
СH3 |
|
H |
C |
H |
C |
C |
|
C |
C |
|
H |
C |
H |
H
Аналіз тестових завдань за 2011 р |
93 |
|
|
Завдання 36
Установіть відповідність між хімічними елементами, що в не значній кількості містяться у мінеральній воді «Лужанська», і бу довою зовнішніх енергетичних рівнів їхніх атомів.
Хімічний елемент |
Будова зовнішнього |
|
енергетичного рівня атома |
||
|
а) ...4s2
б) ...3s23p5 в) ...3s23p4 г) ...4s1
д) ...3s23p3
Правильна відповідь: 1 — в, 2 — б, 3 — г, 4 — а.
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно написати реальні електронні конфігурації ато мів для всіх запропонованих елементів (див. таблицю).
Хімічний |
Кількість електронів |
Реальна електронна |
елемент |
у атомі |
конфігурація атома |
|
|
|
Сульфур (S) |
16 |
1s22s22p63s23p4 |
|
|
|
Хлор (Cl) |
17 |
1s22s22p63s23p5 |
|
|
|
Калій (К) |
19 |
1s22s22p63s23p6 4s1 |
|
|
|
Кальцій (Са) |
20 |
1s22s22p63s23p6 4s2 |
|
|
|
Завдання 37
Установіть відповідність між хімічними формулами сполук і їхньою класифікаційною приналежністю.
Хімічна формула
1)Na2SO4
2)Fe(OH)2 Cl
3)P2O5
4)HNO3
Класифікаційна
приналежність
а) Основна сіль б) Кислотний оксид
в) Одноосновна кислота г) Нерозчинна основа д) Середня сіль
Правильна відповідь: 1 — д, 2 — а, 3 — б, 4 — в.
Коментар до тестового завдання. Щоб відповісти на це тестове за вдання, необхідно згадати до якого класу неорганічних сполук на лежить кожна із запропонованих речовин (див. таблицю).
94 |
Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. |
||
|
|
|
|
|
|
|
|
Хімічна |
Назва |
Клас неорганічних |
|
формула |
|||
речовини |
сполук |
||
речовини |
|||
|
|
||
|
|
|
|
Na2SO4 |
Натрій сульфат |
Середні солі |
|
|
|
|
|
Fe(OH)2 Cl |
Ферум(ІІІ) |
Основні солі |
|
дигідроксохлорид |
|||
|
|
|
|
P2O5 |
Фосфор(V) оксид |
Кислотні оксиди |
|
|
|
|
|
HNO3 |
Нітратна кислота |
Одноосновні кислоти |
|
|
|
|
|
Завдання 38
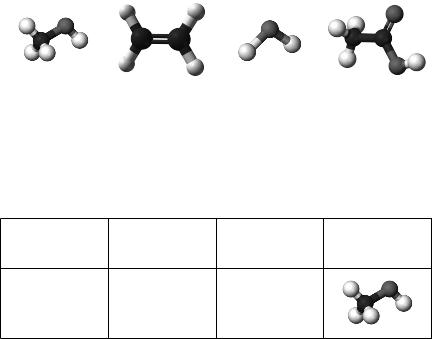
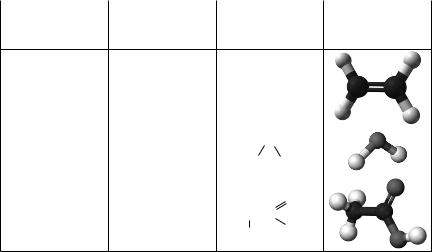
2011 рік — Міжнародний рік хімії. Одним із проектів, що мають популяризувати цю науку, могло б стати виготовлення для дитячої кімнати штор із зображенням моделей добре відо мих речовин. Установіть відповідність між моделями й назвами речовин.
Моделі молекул
1 |
2 |
3 |
4 |
Назви речовин: |
|
а) чадний газ; |
г) оцтова кислота; |
б) вода; |
д) метиловий спирт. |
в) етилен; |
|
Правильна відповідь: 1 — д, 2 — в, 3 — б, 4 — г.
Коментар до тестового завдання. Щоб відповісти на це тестове за вдання, необхідно згадати молекулярні та структурні формули за пропонованих органічних речовин (див. таблицю).
Назва |
Молекулярна |
Структурна |
Модель |
|
формула |
формула |
молекули |
||
речовини |
||||
речовини |
речовини |
речовини |
||
|
|
|
H |
||
Метиловий |
|
|
|
|
CH3OH |
H − C − O − H |
|||
спирт |
||||
|
|
|
||
|
|
H |
||
Аналіз тестових завдань за 2011 р |
|
95 |
||
|
|
|
|
|
|
|
|
|
|
Назва |
Молекулярна |
Структурна |
Модель |
|
формула |
формула |
молекули |
||
речовини |
||||
речовини |
речовини |
речовини |
||
|
||||
Етилен |
C2H4 |
|
H H |
|
||||
|
|
|
|
|
|
|||
H − C |
= C |
− H |
||||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
Вода |
H2O |
|
|
|
O |
|
||
|
H H |
|
||||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
O |
|||
Оцтова |
|
|
|
|
|
|
||
CH3COOH H − C − C |
|
|||||||
кислота |
O – H |
|||||||
|
|
|
|
|
|
|||
|
|
H |
|
|
||||
|
|
|
|
|
||||
Завдання 39
Установіть відповідність між кількістю й масою речовин.
|
Назва речовини та її кількість |
Маса речовини, г |
1) |
Етан кількістю 2 моль |
а) 54 |
2) |
Вода кількістю 3 моль |
б) 68 |
3) |
Кальцій оксид кількістю 0,25 моль |
в) 20 |
4) |
Амоніак кількістю 4 моль |
г) 60 |
|
|
д) 14 |
Правильна відповідь: 1 — г, 2 — а, 3 — д, 4 — б.
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно обчислити маси запропонованих речовин. Це можна зробити за такою розрахунковою формулою:
m(речовини) = ν(речовини) M(речовини).
1)Хімічна формула етану — С2H6 .
m(C2H6 ) = ν(C2H6 ) M(C2H6 ) = 2 моль 30 г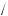 моль = 60 г. Окремо необхідно обчислити молярну масу етану:
моль = 60 г. Окремо необхідно обчислити молярну масу етану:
Mr (C2H6 ) = 2 Ar (C) + 6 Ar (H) = 2 12+ 6 1 = 30. Отже, M(C2H6 ) = 30 г моль.
моль.
2)Хімічна формула води — H2O .
m(H2O) = ν(H2O) M(H2O) = 3 моль 18 г моль = 54 г.
моль = 54 г.
96 |
Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. |
|
|
Окремо необхідно обчислити молярну масу води: Mr (H2O) = 2 Ar (H) + Ar (O) = 2 1+16 = 18.
Отже, M(H2O) = 18 г моль.
моль.
3)Хімічна формула кальцій оксиду — СаO.
m(CaO) = ν(CaO) M(CaO) = 0,25 моль 56 г моль = 14 г. Окремо необхідно обчислити молярну масу кальцій оксиду: Mr (CaO) = Ar (Ca) + Ar (O) = 40 +16 = 56.
моль = 14 г. Окремо необхідно обчислити молярну масу кальцій оксиду: Mr (CaO) = Ar (Ca) + Ar (O) = 40 +16 = 56.
Отже, M(CaO) = 56 г моль.
моль.
4)Хімічна формула амоніаку — NH3 .
m(NH3 ) = ν(NH3 ) M(NH3 ) = 4 моль 17 г моль = 68 г. Окремо необхідно обчислити молярну масу амоніаку:
моль = 68 г. Окремо необхідно обчислити молярну масу амоніаку:
Mr (NH3 ) = Ar (N) + 3 Ar (H) = 14 + 3 1 = 17. Отже, M(NH3 ) = 17 г моль.
моль.
Завдання 40
Установіть відповідність між назвами речовин і продуктів їх термічного розкладання.
|
Назва речовини |
Назва одного з продуктів |
|
її термічного розкладання |
|
|
|
|
1) |
Метан |
а) Кальцій |
2) |
Кальцій карбонат |
б) Кисень |
3) |
Калій перманганат |
в) Вуглець |
4) |
Ферум(ІІІ) гідроксид |
г) Вода |
|
|
д) Карбон(ІV) оксид |
Правильна відповідь: 1 — в, 2 — д, 3 — б, 4 — г.
Коментар до тестового завдання. Щоб відповісти на це тестове за вдання, необхідно написати рівняння реакцій термічного розкладу всіх запропонованих речовин.
1)У результаті термічного розкладу метану CH4 можуть утвори тися вуглець Cвугл. і водень H2:
CH4 t °C→Cвугл. + 2H2
2)У результаті термічного розкладу кальцій карбонату CaCO3 утворюється кальцій оксид СаО і карбон(ІV) оксид CO2 :
CaCO3 t °C→CaO + CO2
Аналіз тестових завдань за 2011 р |
97 |
|
|
3)У результаті термічного розкладу калій перманганату KMnO4 утворюються калій манганат K2MnO4, манган(ІV) оксид MnO2 і кисень O2 :
2KMnO4 t °C→K2MnO4 + MnO2 + O2
4)У результаті термічного розкладу ферум(ІІІ) гідроксиду Fe(OH)3 утворюються ферум(ІІІ) оксид Fe2O3 і вода H2O:
2Fe(OH)3 t °C→Fe2O3 + 3H2O
Завдання 41
Установіть послідовність хімічних формул у ланцюжку пере творень від неметалу до оксиду металічного елемента:
а) MgBr2; |
в) Br2; |
б) Mg(OH)2 ; |
г) MgO. |
Правильна відповідь: в — а — б — г.
Коментар до тестового завдання. Ланцюг перетворення неметалу
(Br2 ) на оксид металічного елемента (MgO) виглядає так: Br2 1→MgBr2 2→Mg(OH)2 3→MgO
1)Mg + Br2 → MgBr2
2)MgBr2 + 2NaOH → Mg(OH)2↓ + 2NaBr
3)Mg(OH)2 t °C→MgO + H2O
Завдання 42
Розташуйте сполуки за посиленням їхніх кислотних власти
востей: |
|
а) етанова кислота; |
в) карбонатна кислота; |
б) етанол; |
г) фенол. |
Правильна відповідь: б — г — в — а.
Коментар до тестового завдання. Серед запропонованих сполук найслабші кислотні властивості проявляє представник насичених одноатомних спиртів — етанол. За нього кращі кислотні власти вості має фенол, однак треба зауважити, що у водному розчині він дуже слабко дисоціює на йони: C6H5OH H+ + C6H5O− і його роз чин не змінює забарвлення індикаторів.
Сильніші за фенол кислотні властивості має карбонатна кис лота. Підтвердженням цього є проста реакція: якщо через водний розчин натрій феноляту пропускати вуглекислий газ, то виділяєть ся фенол:

98 |
Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. |
|
|
C6H5ONa + CO2 (надл.)+ H2O →
→ C6H5OH + NaHCO3
Серед запропонованих сполук найсильніше кислотні власти вості проявляє етанова кислота. У водному розчині вона дисоціює на йони: CH3COOH H+ + CH3COO− і її водний розчин здатен змі нювати забарвлення індикаторів.
Завдання 43
Розташуйте напівсхеми хімічних реакцій за зменшенням суми коефіцієнтів у відповідних хімічних рівняннях:
а) Cl2 + H2 → б) Ca + Cl2 → в) Ca + O2 →
г) Fe + Br2 →
Правильна відповідь: г — в — а — б.
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно в усіх напівсхемах дописати продукти хіміч них реакцій, а потім перетворити ці схеми на хімічні рівняння.
Хімічне рівняння |
Сума коефіцієнтів у хімічному |
|
рівнянні |
||
|
||
|
|
|
2Fe + 3Br2 → 2FeBr3 |
2+ 3+ 2 = 7 |
|
|
|
|
2Ca + O2 → 2CaO |
2+1* +2 = 5 |
|
|
|
|
Cl2 + H2 → 2HCl |
1+1+ 2 = 4 |
|
|
|
|
Ca + Cl2 → CaCl2 |
1+1+1 = 3 |
|
|
|
Завдання 44
Розташуйте символи хімічних елементів за збільшенням числа енергетичних рівнів у електронній оболонці їхніх атомів:
а) S; |
в) Fe; |
б) C; |
г) I. |
Правильна відповідь: б — а — в — г.
Коментар до тестового завдання. Кількість енергетичних рівнів у атомі можна визначити за номером періоду, в якому розміщений хімічний елемент (див. таблицю).
* У хімічних рівняннях коефіцієнт «1» ніколи не пишуть, але він є.
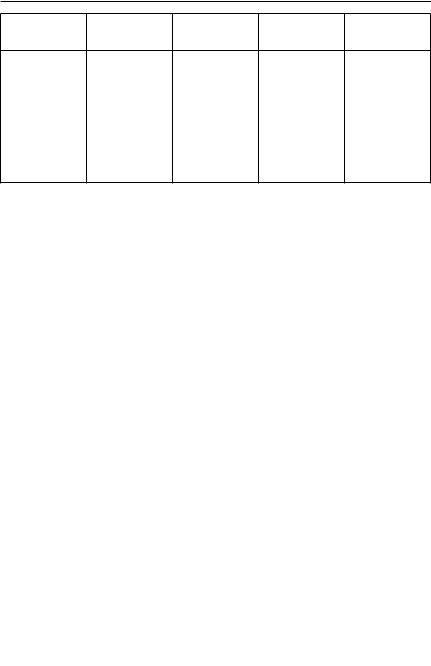
Аналіз тестових завдань за 2011 р |
|
99 |
|||
Хімічний |
Карбон |
Сульфур |
Ферум |
Йод |
|
елемент |
(С) |
(S) |
(Fe) |
(І) |
|
|
|
* |
|
|
|
Схема |
+6 |
+16 |
+26 |
+53 |
|
будови |
|||||
|
|
|
|
||
атома |
24 |
28 |
28 |
28 |
|
|
|||||
|
|
6 |
14 |
18 |
|
|
|
|
2 |
187 |
|
Завдання 45
Розташуйте назви хімічних елементів за збільшенням числа електронів на зовнішньому енергетичному рівні їхніх атомів:
а) Хлор; |
в) Оксиген; |
б) Фосфор; |
г) Калій. |
Правильна відповідь: г — б — в — а.
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно намалювати схеми будови атомів запропонова них елементів (див. таблицю).
Хімічний |
Калій |
Фосфор |
Оксиген |
Хлор |
|
елемент |
(К) |
(Р) |
(О) |
(Сl) |
|
Схема |
+19 |
+15 |
+8 |
+17 |
|
будови |
|||||
|
|
|
|
||
атома |
2881 |
285 |
26 |
287 |
|
|
Завдання 46
Установіть послідовність хімічних формул речовин у ланцюж ку перетворень алкену на циклоалкан:
а) C2H4; |
в) C6H12; |
б) C2H2; |
г) C6H6. |
Правильна відповідь: а — б — г — в.
* На схемах будови атома енергетичні рівні позначають у вигляді дужки.

100 |
Тестові завдання у форматі ЗНО 2009, 2010, 2011 рр. |
|
|
Коментар до тестового завдання. Ланцюг перетворення алкену
(C2H4 ) на циклоалкан (C6H12 ) виглядає так:
C2H4 1→C2H2 2→C6H6 3→C6H12
1)C2H4 t, p→C2H2 + H2
2)3C2H2 Cактивоване, t→C6H6
3)C6H6 + 3H2 kat.→C6H12 (циклогексан)
Завдання 47
Розташуйте хімічні формули за збільшенням кількості речови
ни в їхніх порціях масою 128 г: |
|
а) SO2; |
в) Cu2S; |
б) CuO; |
г) S. |
Правильна відповідь: в — б — а — г.
Коментар до тестового завдання. Щоб відповісти на це тестове за питання, необхідно обчислити кількості речовин для всіх запропо нованих сполук. Це можна зробити за такою розрахунковою фор
мулою: |
|
|
ν(речовини) = |
|
m(речовини) |
|
|||||||||||
|
|
|
|
|
|
. |
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M(речовини) |
|||
|
ν(Сu2S) = |
|
m(Cu2S) |
|
|
128 г |
|
|
|
|
|||||||
1) |
|
|
|
|
= |
|
|
= 0,8 моль. |
|||||||||
|
M(Cu |
S) |
160 г моль |
||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Окремо необхідно обчислити молярну масу купрум(І) сульфіду: |
||||||||||||||||
|
Mr (Cu2S) = 2 Ar (Cu) + Ar (S) = 2 64 + 32 = 128 + 32 = 160. |
||||||||||||||||
|
Отже, M(Cu2S) = 160 г моль. |
|
|
|
|
||||||||||||
2) |
ν(CuO) = |
m(CuO) |
= |
|
|
128 г |
|
= 1,6 моль. |
|||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
( |
CuO |
) |
|
|
|
|
80 г моль |
|||||||
|
|
|
M |
|
|
|
|
|
|||||||||
|
Окремо необхідно обчислити молярну масу купрум(ІІ) оксиду: |
||||||||||||||||
|
|
|
|
Mr (CuO) = Ar (Cu) + Ar (O) = 64 +16 = 80. |
|||||||||||||
|
Отже, M(CuO) = 80 г моль. |
|
|
|
|
||||||||||||
3) |
ν(SO2 ) = |
|
m(SO2 ) |
= |
|
|
|
|
128 г |
= 2 моль. |
|||||||
M(SO ) |
|
|
64 г моль |
||||||||||||||
2
Окремо необхідно обчислити молярну масу сульфур(ІV) оксиду: Mr (SO2 ) = Ar (S) + 2 Ar (O) = 32+ 2 16 = 32+ 32 = 64.
Отже, M(SO2 ) = 64 г моль.
моль.
