
- •Передмова
- •Тема 1. Основні хімічні поняття. Речовина
- •Тема 2. Хімічна реакція
- •Тема 4. Хімічний зв’язок
- •Тема 5. Суміші речовин. Розчини
- •Тема 6. Основні класи неорганічних сполук (оксиди, кислоти)
- •Тема 7. Основи, солі, амфотерні сполуки. Генетичні зв’язки між класами неорганічних сполук
- •Тема 8. Неметалічні елементи та їх сполуки. Неметали. Галогени
- •Тема 9. Оксисен і Сульфур
- •Тема 10. Неметали. Нітроген і Фосфор
- •Тема 11. Карбон і Силіцій
- •Тема 12. Загальні відомості про металічні елементи та метали
- •Тема 13. Лужні та лужноземельні елементи
- •Тема 14. Алюміній
- •Тема 15. Ферум
- •Тема 16. Теоретичні основи органічної хімії
- •Тема 17. Алкани, Алкени, Алкіни
- •Тема 18. Ароматичні вуглеводні. Бензин. Природні джерела вуглеводнів та їхня переробка
- •Тема 19. Спирти і феноли
- •Тема 20. Альдегіди, Карбонові кислоти
- •Тема 21. Естери. Жири
- •Тема 22. Вуглеводи
- •Тема 23. Аміни. Амінокислоти. Білки
- •Відповіді до тестів
- •Відповіді до тестів у форматі ЗНО

тема 10. неметали. нітРоген і фосфоР
Тема 10. Неметали. Нітроген і Фосфор
Перевірте свої знання
Виконайте тест 19. На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися словниками, підручниками, посібниками, довідниками тощо.
тест 19 (вступний)
1. Метал у вільному стані утворюється при термічному розкладі солі:
А NaNO3 |
В Zn(NO3)2 |
Б Ca(NO3)2 |
ГAgNO3 |
2. Укажіть ряд речовин, у якому приведені тільки солі ортофосфатної кислоти.
А KCl, K3PO4, NaPO3
Б Na3PO4,AlPO4, K3PO4
В NaNO3, NaCl, KPO3
Г K3PO4, Li3PO4, MgCl2
3. Визначте речовини, що у водних розчинах взаємодіють за рівнянням реакції у скороченому йонному вигляді:
3Ag+ + PO43– →Ag3PO4.
А аргентум нітрат та метафосфатна кислота Б аргентум хлорид та барій ортофосфат В аргентум нітрат та натрій ортофосфат
Гаргентум хлорид та амоній ортофосфат
4.Установіть відповідальність між реагентами і продуктами реакції.
А HNO3 + Cu→ 1 Cu(NO |
2 |
3)2 |
+ H2O |
|
Б HNO3(конц.) + CuS→ |
Cu(NO3)2 |
+ NO + H2O |
||
В HNO3 + CuО→ |
3 Cu(NO3)2 |
+ NO2 |
+ H2O |
|
Г HNO3(розб.) + Cu→ 4 Cu(NO |
|
3)2 |
+ H2S |
|
5.Установіть генетичний ланцюг добування ортофосфатної кислоти.
Афосфор
Б фосфор (V) оксид В фосфор (ІІІ) оксид
Гметафосфатна кислота
6.Який об’єм амоніаку потрібний для реакції з 24,5 г сульфатної кислоти при добуванні амоній гідрогенсульфату?
68
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
теоретична частина
фіЗичні ВлАСтиВОСті ПРОСтиХ РечОВин
Властивості |
Нітроген |
фосфор білий |
фосфор червоний |
Формула сполуки |
N2 |
Зовнішній вигляд |
Газ |
у звичайних умовах |
|
Колір |
Безбарвний |
P4
Воскоподібна тверда речовина
Білий
P∞
 Порошкоподібна тверда речовина
Порошкоподібна тверда речовина 
Залежно від умов одержання змінюється від темно-коричневого до червоно-фіолетового
Температура плав- |
–209 °С |
+44 °С |
+585 ÷ 600 C° (при підвищено- |
лення |
|
|
му тиску); |
|
|
|
+429 °С — сублімація |
Температура кипіння |
–196 °С |
+275 °С |
+800 ÷ 850 C° |
Густина за н. у. |
1,2506 г/л |
1,8 г/см3 |
2 2,4 г/см3 |
Розчинність у воді |
2 об’єми азоту |
Не розчиняється |
Не розчиняється |
|
в 100 об’ємах води |
|
|
Хімічні властивості азоту
За рахунок високої стійкості молекули проста речовина поводиться досить пасивно. За звичайних умов азот вступає в реакцію тільки з металічним літієм:
6Li + N2 →2Li3N.
При нагріванні азот взаємодіє з деякими металами та неметалами, при цьому утворюються нітриди, сполуки, в яких Нітроген проявляє ступінь окиснення –3:
3Mg +N2 →t Mg3N2 ,
3Cl2 +N2 →t 2NCl3 .
В електричному розряді азот реагує з киснем, при цьому утворюються оксиди Нітрогену II та IV. За рахунок цього під час грози повітря, а згодом і ґрунт, збагачується складними сполуками Нітрогену:
N2 +O2 електророзряд→2NO,
N2 +2O2 електророзряд→2NO2.
Хімічні властивості фосфору
Хімічні властивості всіх алотропних модифікацій фосфору однакові, за винятком того, що бі - лий фосфор активніший, ніж червоний, а червоний активніший, ніж чорний. Таким чином, речови - ну фосфор при складанні хімічних реакцій будемо записувати просто як P. Червоний і чорний фос - фор реагують із киснем повітря при підвищеній температурі, а білий — навіть при кімнатній тем - пературі:
4P +5O2 →t 2P2O5.
69
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
Білий фосфор при повільному окисненні киснем повітря випромінює світло. Це відбувається внаслідок того, що в процесі окиснення енергія, яка виділяється, витрачається на випромінювання світла. Це явище називають хемілюмінесценцією.
Фосфор реагує з деякими неметалами-окисниками, при цьому можуть утворюватися похідні Фосфору з різним ступенем окиснення. Це залежить від кількості речовини-окисника. При надлишку окисника утворюються сполуки Фосфору(V), а при нестачі — Фосфору(III):
2P +3S → P2S3 ,
2P +5S → P2S5 ,
2P +3Cl2 →2PCl3 ,
2P +5Cl2 →2PCl5 .
Фосфор вступає у взаємодію з багатьма активними металами. При цьому утворюються фосфіди металів. Фосфіди — це сполуки, в яких атом Фосфору виявляє ступінь окиснення –3:
3Ca +2P →t Ca3P2 .
Більшу частину добутого в промисловості азоту використовують для виробництва амоніаку. Багато азоту йде для виробництва нітратних добрив, які добувають із повітря при електричному розряді. За рахунок своєї інертності азот часто застосовують для створення інертної атмосфери в різних промислових процесах, для заповнення ламп розжарювання, для заповнення вільного місця в термометрах та барометрах. У металургії азот використовують при загартовуванні сталі, тому що на поверхні розпеченого металевого лиття утворюється тугоплавкий і стійкий ферум нітрид.
фізичні властивості амоніаку
Амоніак являє собою безбарвний газ із дуже різким характерним запахом. Саме амоніак надає запаху медичному препарату, який називають «нашатирний спирт». Температури його фазових переходів дорівнюють: Тпл = –78 °С і Ткип = –33 °С. У рідкому стані між молекулами амоніаку утворюються стійкі водневі зв’язки, чим пояснюються високі температури кипіння та плавлення:
H
H N
N H
H
H H
 H
H N
N H
H N
N
H H
Амоніак дуже добре розчиняється у воді: при +20°С в 1 літрі води розчиняється 700 літрів амоніаку, а при 0 °С — 1180 літрів.
хімічні властивості амоніаку
NH3 +H2O NH3 H2O NH4+ +OH− .
Четвертийзв’язокміжНітрогеномтаГідрогеномвйоніамоніюутворюєтьсязадонорно-акцепторним механізмом. Йон амонію має форму правильної трикутної піраміди (тетраедра), у вершинах якої перебувають атоми Гідрогену, а в її центрі — атом Нітрогену.
70
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
Основні властивості амоніаку проявляються в реакціях з кислотами. При цьому утворюються солі амонію:
NH3 + HCl → NH4Cl,
NH3 + H2SO4 → NH4HSO4 ,
2NH3 + H2SO4 → (NH4 )2 SO4.
АтомНітрогенувмолекуліамоніакуздатнийтількиокиснюватисяйприцьомувиступативролівідновника. При високій температурі амоніак згорає в кисні повітря, унаслідок чого утворюється молекулярний азот і вода:
4NH3 +3O2 →2N2 +6H2O.
У присутності каталізатора (Pt, Cr2O3) окиснення Нітрогену продовжується, при цьому утворюється нітроген(II) оксид:
4NH3 +5O2 Pt, Cr2O3→4NO ↑ +6H2O.
У водних розчинах відновлює бром:
8NH3 + 3Br2 → 6NH4Br + N2 ↑.
Солі амонію
За рахунок гідролізу розчини солей амонію проявляють слабокислу реакцію:
NH4NO3 + H2O → NH3 H2O + HNO3.
При дії розчинів лугів на солі амонію виділяється амоніак:
NH4Cl + NaOH → NH3 ↑ +NaCl + H2O.
Солі амонію при нагріванні розкладаються за різними механізмами:
NH4Cl t→NH3 ↑ + HCl ↑
(NH4 )2 CO3 t→2NH3 ↑ + CO2 ↑ + H2O
Застосування амоніаку
Амоніак переважно використовують як реагент для виробництва більш складних хімічних сполук, таких як нітратна кислота, сода, різні солі амонію. Багато амоніаку використовують для виробництва різних органічних сполук, що містять атоми Нітрогену. Сьогодні амоніак широко використовують у холодильних установках. Іноді амоніак використовують як рідке добриво.
якісна реакція на йон амонію
Оскільки майже всі солі амонію добре розчиняються у воді, то для виявлення амоніаку вивчають запах досліджуваного розчину, в який попередньо додають луг. У разі присутності в розчині йонів амонію, при підлуговуванні виділяється амоніак, запах якого легко виявити:
NH4Cl + NaOH → NH3 ↑ +NaCl + H2O.
Одержання амоніаку в лабораторії
Амоніак в лабораторії одержують :
2NH4Cl + Ca (OH)2 =t 2NH3↑ + CaCl2 + 2H2O
кр. кр.
Нітроген(II) оксид являє собою безбарвний газ із низькими температурами плавлення й кипіння (Тпл = –164 °С, Ткип = –152 °С). Він погано розчиняється у воді.
71
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
На повітрі швидко окиснюється, при цьому утворюється бурий газ:
2NO + O2 →2NO2 .
Нітроген(II) оксид проявляє окисні властивості:
2NO +2SO2 → N2 +2SO3 .
Нітроген діоксид являє собою газ (Тпл = –11 °С, Ткип = +21 °С) характерного бурого кольору з неприємним, «пекучим» запахом.
Газ реагує з водою, при цьому проходить реакція диспропорціонування:
2NO2 +H2O HNO2 +HNO3.
У результаті цієї реакції утворюється сильна нітратна кислота HNO3 та слабка нестійка нітритна кислота HNO2. При взаємодії бурого газу з розчином лугу утворюються дві солі — нітрат (сіль нітратної кислоти) і нітрит (сіль нітритної кислоти):
2NO2 +2NaOH → NaNO2 + NaNO3 + H2O.
Нітроген діоксид при низьких температурах помітно димеризований (тобто дві однакових молекули з’єднуються в одну):
NO2 +NO2 N2O4.
нітратна кислота
У молекулі нітратної кислоти HNO3 Нітроген перебуває в ступені окиснення +5, але при цьому проявляє валентність, що дорівнює 4. Будова молекули нітратної кислоти зображена нижче.
O
H O
O N
N
O
Пунктиром показана валентність, розподілена між двома атомами Оксигену й атомом Нітрогену; отже, електрони при утворенні зв’язку розподілені не між двома атомами, а між трьома.
фізичні властивості нітратної кислоти
Нітратна кислота за нормальних умов являє собою безбарвну, важку димну рідину (ρ = 1,52 г/см3 ), яка кристалізується при температурі –42 °С, а кипить при температурі +83 °С. Ця кислота має їдкий характерний запах. У твердому стані HNO3 є безбарвною кристалічною масою. При температурі близько +25 °С вона набуває червоного забарвлення унаслідок виділення бурого газу NO2. Нітратна кислота змішується з водою в будь-яких співвідношеннях. Як і сульфатна кислота, вона енергійно поглинає вологу, тобто проявляє гігроскопічні властивості.
хімічні властивості нітратної кислоти
Нітратна кислота — нестійка сполука. Якщо концентровану кислоту опромінювати денним світлом або нагрівати, то вона стає червоною. Це відбувається за рахунок розкладання кислоти й утворення нітроген діоксиду:
4HNO3 hv, t→4NO2 ↑ + 2H2O + O2 ↑.
72
www.e-ranok.com.ua
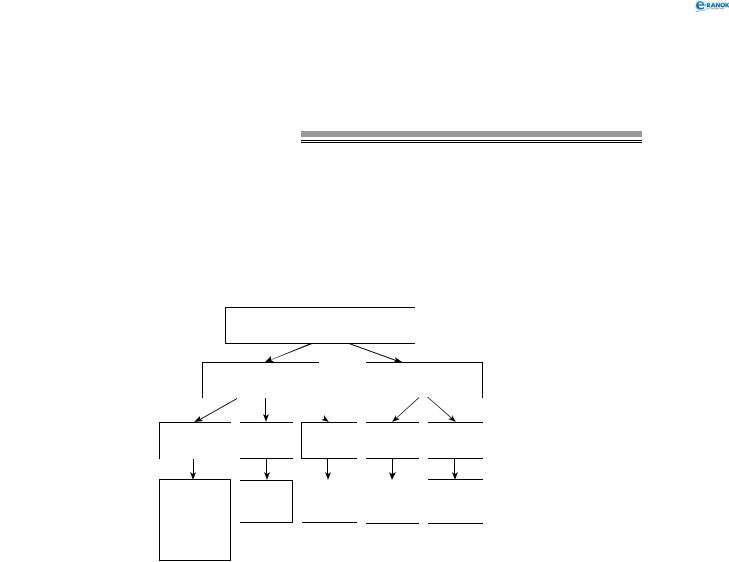
тема 10. неметали. нітРоген і фосфоР
Взаємодія з металами
При взаємодії нітратної кислоти з металами водень виділяється тільки тоді, коли нітратна кислота дуже розведена (близько 1%) й реагує з лужними металами. При цьому спочатку відбувається реакція взаємодії металу з водою, а вже потім нейтралізація утвореного лугу кислотою:
|
2Na |
+ |
2H |
2 |
O |
→ |
2NaOH |
+ |
H |
2 |
↑ |
|
|
|
|
|
|
|
, |
|
|||||
|
HNO3 + NaOH → NaNO3 + H2O. |
|
||||||||||
|
Нітратна кислота HNO3 |
|
|
|
||||||||
Концентрована |
|
|
|
|
|
Розведена |
||||||
Au, Fe, Al, |
Пасивні |
|
|
Активні |
|
Пасивні |
Активні |
|||||
Cr, Pt |
метали |
|
|
метали |
|
метали |
метали |
|||||
Реакція не |
|
|
|
|
NO2 і NO |
|
NO |
NH4+ |
||||
проходить, |
NO2 |
|
|
|
і N2 |
і N2O |
||||||
або метал пасивується кислотою
Завдяки тому, що концентрована нітратна кислота пасивує металічне залізо, її транспортують у сталевих бочках і цистернах. Нижче наведені приклади реакцій нітратної кислоти різної концентрації з деякими металами:
Fe + HNO3 (конц.) ×→,
Ag + 2HNO3 (конц.) → AgNO3 + NO2 ↑ + H2O.
Взаємодія зі складними сполуками
Нітратна кислота вступає у взаємодію з різними складними сполуками. За рахунок проявлення кислотних властивостей, HNO3 реагує з основами та основними оксидами:
HNO3 + NaOH → NaNO3 + H2O,
3HNO3 + Al(OH)3 → Al(NO3 )3 + 3H2O,
2HNO3 + ZnO → Zn(NO3 )2 + H2O.
У промисловості нітратну кислоту добувають розчиненням нітроген діоксиду у воді в присутності надлишку кисню. NO2 добувають каталітичним окисненням амоніаку:
4NH3 + 5O2 Pt, Cr2O3→4NO ↑ + 6H2O,
2NO + O2 →2NO2 ,
4NO2 + O2 +2H2O → 4HNO3 .
73
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
Невеликі кількості нітратної кислоти в лабораторіях добувають за такою реакцією:
NaNO3 +H2SO4 HNO3 +NaHSO4.
Нітратну кислоту застосовують у багатьох галузях промисловості. Одне з головних застосувань HNO3 — це добування нітратних добрив. Нітратну кислоту також використовують для виготовлення різних вибухових речовин (порох, тротил, нітрогліцерин тощо), лікарських препаратів, яскравих барвників, штучних волокон (наприклад, нітроцелюлози, або «штучного шовку»). Її також застосовують як окисник ракетного палива.
Нітрати широко використовують у народному господарстві. Амоній нітрат NH4NO3 застосовують як азотне добриво та при виробництві вибухових речовин (він входить до складу амоналу); калій нітрат KNO3 (калійна селітра) застосовують при виготовленні пороху (у чорному поросі міститься близько 75% KNO3) і як добриво, а ще в харчовій промисловості та при виробництві скла. Багато інших нітратів застосовують як добрива в сільському господарстві.
Усі нітрати при нагріванні розкладаються. Однак, залежно від активності металу, розклад може проходити в різних напрямках. Наприклад, нітрати металів, що перебувають в електрохімічному ряді напруг правіше магнію (літій Li, калій K, барій Ba, кальцій Ca і натрій Na), розкладаються на нітрит і кисень:
2NaNO3 t→2NaNO2 + O2 ↑.
Нітрати, утворені металами середньої активності, що розташовані між міддю та магнієм включно (магній Mg, алюміній Al, марганець Mn, хром Cr, цинк Zn, залізо Fe, кобальт Co, нікель Ni, олово Sn, свинець Pb і мідь Cu), розкладаються на оксиди металів, нітроген діоксид та кисень:
2Cu(NO3 )2 t→2CuO + 4NO2 ↑ + O2 ↑.
Нітрати малоактивних металів (ртуть Hg, сріблоAg, платина Pt та золотоAu) розкладаються на чистий метал, нітроген діоксид та кисень:
2AgNO3 = 2Ag + 2NO2 ↑ + O2 ↑.
Оксиди фосфору
Фосфор(V) оксид P2O5 (фосфатний ангідрид) у звичайних умовах є білою, дуже гігроскопічною речовиною. Густина твердого фосфатного ангідриду дорівнює 2,3 г/см3. При його нагріванні до +359 °С відбувається фазовий перехід із твердого стану в газоподібний, оминаючи рідкий. Такий фазовий перехід називають сублімацією.
хімічні властивості фосфатного ангідриду
Фосфор(V) оксид дуже активно взаємодіє з водою. При цьому може утворюватися три кислоти: метафосфатна (HPO3), пірофосфатна (H4P2O7) або ортофосфатна (H3PO4). Продукти реакції залежать від кількості води:
P2O5 + H2O →2HPO3 ,
P2O5 +3H2O →2H3PO4.
74
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
P2O5 проявляє властивості кислотного оксиду. Він реагує з лугами та основними оксидами, при цьому утворюються солі фосфатної кислоти — фосфати:
P2O5 +6KOH →2K3PO4 +3H2O,
P2O5 +3Na2O →2Na3PO4 .
фізичні властивості ортофосфатної кислоти
При нормальних умовах ортофосфатна кислота являє собою безбарвну й розпливчасту на повітрі кристалічну сполуку із температурою плавлення +42 °С (65 %-й розчин кислоти замерзає тільки при –85 °С). У твердому стані й у розчині молекули ортофосфатної кислоти асо - ційовані за рахунок водневих зв’язків, і тому концентровані розчини мають високу в’язкість. Фосфатна кислота добре розчиняється у воді (до 80 % за масою). Її водні розчини — гарні електроліти (найвища електропровідність спостерігається тоді, коли концентрація кислоти становить 48 %).
Фосфатна кислота вступає у взаємодію з основами та основними оксидами:
H3PO4 + NaOH(надлишок) = Na3PO4 + 3H2O
2H3PO4 + 3K2O = 2K3PO4 + 3H2O.
Більшість металів не розчиняється у фосфатній кислоті внаслідок утворення нерозчинної щільної оксидної плівки на поверхні металу. У воді розчиняються тільки фосфати амонію та найбільш активних металів (Натрію, Калію).
Застосування фосфатної кислоти
Фосфатну кислоту здебільшого застосовують для добування фосфатних добрив. Окрім того, її використовують у лакофарбовій, металургійній та харчовій промисловості, а також для запобігання корозії металів.
якісна реакція на фосфатіон
Аналітичне визначення фосфат-іона ґрунтується на утворенні жовтого, не розчинного у воді осаду з йоном Аргентуму:
3Ag+ + PO34–→Ag3PO4 ↓.
75
www.e-ranok.com.ua

тема 10. неметали. нітРоген і фосфоР
виконайте контрольний тест
На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися слов никами, підручниками, посібниками, довідниками тощо.
тест 20 (контрольний)
1. Розведені розчини нітратної та ортофосфатної кислот можна відрізнити одну від одної за допомогою реагентів
А калій гідроксид Б крохмаль В розчин йоду
Гмідна пластівка
2.Укажіть йони, які містяться в розчині натрій ортофосфату.
А Na+ та SO42– |
В Na+ та PO3– |
|
Б Na+ та PO |
3– |
Г Na3+ та PO 3– |
4 |
|
4 |
3.Ортофосфатна кислота вступає в реакцію з речовинами:
Ахлоридною кислотою Б натрій гідроксидом В сульфур(IV) оксидом
Г карбонатною кислотою
4.Установіть відповідність між формулами нітратів та продуктами їх термічного розкладу.
А KNO3 |
1 |
N2O, H2O |
Б Cu(NO3)2 |
2 |
KNO2, O2 |
ВAgNO3 |
3 |
СuO, NO2, O2 |
Г NH4NO3 |
4 Ag, NO2, O2 |
|
5. Установіть послідовність утворення речовин у ланцюжку перетворень від амоніаку до солі ні-
тратної кислоти. |
В NO |
А KNO3 |
|
Б NO2 |
Г NH3 |
6. З 1 т амоніаку добувають 5,6 т розчину нітратної кислоти з масовою часткою HNO3 60%. Обчисліть масову частку (%) виходу продукції від теоретично можливого.
76
www.e-ranok.com.ua
