
- •Передмова
- •Тема 1. Основні хімічні поняття. Речовина
- •Тема 2. Хімічна реакція
- •Тема 4. Хімічний зв’язок
- •Тема 5. Суміші речовин. Розчини
- •Тема 6. Основні класи неорганічних сполук (оксиди, кислоти)
- •Тема 7. Основи, солі, амфотерні сполуки. Генетичні зв’язки між класами неорганічних сполук
- •Тема 8. Неметалічні елементи та їх сполуки. Неметали. Галогени
- •Тема 9. Оксисен і Сульфур
- •Тема 10. Неметали. Нітроген і Фосфор
- •Тема 11. Карбон і Силіцій
- •Тема 12. Загальні відомості про металічні елементи та метали
- •Тема 13. Лужні та лужноземельні елементи
- •Тема 14. Алюміній
- •Тема 15. Ферум
- •Тема 16. Теоретичні основи органічної хімії
- •Тема 17. Алкани, Алкени, Алкіни
- •Тема 18. Ароматичні вуглеводні. Бензин. Природні джерела вуглеводнів та їхня переробка
- •Тема 19. Спирти і феноли
- •Тема 20. Альдегіди, Карбонові кислоти
- •Тема 21. Естери. Жири
- •Тема 22. Вуглеводи
- •Тема 23. Аміни. Амінокислоти. Білки
- •Відповіді до тестів
- •Відповіді до тестів у форматі ЗНО

тема 13. лужні та лужноЗемельні елементи
Тема 13. Лужні та лужноземельні елементи
Перевірте свої знання
Виконайте тест 25. На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися словниками, підручниками, посібниками, довідниками тощо.
тест 25 (вступний)
1.Укажіть хімічну формулу негашеного вапна.
АCaO
Б Ca(OH)2
В CaSO3
Г Ca(HCO3)2
2. Укажіть металічний елемент, солі якого зумовлюють твердість кісток.
А Na |
ВAl |
Б Ca |
Г Fe |
3. Визначте речовину «Х», що відповідає схемі перетворень Ca →X→ CaCO3.
А Ca(NO3)2
Б Ca(OH)2
В CaSO3
Г CaI2
4. Установіть відповідність між назвою мінералу та формулою сполуки:
А доломіт |
1 |
Ca3(PO4)2 |
|
Б гіпс |
2 |
CaCO3 |
|
В кальцит |
3 |
CaSO4 |
∙ 2H2O |
Г фосторит |
4 |
CaCO3 |
∙ MgCl2 |
5. Установіть генетичний ланцюжок добування калій сульфата А гідроксид калію Б калій В оксид калію
Гсульфат калію
6.Який об’єм карбон(IV) оксиду (м3) виділяється, якщо подіяти нітратною кислотою на 53 кг натрій карбонату?
93
www.e-ranok.com.ua

тема 13. лужні та лужноЗемельні елементи
теоретична частина
Маючи в зовнішньому електронному шарі тільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми лужних елементів досить легко віддають електрон, тобто характеризуються низькою енергією йонізації.
Зі сполук лужних металів широко розповсюджені в природі лише сполуки Натрію й Калію. У вигляді простих речовин у природі вони не зустрічаються, тому що занадто активні.
Найважливішими природними сполуками Натрію й Калію є: натрій хлорид (NaCl), натрій сульфат — мірабіліт (Na2SO4 . 10H2O), сильвініт (NaCl. KCl), карналіт (KCl. MgCl2 . 6H2O). Сполуки інших лужних металів зустрічаються дуже рідко. Францій отриманий штучно в ядерних реакціях.
Лужні метали надзвичайно активні і є найсильнішими серед відомих відновників, тому електроліз водних розчинів солей цих металів не призводить до добування самих металів, а лише до утворення лугів. Прості речовини добувають електролізом розплавів їхніх галогенідів, найчастіше — хлоридів, що утворюють природні мінерали. Металічний натрій у промисловості добувають електролізом розплаву натрій хлориду з інертними (графітними) електродами.
фізичні властивості натрію й калію
Натрій і калій — сріблясто-білі метали, що мають добру електропровідність; м’які, легші від води (плавають на її поверхні, реагуючи з нею).
хімічні властивості натрію й калію
Натрій і калій активно взаємодіють із галогенами:
2Na + Cl2 →2NaCl;
2K + Br2 →2KBr .
На повітрі натрій і калій активно згорають. Причому продуктом реакції є не оксиди, а пероксиди або надпероксиди:
2Na + O2 → Na2O2;
K + O2 → KO2.
Як і всі лужні метали, натрій і калій активно взаємодіють із водою з утворенням водню та відповідних лугів. Калій найчастіше при такій взаємодії вибухає:
2Na +2H2O →2NaOH + H2 .
Застосування сполук натрію й калію
Натрій та його сплав з калієм застосовують як рідкометалеві теплоносії. У металургії натрійметричним методом добувають низку тугоплавких металів, а відновлюючи натрієм KOH, виділяють калій. Окрім того, натрій використовують як зміцнювальну добавку свинцевих сплавів. В органічному синтезі натрій використовують для добування багатьох речовин. Він слугує також каталізатором при добуванні деяких органічних полімерів. Із ртуттю натрій утворює твердий сплав — амальгаму натрію, яку іноді використовують як більш м’який відновник замість чистого металу. Натрій гідроксид застосовують для очищення продуктів переробки нафти, у миловарній, паперовій, текстильній та інших галузях промисловості, а також при виробництві штучного волокна.
94
www.e-ranok.com.ua
тема 13. лужні та лужноЗемельні елементи
Калій потрібен у значній кількості для живлення рослин, тому його широко використовують як добриво у вигляді нітрату. Поташ K2CO3 використовують при виробництві скла та рідкого мила.
Кальцій
характеристика хімічного елемента
Кальцій перебуває в головній підгрупі II групи, належить до лужноземельних металів разом з Барієм та Стронцієм. У зовнішній оболонці він має два електрони й може легко віддавати їх, утворюючи йони зі стійкими конфігураціями інертних газів.
Поширеність у природі
Кальцій має велику хімічну активність, тому зустрічається в природі тільки у вигляді сполук. Найважливіші природні сполуки Кальцію: а) вапняк, мармур, крейда (CaCO3); б) гіпс (CaSO4 . 2H2O); в) фосфорит і апатит (Ca3 (PO4 )2 );г) доломіт (CaCO3 . MgCO3).
фізичні властивості
Кальцій — метал сріблясто-білого кольору, дуже легкий, як і лужні метали, але значно твердіший за них і має більш високу температуру плавлення (+851 °С). Кальцій зберігають під шаром гасу.
Добування
Кальцій добувають шляхом електролізу його розплавленого хлориду.
CaCl2 ел. струм→Ca +Cl2.
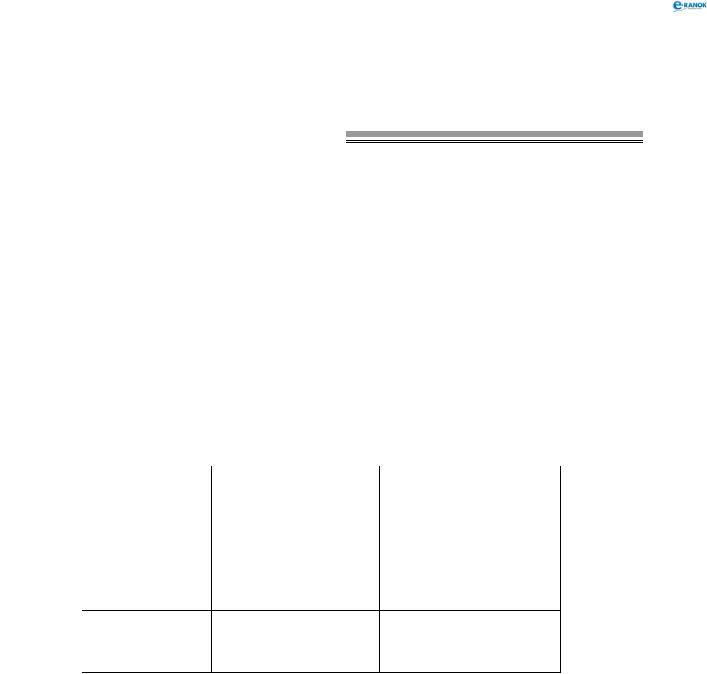
хімічні властивості
|
|
O2 |
|
|
|
CaO |
|
|
|
|
|
|
|
C, t° |
|
|
|
|
|
|
|
CaC2 |
|
|
|
|
|
|
|
Hal |
|
|
|
|
|
|
|
CaCl2 |
|
|
|
|
|
|
|
H2 |
|
|
|
CaH2 |
|
|
|
|
|
Ca |
+ |
S, t° |
CaS |
|
|
N2 , t°  Ca3N2
Ca3N2
P, t° |
Ca3 P2 |
|
H2O  Ca(OH)2 + H2↑
Ca(OH)2 + H2↑
HCl  CaCl2 + H2↑
CaCl2 + H2↑
Хімічні властивості Mg аналогічні.
95
www.e-ranok.com.ua
тема 13. лужні та лужноЗемельні елементи
Найважливішою сполукою Кальцію є його карбонат СаCO3. Він являє собою основну складову частину вапняку, мармуру, крейди, а також входить до складу доломіту (MgCO3 . СаCO3). Кальцій карбонат використовують у виробництві цементу, сталі, скла. Кальцій та кальцій карбід застосовують в органічній хімії. А ще Кальцій відіграє дуже важливу роль у біохімічних процесах, які протікають у живих організмах.
Магній застосовується для одержання легких сплавів, як відновник рідкісних металів і деяких неметалів (Si).
твердість води
Твердість води — це природна властивість води, обумовлена присутністю в ній розчинених солей Кальцію та Магнію. Сумарну концентрацію йонів Магнію й Кальцію називають загальною твердістю води. Розрізняють постійну й тимчасову твердість води, їхня порівняльна характеристика подана в таблиці.
характеристика
Причини твердості
Джерела твердої води
Усунення твердості
Тимчасова твердість, |
Постійна твердість, |
або карбонатна |
або некарбонатна |
Наявність розчинених гід- |
Наявність сульфатів, хлори- |
рогенкарбонатів Магнію |
дів або деяких інших солей |
Mg(HCO3 )2 й Кальцію |
Кальцію й Магнію (наприклад, |
Ca(HCO3 )2 |
CaSO4, MgCl2 та ін.) |
Річкові й озерні води, водо- |
Морська вода, вода солоних |
провідна вода, різні газовані |
озер, природні негазовані міне- |
мінеральні води |
ральні води |
Усувається при кип’ятінні, |
Не усувається при кип’ятінні, |
при додаванні кислот або |
але зникає при додаванні соди |
соди (Na2CO3 ) |
(Na2CO3 ) або при використанні |
|
йонообмінних смол |
Калійні добрива: K2CO3 – поташ; KNO3 – калійна селітра; KCl – калій хлорид; K2SO4 – калій сульфат; KCl ∙ NaCl – сильвініт.
96
www.e-ranok.com.ua

тема 13. лужні та лужноЗемельні елементи
виконайте контрольний тест
На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися слов никами, підручниками, посібниками, довідниками тощо.
тест 26 (контрольний)
1. Укажіть формулу харчової соди.
А Na2CО3
Б NaCl
В NaHCO3
ГNaOH
2.Укажіть продукт взаємодії кальцію з водою.
А Ca(OH)2 |
+ H2O |
В CaO + H2 |
Б Ca(OH)2 |
+ H2 |
Г Ca(HCO3)2 |
3. Визначте пари речовин, що відповідають сполукам «Х1» та «Х2» у схемі перетворень:
Ca O→ Х1 → CaCl2 → Х2. А CaO та CaCO3
Б Ca(OH)2 та CaCO3
2та CaC2
ГCaO та H2O
4.Установіть відповідність між реагентами реакцій обміну та йонними рівняннями цих реакцій
ускороченому вигляді: В
А K |
SO |
+ Ba(NO |
) |
→ |
1 Al3+ + 3OH– =Al(OH) |
3 |
|||||||||
2 |
|
4 |
|
+ Na |
3 |
2 |
|
2 |
Ba2+ |
+ SO 2– |
= BaSO |
|
|
||
Б Ba(OH) |
CO |
3 |
4 |
|
|||||||||||
ВAlCl |
|
2 |
2 |
|
|
3 |
|
4 |
|
O |
|
||||
+ KOH→ |
|
|
H+ + OH– = H |
|
|
|
|||||||||
|
3 |
|
|
|
|
|
|
4 |
Ba2+ |
+ CO 2– |
2 |
|
|
|
|
Г NaOH + HCl→ |
|
|
= BaCO |
3 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
5. Установіть послідовність утворення речовин у ланцюгу перетворень лужноземельного металу на кальцій карбонат:
А CaCO3
Б Ca(OH)2 В Ca
ГCaO
6.Змішали 0,5 моль NaOH і 0,5 моль H2SO4. Обчислити масу солі.
97
www.e-ranok.com.ua
