
- •Передмова
- •Тема 1. Основні хімічні поняття. Речовина
- •Тема 2. Хімічна реакція
- •Тема 4. Хімічний зв’язок
- •Тема 5. Суміші речовин. Розчини
- •Тема 6. Основні класи неорганічних сполук (оксиди, кислоти)
- •Тема 7. Основи, солі, амфотерні сполуки. Генетичні зв’язки між класами неорганічних сполук
- •Тема 8. Неметалічні елементи та їх сполуки. Неметали. Галогени
- •Тема 9. Оксисен і Сульфур
- •Тема 10. Неметали. Нітроген і Фосфор
- •Тема 11. Карбон і Силіцій
- •Тема 12. Загальні відомості про металічні елементи та метали
- •Тема 13. Лужні та лужноземельні елементи
- •Тема 14. Алюміній
- •Тема 15. Ферум
- •Тема 16. Теоретичні основи органічної хімії
- •Тема 17. Алкани, Алкени, Алкіни
- •Тема 18. Ароматичні вуглеводні. Бензин. Природні джерела вуглеводнів та їхня переробка
- •Тема 19. Спирти і феноли
- •Тема 20. Альдегіди, Карбонові кислоти
- •Тема 21. Естери. Жири
- •Тема 22. Вуглеводи
- •Тема 23. Аміни. Амінокислоти. Білки
- •Відповіді до тестів
- •Відповіді до тестів у форматі ЗНО

тема 20. альдегіди, каРбонові кислоти
Тема 20. Альдегіди, Карбонові кислоти
Перевірте свої знання
Виконайте тест 39. На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися словниками, підручниками, посібниками, довідниками тощо.
тест 39 (вступний)
1. Позначте загальну формулу насичених одноосновних карбонових кислот.
А CnH2n+1COOH
Б CnH2nCOOH
В CnH2n+1COOCH3
Г CnH2n+1CHO
2. Найсильнішою кислотою з наведених сполук є:
А Cl – CH2 – CH2 – OH
Б Cl – CH2COOH
В CH3 – COOH
Г CHCl2 – COOH
3. Укажіть речовину, із якою реагує оцтова кислота. А метан
Б натрій гідроксид В мідь
Гнатрій хлорид
4.Установіть відповідність між реагентами та продуктами реакцій.
А CH3COOH + Cu(OH)2 |
1 |
(CH3COO)2Mg + H2 |
Б CH3COOH + Mg |
2 |
CH3COOH + CuOH + H2O |
В CH3CHO + Cu(OH)2 |
3 |
(CH3COO)2Mg + H2O |
Г CH3COOH + MgO |
4 |
(CH3COO)2Cu + H2O |
5. Розташуйте речовини в ряд за збільшенням кислотних властивостей.
А CH3COOH
Б C2H5COOH В HCOOH
ГC15H31COOH
6.У розчин оцтової кислоти масою 300 г помістили надлишок питної соди. У результаті реакції виділиться газ об’ємом 18 л (н. у.). Розрахуйте масову частку кислоти (%) у вихідному розчині.
138
www.e-ranok.com.ua

тема 20. альдегіди, каРбонові кислоти
теоретична частина
Альдегіди
Поняття про альдегіди
До альдегідів належать сполуки, які у своєму складі містять альдегідну групу. Альдегідна група є функціональною групою альдегідів:
O
 C
C
H
Скорочено альдегідну групу записують: . Найпростішим альдегідом є мурашиний альдегід, у молекулі якого до альдегідної групи приєднаний атом Гідрогену, його молекулярна формула — CH2O.
Зв’язки атома Карбону в альдегідній групі аналогічні до зв’язків у ненасичених вуглеводнях: три його валентні електронні хмари в стані sp2-гібридизації утворюють зв’язки із двома атомами Гідрогену (в інших альдегідах — з атомами Гідрогену й Карбону) і з атомом Оксигену.
З’єднані подвійним зв’язком атоми Оксигену й Карбону мають різну електронегативність. Унаслідок цього область перекривання електронів (область найбільшої електронної густини) зміщена до атома Оксигену. Таким чином, подвійний зв’язок C = O поляризований:
δ−
 O
O
δ+ C
H
Назви альдегідів
формула
HCHO
CH3CHO
C2H5CHO C3H7CHO C4H9CHO
Назва IUPAC |
Тривіальна назва |
|
Метаналь |
Формальдегід, |
|
мурашиний альдегід |
||
|
||
Етаналь |
Ацетальдегід, |
|
оцтовий альдегід |
||
|
||
Пропаналь |
Пропіоновий альдегід |
|
Бутаналь |
Масляний альдегід |
|
Пентаналь |
Валеріановий альдегід |
Загальна формула насичених альдегідів CnH2nO.
Альдегіди — безбарвні речовини, з характерним запахом. Перший член гомологічного ряду альдегідів — формальдегід — при звичайних умовах є газоподібною речовиною (на відміну від спиртів).
хімічні властивості альдегідів
1. Горіння.
CH2O + O2 → CO2 + H2O .
139
www.e-ranok.com.ua
тема 20. альдегіди, каРбонові кислоти
2. Гідрування. Гідрування альдегідів проходить у присутності каталізаторів (Ni, Pt, Pd тощо).
H |
|
|
|
|
H |
|
|
|
|
|
|
H C |
H |
|
|
H |
C H |
|
|
|
|
||
C |
|
+ |
H |
|
або CH3 CH2 OH |
H |
O |
H |
H |
CH |
|
|
|
|
|
O H |
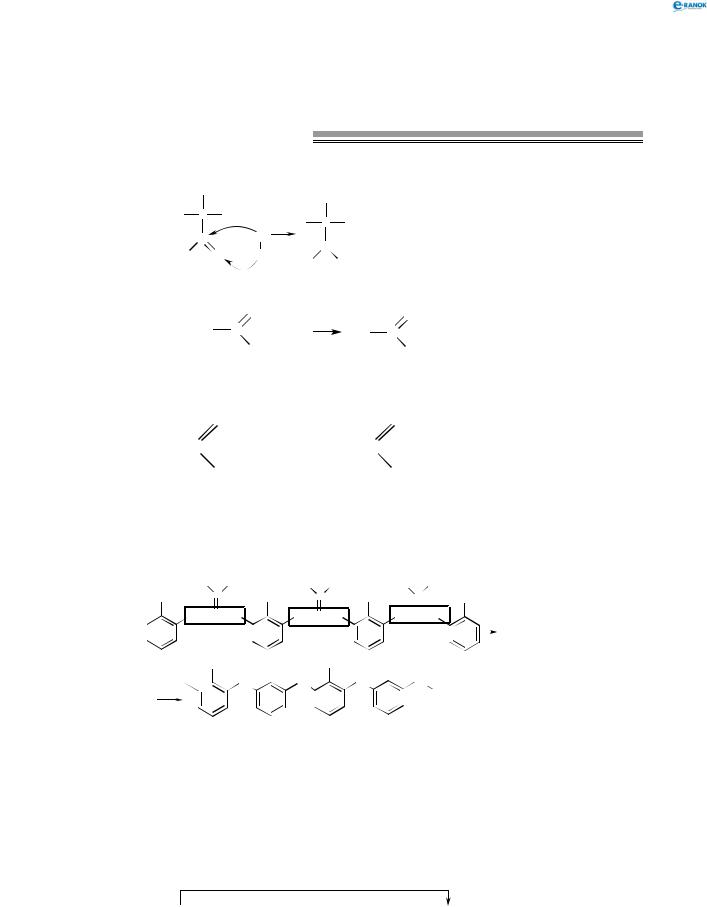
3. Окиснення альдегідів (реакція «срібного дзеркала»).
+1 |
O |
|
t0 |
|
O |
|
|
|
+3 |
|
|||
H3C C |
+ Ag |
O |
+ 2Ag |
|||
|
H C C |
|||||
|
2 |
|
|
3 |
|
|
|
H |
|
|
|
OH |
Аналогічно до аргентум оксиду купрум(ІІ) гідроксид здатний окиснювати альдегіди. При цьому утворюється жовтий осад одновалентного купрум(І) гідроксиду:
O |
O |
t0 |
+ 2CuOH + H2O |
H3C — C + 2Cu(OH)2 → H3C — C |
|
H |
CH |
При подальшому нагріванні відбувається розклад купрум(І) гідроксиду й утворення червоного осаду одновалентного купрум(І) оксиду:
|
|
|
t0 |
|
+ H2O. |
|
|
|
|
|
2CuOH → Cu2O |
|
|
||
4. |
Поліконденсація. |
|
|
|
|
|
|
|
H |
H |
H |
H |
H |
H |
|
|
OH |
C |
OH |
C |
OH |
C |
OH |
|
H |
O H |
H |
O H |
H O H |
|
|
|
OH |
OH |
OH |
OH |
|
|
|
|
|
CH |
CH |
|
CH |
CH2 |
|
|
|
2 |
2 |
2 |
|
|
|
|
–H2O |
|
|
|
|
|
|
Добування альдегідів |
|
|
|
|
|
|
|
1. |
Окиснення спиртів. |
|
|
|
|
|
|
|
CH3 − CH2 − OH + CuO → CH3 − CHO + H2O + Cu. |
|
|||||
2. |
Окиснення метану. |
|
|
|
|
|
|
Методдобуванняформальдегідузметанускладається,восновному,зкількохстадій:1)шляхомвзаємодії метану з водною парою добувають водний газ (суміш водню й карбон(ІІ) оксиду CO); 2) із нього синтезують метиловий спирт; 3) потім спирт окиснюють у мурашиний альдегід:
CH4 + H2O  CO + H2
CO + H2  CH3OH
CH3OH  CH2O
CH2O
3. Реакція Кучерова.
CH ≡ CH + H2O → CH2 = CH − OH → CH3 − CHO.
140
www.e-ranok.com.ua

тема 20. альдегіди, каРбонові кислоти
4. Окиснення етилену киснем.
2CH2 = CH2 + O2 → 2CH3 − CHO.
Застосування альдегідів
Формальдегід. Застосовують у виробництві термореактивних пластмас, феноло-формальдегідних та сечовино-формальдегідних смол.
Формальдегід є біологічно активною речовиною: під його впливом відбувається згортання (денатурація) білка. На цьому ґрунтується його (точніше його водного розчину — формаліну) застосування як засобу для дезінфекції, як дубильного засобу та консерванта для анатомічних препаратів. Формаліном називають 37—40% водний розчин формальдегіду, до якого як інгібітор полімеризації додають 6—15% метанолу. У медицині також використовують похідні формальдегіду — гексаметилентетрамін (уротропін).
Ацетальдегід. Найважливіші застосування оцтового альдегіду ґрунтуються на використанні його реакцій окиснення та відновлення. За допомогою першої з них добувають оцтову кислоту, за допомогою другої у деяких країнах — етиловий спирт. Основне застосування оцтового альдегіду — добування оцтової кислоти.
Карбонові кислоти
Карбонові кислоти належать до оксигеновмісних органічних сполук і мають у своєму складі функціональну групу, що визначає їхню приналежність до кислот.
O
функціональна група |
C |
OH
У кислот функціональна група поєднує в собі карбонільну та гідроксильну групи — COOH. Цю групу називають карбоксильною групою.
Класифікація карбонових кислот
Класифікація за вмістом Оксигену: оскільки до складу функціональної групи кислот входять атоми Оксигену, то всі карбонові кислоти належать до оксигеновмісних кислот.
Класифікація за силою кислот: усі карбонові кислоти є слабкими кислотами.
Класифікація за основністю кислот: так само, як неорганічні кислоти, органічні поділяють за основністю.Причомуосновністькислотвизначаєтьсякількістюкарбоксильнихгруп.
Одноосновні кислоти
O |
O |
H C C |
H3C CH2 C |
3 |
OH |
OH |
оцтова |
|
пропіонова |
|
||
Двохосновні кислоти |
|
|
|
|
|
O |
O |
O |
|
O |
|
C |
CH CH C |
|
|||
C (CH2)6 C |
|
OH |
|||
OH |
HO |
OH OH |
|||
HO |
|||||
|
|
||||
коркова |
|
|
винна |
|
|
141
www.e-ranok.com.ua

тема 20. альдегіди, каРбонові кислоти
Класифікація за вуглеводневим радикалом: карбонові кислоти можна класифікувати за вуглеводневим радикалом — насичені, ненасичені (акрилова) та ароматичні (бензойна, фталева, корична, саліцилова).
Назва карбонових кислот та їхніх солей
формула |
Тривіальна назва |
Назва солей |
Назва IUPAC |
|
|
HCOOH |
Мурашина |
Форміат (метаноат) |
Метанова |
|
|
CH3COOH |
Оцтова |
Ацетат (етаноат) |
Етанова |
|
|
CH3CH2COOH |
Пропіонова |
Пропіонат (пропаноат) |
Пропанова |
|
|
CH3 (CH2 )2 COOH |
Масляна |
Бутират (бутаноат) |
Бутанова |
|
|
CH3 (CH2 ) COOH
Пентанова 3
CH3 (CH2 ) COOH
Гексанова 4
CH3 (CH2 )14 COOH
Гексадеканова
CH3 (CH2 )16 COOH
Октадеканова
Валеріанова Валерат (пентаноат)
Капронова Капронат (гексаноат)
Пальмітинова Пальмітат
 Стеаринова
Стеаринова  Стеарат
Стеарат
CH3 (CH2 )7 − CH = CH − (CH2 )7 COOH Олеїнова |
Олеат |
Октадеценова |
|
Загальна формула гомологічного ряду одноосновних насичених карбонових кислот:
(CnH2n + 1COOH або CnH2nO2).
Ізомерія кислот зумовлена будовою радикала.
хімічні властивості карбонових кислот
1. Вплив кислот на індикатори за рахунок дисоціації на йони:
CH3COOH CH3COO− +H+.
2. Взаємодія з металами:
Zn + 2CH3COOH → Zn(CH3COO)2 + H2. 3. Взаємодія з оксидами металів:
MgO + 2CH3COOH → Mg(CH3COO)2 + H2O.
4. Взаємодія з лугами:
CH3COOH + NaOH → CH3COONa + H2O.
5. Горіння:
Як і більшість органічних сполук, карбонові кислоти дуже добре горять, причому чим більшим є вуглеводневий радикал, тим більша ймовірність протікання реакції горіння з виділенням сажі (вільного вуглецю):
CH3COOH +2O2 →2CO2 + H2O , C17H35COOH + 8O2 →17C +18H2O.
142
www.e-ranok.com.ua
тема 20. альдегіди, каРбонові кислоти
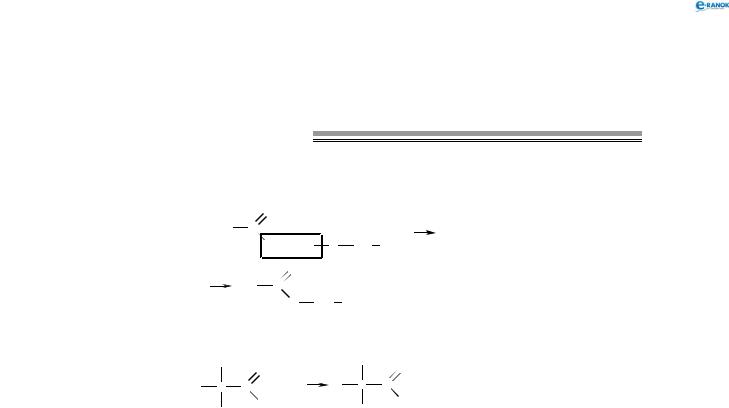
6. Реакція естерифікації.
Карбонові кислоти здатні взаємодіяти зі спиртами з утворенням естерів:
|
|
O |
|
|
|
H3C |
C |
|
|
|
|
|
|
OH + H |
O |
CH2 |
CH3 |
|
|
O |
|
|
|
|
H C |
C |
|
+ H2O |
|
|
3 |
|
|
|
|
|
|
O |
CH2 |
CH3 |
|
7. Взаємодія з хлором. |
|
|
|
|
|
H |
|
O |
|
H |
O |
|
|
|
|
||
H C |
C |
+ Cl2 |
H |
C |
C + HCl |
H |
|
OH |
|
Cl |
OH |
|
|
|
|
||
Застосування мурашиної кислоти.
Оскільки при нагріванні мурашиної кислоти з оцтовою виділяється чадний газ, то її часто використовують у лабораторії для добування чистого чадного газу.
Мурашину кислоту широко використовують в органічному синтезі, як протраву при фарбуванні текстилю, у бджільництві проти вароатозу, для добування пестицидів тощо. У медицині мурашину кислоту застосовують у вигляді 1% спиртового розчину (мурашиний спирт) як розтирку при невралгіях, міозитах та інших захворюваннях.
Застосування оцтової кислоти.
Реакцією плюмбум(ІІ) оксиду з оцтовою кислотою добувають плюмбум(ІІ) ацетат Pb(CH3COO)2 (його також називають свинцевим цукром, унаслідок солодкого смаку), розчин якого застосовують у медицині (свинцева примочка).
Взаємодією ферум(ІІІ) гідроксиду з кислотою добувають ферум(ІІІ) ацетат Fe(CH3COO)3 , відомий як протрава при фарбуванні: нанесений на тканину, він, з одного боку, міцно втримується волокнами, з іншого боку, добре втримує барвник.
На мову хімії можна перекласти й використання оцтової кислоти для добування естерів, наприклад етилового естеру та інших естерів, які через їхній приємний запах використовують в парфумерній та харчовій промисловості.
У сільському господарстві та харчовій промисловості оцтову кислоту, а також її найближчі гомологи — мурашину й пропіонову — використовують як консерванти, що запобігають гнильним процесам і зберігають високу поживність кормів.
Добування кислот
1. Окиснення метану:
2СН4 + 3О2 →t0 2НСООН + 2Н2О
2. З чадного газу:
СО + NaOH → HCOONa, HCOONa + HCl → HCOOH + NaCl
143
www.e-ranok.com.ua

тема 20. альдегіди, каРбонові кислоти
3. Окиснення бутану:
2C4H10 + 5O2 → 4CH3COOH + 2H2O
4. Окиснення етанолу:
C2H5OH + O2 → CH3COOH + H2O
5. Окиснення етаналю:
CH3COH +Ag2O → CH3COOH + 2Ag
виконайте контрольний тест
На його виконання відводиться 15 хвилин. Під час роботи над тестом не можна користуватися слов никами, підручниками, посібниками, довідниками тощо.
тест 40 (контрольний)
1. |
Укажіть речовину, яка утворюється при окисненні альдегіду. |
||
|
А спирт |
В естери |
|
|
Б карбонова кислота |
Г вуглеводень |
|
2. |
Укажіть речовину, для якої відбувається реакція «срібного дзеркала». |
||
|
А метаналь |
|
В оцтова кислота |
|
Б етанол |
Г фенол |
|
3.Укажіть назву функціональної групи, наявної у карбонових кислот.
Агідроксильна
Б карбонільна В карбоксильна
Гальдегідна
4.Установіть відповідність між реагентами та продуктами реакцій.
А HCHO + H2 → |
1 |
CO2 + H2O +Ag |
Б HCHO + Cu(OH)2 → |
2 |
HCOOH + CuOH + H2O |
В HCHO +Ag2O → |
3 |
CH3OH |
Г HCOOH +Ag2O → |
4 |
HCOOH +Ag |
5. Установіть генетичний ланцюг утворення натрій етаноату. |
||
А C2H5OH |
В C2H4 |
|
Б CH3COOH |
Г C2H6 |
|
6.Визначити масу етаналю (т), яку можна добути з 2 т технічного кальцій карбіду, масова частка домішок у якому 15%.
144
www.e-ranok.com.ua
