
Otvety_KhTP
.pdf

22.Прямая и обратная задачи химического равновесия.

23.Прямые и косвенные измерения в химической технологии.
Прямыерезультат непосредственных измерений величины при помощи прибора. Косвенныеполученные из результатов прямых измерений (скорость реакции, Еа, порядок рекции, скорость потока)
Часто прямое измерение физической величины оказывается невозможным или слишком трудоемким. При косвенных измерениях результат определяется по формулам на основе результатов прямых измерений других величин (например, определение электрического cопротивления образца по измеренным силе тока и напряжению). Одну и ту же величину часто можно найти путем как прямых, так и косвенных измерений. Например, скорость автомобиля может быть определена по спидометру (прямое измерение) или найдена делением пройденного пути на время движения (косвенное измерение).
При косвенных измерениях погрешность искомой физической величины накапливается из погрешностей прямых измерений величин, входящих в расчетную формулу.
24.Метод наименьших квадратов в задачах моделирования ХТП.
Метод наименьших квадратов играет важнейшую роль при решении обратных задач моделирования.
Общий вид уравнения математической модели может быть представлен как
yi=Fi (X, B), (1)
где В = (b0, b1,….,bp)-вектор параметров. Запись (1) отражает тот факт, что в модель обязательно входят параметры. Возможны два основных класса задач, связанных с уравнениями вида (1).
Задача первого класса. Нам заданы X, B. В этих условиях следует определить yi. Это прямая задача. В такой формулировке она сводится к расчету функции, заданной в явной форме. Если рассмотреть переменные X, то решение данной задачи дает изменения величины y, или распределение y в пространстве векторов.
Задача второго класса. Нам задано распределение (как правило, в виде совокупности экспериментальных данных) y в пространстве факторов X и известен общий вид функции (1). Требуется определить параметры b0, b1,….,bp.Это обратная задача.
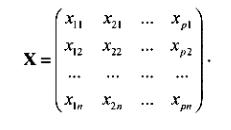
Метод наименьших квадратов.
Метод наименьших квадратов отвечает следующей постановке задачи. Вид уравнений математического описания задается. Он может вытекать из структуры объекта либо соответствовать, например, многочлену 1, 2 или 3-й степени при эмпирическом подходе. Важно, что обработка опытных данных проводится для определенного вида уравнений. Неизвестны лишь коэффициенты этих уравнений – параметры модели, которые и надо определить. В общем виде уравнение можно записать так:
y=F(х1,x2,…,xp, b0, b1,….,bp), (2)
где (х1,x2,…,xp)-вектор контролируемых факторов; (b0, b1,….,bp)- вектор параметров (коэффициентов). Задача состоит в том, чтобы
по опытным данным наилучшим образом оценить значения параметров b.
Обратим внимание на то, что в каждом эксперименте допускается случайная ошибка, поэтому получаемые значения параметров будут оценками истинных значений. Проведенный эксперимент можно рассматривать как выборку, при этом генеральная совокупность мыслится как бесконечное число возможных опытов на данном объекте. Поэтому к такой задаче целесообразно применить аппарат математической статистики.
Примем, что в опытах значения факторов х задавались с пренебрежимо малой ошибкой, т.е. практически точно. Но значения отклика у получались со случайными ошибками. Кроме того, будем считать, что все ошибки имеют одинаковый закон распределения и различаются только случайным образом (все измерения сделаны с одинаковой точностью). В этом случае метод наименьших квадратов сводится к следующему: наилучшими будут те значения параметров b, при которых сумма квадратов отклонений расчетных величин у от опытных окажется наименьшей.
Пусть функция задана в виде (2). Запишем условия всех опытов в виде таблицы – матрицы плана эксперимента:
(3)

Здесь каждая строка – условия одного опыта; каждый столбец – значения одного фактора в разных опытах; xij – значение i -гo фактора в j -м опыте.
Рассмотрим также вектор-столбец результатов эксперимента:
(4)
Расчетное значение  для j -й строки матрицы X будет иметь вид:
для j -й строки матрицы X будет иметь вид:
(5)
Приведенное выше определение метода наименьших квадратов может быть записано формулой:
(6)
Те значения b, при которых сумма S окажется минимальной, и будут наилучшими. Как известно, для отыскания минимума функции нескольких переменных нужно приравнять нулю ее частные производные по всем аргументам. Обратите внимание на то, что в данном случае S следует дифференцировать по коэффициентам b. Действительно, факторы х сейчас выступают как постоянные величины: это условия уже сделанных опытов, изменять их мы не можем. Именно коэффициенты - это те величины, от которых зависит значение S. Таким образом, наилучшие значения могут быть найдены как решение системы уравнений:
(7)
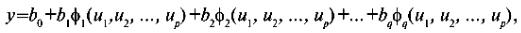
Уравнения (7) называются нормальными.
Отмечу, что если ошибки определения у – независимые нормально распределенные случайные величины с нулевым математическим ожиданием и одинаковыми (хотя и не известными нам) дисперсиями, то решение системы (8) даст состоятельные, несмещенные и эффективные оценки коэффициентов b, т. е. действительно наилучшие с точки зрения математической статистики.
Проще всего расчет методом наименьших квадратов осуществлять в случае, когда уравнение (2) линейно относительно коэффициентов b. Это значит, что его можно записать в следующем виде (в отличие от уравнения (2) здесь факторы обозначены буквой u):
(8)
причем каждая функция φ(u1, …, up) должна быть известна заранее полностью , т. е. не включать никаких оцениваемых параметров. Параметры b входят в формулу только как множители при этих функциях. В этом случае говорят о линейном оценивании параметров.
25. Применение вариационного исчесления в задачах оптимизации ХТП.
Вариационное исчисление – решение задач, когда решение представляется не как совокупность значений конечного числа переменных, а как совокупность функций, вид которых заранее не известен.
Так бывает, если критерий зависит не от значений каких-то факторов, а от характера их непрерывного изменения: например, если протекание переходного процесса определяется непрерывным изменением управляющего воздействия во времени или если состав смеси на выходе из аппарата идеального вытеснения определяется профилем температуры по всей его длине.
26. Кинетическое уравнение Гульдберга и Вааге, смысл его параметров.
Основным законом химической кинетики является закон действующих масс, сформулированный норвежскими учеными

Гульдбергом и Вааге. Закон Гульдберга и Вааге в химической кинетике гласит: скорость химической реакции пропорциональна
произведению текущих концентраций реагирующих веществ:
ri=k*Cia
где k – константа скорости данной реакции, Сi – текущая концентрация i-го реагента, α - порядок реакции по i-му реагенту.
Порядок реакции – это формальная величина. С математической точки зрения – это «подгоночный параметр», который позволяет описывать кинетические кривые с приемлемой точностью законом Гульдберга и Вааге. Поэтому в приведенной формулировке говорится о пропорциональности скорости реакции текущим концентрациям без конкретизации характера этой пропорциональности.
Сумма порядков реакции по отдельным компонентам называется общим порядком реакции.
В закон Гульдберга и Вааге входит параметр, названный нами константой скорости. Именно он и характеризует первую причину, влияющую на скорость – природу реагирующих веществ.
Рассмотрим кинетические уравнения реакций нулевого, 1-го и 2-го порядков.
Для реакции нулевого порядка по реагенту кинетическое уравнение имеет вид:
Для реакции 1-го порядка по реагенту кинетическое уравнение имеет вид:
Для реакции 2-го порядка (А + В = D Так протекает подавляющее большинство элементарных актов химических реакций), в общем случае кинетическое уравнение имеет вид:

27. Уравнение Аррениуса, смысл его параметров.
Уравнение Аррениуса устанавливает зависимость константы скорости k химической реакции от температуры T:
(1)
Параметрами уравнения (1) являются предэкспоненциальный множитель, или предэкспонента, А и энергия активации Е.
Роль энергии активации. Формальная кинетика не занимается физическим смыслом величин А и Е, но для многих задач важно понимать, именно какая характеристика реакции определяется величиной Е. Величина k определяется совокупностью значений Е и А, поэтому сама по себе величина Е еще не определяет, быстро или медленно проходит реакция.
Почти всегда, чем больше энергия активации, тем больше предэкспонента. Реакция с меньшей Е имеет и меньшее значение А, а влияния обоих параметров противоположны. Прологарифмируем уравнение (1):
(2)
Получили линейную зависимость ln k от 1/Т, коэффициентами которой являются ln A и –E/R. Изобразим ее на графике для двух реакций: у первой величина E меньше (и, согласно изокинетическому правилу, ln A тоже меньше), чем у второй (рис.1а).
Рис.1 Аррениусовы зависимости для двух реакций: a – по уравнению (2), б – по уравнению (1)
Чем больше энергия активации, тем сильнее скорость реакции зависит от температуры.
Так, для обратимых экзотермических реакций Е2 > Е1: энергия активации обратной реакции больше, чем прямой. Поэтому с ростом температуры коэффициент k2 растет быстрее, чем k1, в результате чего равновесие смещается влево. При эндотермических обратимых реакциях наоборот Е2 < Е1, и с ростом температуры равновесие смещается вправо. Так устанавливается связь уравнения Аррениуса с правилом Ле Шателье.
Если рассматривается сложная реакция, некоторые стадии которой являются для нас побочными, то соотношение энергий активации различных стадий определяет влияние температуры на селективность: при нагревании преимущественно ускоряются те стадии, которые характеризуются большей энергией активации. Нужно иметь в виду, что в одном важном случае снижение энергии активации действительно приводит к ускорению реакции – это катализ. Механизм действия катализатора связан со снижением энергии активации реакции.
28. Сложные химические реакции, особенности их протекания.
Химическая кинетика определяет простые (одностадийные) реакции как такие, которые по существу проходят в одну стадию; простая реакция содержит один элементарный акт. Однако такие реакции, которые проходят как истинно одностадийные, встречаются редко. В феноменологической кинетике оказывается удобным говорить о формально простых реакциях. Так называют реакции, которые можно формально представить как протекающие в одну стадию и записать в виде (1).
а1А1+а2А2+...+аnАn=0 (1)
По существу реакция может быть сложной, проходящей через какие-то промежуточные стадии, но если в условиях рассматриваемой задачи промежуточные продукты не обнаруживаются, то реакция будет считаться формально простой. В какой-либо другой задаче та же реакция может рассматриваться как сложная – это будет означать лишь переход к иному формальному рассмотрению.
Несмотря на условность понятия «формально простая реакция» оно удобно и поэтому часто используется. При этом многие реакции всегда приходится рассматривать как сложные: они явно
