
Лаб 3.1
.docx

МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
|
Институт тонких химических технологий им. М.В. Ломоносова |
|
(наименование Института)
|
Кафедра общей химической технологии |
|
(наименование кафедры)
Лабораторная работа №3.1
Моделирование и исследование протекания сложной реакции в реакторе идеального смешения
Вариант 21
Работу выполнила
Студентка группы ХБМО-02-20
Иванова Елена Анатольевна
Руководитель работы
Кацман Евгений Александрович
Москва, 2020
Цель и задача работы
Заданная реакция протекает в реакторе идеального смешения, который работает в стационарном изотермическом режиме. Известна схема реакции и кинетические характеристики каждой стадии: порядок реакции (первый), энергия активации и предэкспоненциальный множитель уравнения Аррениуса.
На процесс влияют два параметра: время пребывания t и температура T. Для характеристики качества работы реактора можно использовать концентрации продуктов. Интервал варьирования параметров задан в каждом варианте расчёта.
Необходимо исследовать работу реактора в заданных пределах изменения времени пребывания и температуры, с тем, чтобы найти область наиболее эффективной его работы.
Теоретическая часть
Схема реакции:



Параметры уравнения Аррениуса:
№ стадии |
Ea |
k0 |
1 |
68124 |
7,29E+09 |
2 |
78350 |
2,35E+10 |
3 |
86747 |
5,34E+11 |
Исходная область исследования:
По температуре: 323-373 К
По времени: 10-50 с
Начальная концентрация реагента на входе в реактор 1,2 моль/л.
Математическое описание состоит из матрицы стехиометрических коэффициентов реакции, кинетических уравнений и уравнений материального баланса. Матрица стехиометрических коэффициентов записывается в следующем виде:

Экспериментальная часть
Для изучения влияния времени пребывания и температуры расчёты проводятся при пяти значениях одного параметра. Это значит, что для значения одного параметра (например, температуры) расчёт производится для пяти значений другого параметра (времени пребывания), которые выбираются следующим образом: имея начальную и конечную точки интервала определяют среднее между ними, что даёт два интервала. Проделав аналогичную операцию с этими двумя интервалами получают пять точек.
Таким же образом выбираются рабочие точки для второго параметра. В результате получаем 25 точек, соответствующих плану полного факторного эксперимента. Исходные данные и результаты расчёта представлены в таблице 1.
Зависимости степени превращения, выхода и селективности от времени и от температуры представлены в таблицах 2-4 и на графиках 1-6. На каждом графике рисуется зависимость одной характеристики от одного фактора (времени или температуры), при нескольких постоянных значениях другого фактора. На графике получается пять кривых. Всего в работе получается шесть графиков: три зависимости каждой реакции от времени и три – от температуры. Чтобы увидеть одновременное влияние двух параметров (температуры и времени), на графиках 7-13 представлены трехмерные графики (где по двум осям в горизонтальной плоскости отложены температура и время, а по вертикальной оси – рассматриваемая характеристика) и соответствующие им контурные графики.
Таблица 1. Исходные и полученные в ходе работы данные.
№ |
t, с |
T, K |
k1 |
k2 |
k3 |
c1 |
c2 |
c3 |
c4 |
P |
R |
S |
1 |
10 |
323 |
7,01E-02 |
5,01E-03 |
5,00E-03 |
0,666 |
0,445 |
0,022 |
0,033 |
0,445 |
0,371 |
0,833 |
2 |
20 |
323 |
0,461 |
0,588 |
0,059 |
0,046 |
0,616 |
0,49 |
0,795 |
|||
3 |
30 |
323 |
0,353 |
0,645 |
0,097 |
0,053 |
0,706 |
0,537 |
0,761 |
|||
4 |
40 |
323 |
0,286 |
0,667 |
0,134 |
0,057 |
0,762 |
0,556 |
0,729 |
|||
5 |
50 |
323 |
0,24 |
0,672 |
0,168 |
0,06 |
0,8 |
0,56 |
0,7 |
|||
6 |
10 |
333 |
1,50E-01 |
1,20E-02 |
1,32E-02 |
0,434 |
0,582 |
0,07 |
0,057 |
0,638 |
0,485 |
0,759 |
7 |
20 |
333 |
0,265 |
0,641 |
0,154 |
0,07 |
0,779 |
0,534 |
0,686 |
|||
8 |
30 |
333 |
0,191 |
0,631 |
0,228 |
0,075 |
0,841 |
0,526 |
0,625 |
|||
9 |
40 |
333 |
0,149 |
0,603 |
0,291 |
0,078 |
0,876 |
0,503 |
0,574 |
|||
10 |
50 |
333 |
0,122 |
0,572 |
0,345 |
0,08 |
0,898 |
0,477 |
0,531 |
|||
11 |
10 |
343 |
3,08E-01 |
2,75E-02 |
3,29E-02 |
0,254 |
0,612 |
0,168 |
0,083 |
0,789 |
0,51 |
0,646 |
12 |
20 |
343 |
0,142 |
0,563 |
0,309 |
0,093 |
0,883 |
0,469 |
0,532 |
|||
13 |
30 |
343 |
0,098 |
0,498 |
0,41 |
0,097 |
0,918 |
0,415 |
0,452 |
|||
14 |
40 |
343 |
0,075 |
0,442 |
0,485 |
0,099 |
0,937 |
0,368 |
0,393 |
|||
15 |
50 |
343 |
0,061 |
0,395 |
0,543 |
0,1 |
0,949 |
0,329 |
0,347 |
|||
16 |
10 |
363 |
1,15E+00 |
1,25E-01 |
1,76E-01 |
0,075 |
0,383 |
0,478 |
0,132 |
0,937 |
0,319 |
0,341 |
17 |
20 |
363 |
0,039 |
0,254 |
0,635 |
0,136 |
0,968 |
0,212 |
0,219 |
|||
18 |
30 |
363 |
0,026 |
0,189 |
0,706 |
0,138 |
0,978 |
0,158 |
0,161 |
|||
19 |
40 |
363 |
0,02 |
0,151 |
0,753 |
0,138 |
0,984 |
0,126 |
0,128 |
|||
20 |
50 |
363 |
0,016 |
0,125 |
0,781 |
0,139 |
0,987 |
0,104 |
0,106 |
|||
21 |
10 |
373 |
2,10E+00 |
2,50E-01 |
3,79E-01 |
0,041 |
0,243 |
0,609 |
0,154 |
0,966 |
0,203 |
0,21 |
22 |
20 |
373 |
0,021 |
0,144 |
0,722 |
0,156 |
0,983 |
0,12 |
0,122 |
|||
23 |
30 |
373 |
0,014 |
0,102 |
0,769 |
0,157 |
0,988 |
0,085 |
0,086 |
|||
24 |
40 |
373 |
0,01 |
0,079 |
0,795 |
0,158 |
0,991 |
0,066 |
0,067 |
|||
25 |
50 |
373 |
0,008 |
0,065 |
0,811 |
0,158 |
0,993 |
0,054 |
0,054 |
Таблица 2. Зависимость степени превращения реагента от температуры и времени пребывания в реакторе
Конверсия P |
|||||
Т\t |
10 |
20 |
30 |
40 |
50 |
323 |
0,445 |
0,616 |
0,706 |
0,762 |
0,8 |
333 |
0,638 |
0,779 |
0,841 |
0,876 |
0,898 |
343 |
0,789 |
0,883 |
0,918 |
0,937 |
0,949 |
363 |
0,937 |
0,968 |
0,978 |
0,984 |
0,987 |
373 |
0,966 |
0,983 |
0,988 |
0,991 |
0,993 |
Таблица 3. Зависимость выхода целевого продукта от температуры и времени пребывания в реакторе
Выход R |
|||||
Т\t |
10 |
20 |
30 |
40 |
50 |
323 |
0,371 |
0,49 |
0,537 |
0,556 |
0,56 |
333 |
0,485 |
0,534 |
0,526 |
0,503 |
0,477 |
343 |
0,51 |
0,469 |
0,415 |
0,368 |
0,329 |
363 |
0,319 |
0,212 |
0,158 |
0,126 |
0,104 |
373 |
0,203 |
0,12 |
0,085 |
0,066 |
0,054 |
Таблица 4. Зависимость селективности от температуры и времени пребывания в реакторе
Селективность S |
|||||
Т\t |
10 |
20 |
30 |
40 |
50 |
323 |
0,833 |
0,795 |
0,761 |
0,729 |
0,7 |
333 |
0,759 |
0,686 |
0,625 |
0,574 |
0,531 |
343 |
0,646 |
0,532 |
0,452 |
0,393 |
0,347 |
363 |
0,341 |
0,219 |
0,161 |
0,128 |
0,106 |
373 |
0,21 |
0,122 |
0,086 |
0,067 |
0,054 |

График 1. Зависимость степени превращения реагента от времени пребывания в реакторе

График 2. Зависимость степени превращения реагента от температуры
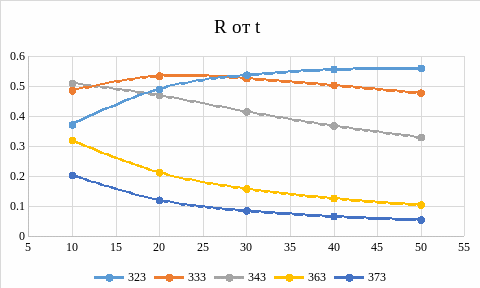
График 3. Зависимость выхода от времени пребывания в реакторе

График 4. Зависимость выхода от температуры

График 5. Зависимость селективности от времени пребывания в реакторе

График 6. Зависимость селективности от температуры


Графики 7,8. Трехмерный график зависимости селективности от температуры и времени и соответствующий ему контурный график.


Графики 9,10. Трехмерный график зависимости степени превращения от температуры и времени и соответствующий ему контурный график.


Графики 11,12. Трехмерный график зависимости выхода от температуры и времени и соответствующий ему контурный график.
Обсуждение результатов
Теоретическая часть
Степень превращения реагента характеризует глубину превращения исходного реагента, выход - количество образовавшегося продукта, селективность – то, насколько целесообразно использована та часть реагента, которая превратилась в продукты (какая часть превратившегося реагента превратилась именно в нужный продукт).
Для сравнения теоретических и опытных закономерностей, оценим предельные значения концентраций, степени превращения, выхода и селективности при предельных значениях времени. При t → 0 продукты всех реакций будут отсутствовать, их концентрация будет равна 0. При бесконечно большом времени все реакции пройдут до конца, в системе не останется исходных веществ каждой реакции. В соответствии со стехиометрией, концентрация вещества А4 станет равной 0,5 моль/л.
|
C А1 |
С А2 |
С А3 |
С А4 |
t → 0 |
1 |
0 |
0 |
0 |
t → ∞ |
0 |
0 |
0 |
0,5 |
При t → 0 степень превращения будет также стремиться к 0, так как количество прореагировавшего реагента будет бесконечно малым. При t → ∞ степень превращения будет стремиться к 1, так как прореагирует весь реагент. Выход будет стремиться к нулю, как при бесконечно большом (так как всё целевое вещество прореагирует во второй реакции), так и при бесконечно малом времени реакции (так как целевое вещество еще не образовалось). Селективность будет стремиться к 1 при бесконечно малом времени, так как скорость первой реакции будет максимальна (из-за максимальной концентрации С А1), а скорость второй и третьей реакции будет бесконечно малой (вначале процесс идёт так, как будто в системе нет побочных реакций). При бесконечно большом времени селективность стремится к 0.
|
P |
R |
S |
t → 0 |
0 |
0 |
1 |
t → ∞ |
1 |
0 |
0 |
Анализ закономерностей
При повышении температуры возрастают скорости всех реакций, увеличивается расход продукта, поэтому кривая Р = f(Т) с ростом температуры будет идти круче и быстрее приближаться к пределу. На графике P=f(t) видно, что кривые становятся круче с ростом температуры. График P=f(Т) показывает, что скорость реакции (а, следовательно, и степень превращения) растут с ростом температуры и времени пребывания. Расстояния между линиями на этом графике уменьшаются с увеличением времени пребывания. Это объясняется тем, что с ростом времени пребывания, концентрация реагента становится всё меньше.
Падение селективности обуславливает скорость реакции (2), которая в заметной степени возрастает с ростом температуры. Кривые падения селективности идут круче с ростом температуры. Полученный в данной работе график подтверждает эту закономерность. На графике зависимости селективности от времени видно, что с увеличением времени пребывания селективность асимптотически приближается к 0.
Рассмотрим зависимости выхода от времени пребывания и от температуры. Эти зависимости имеют точки максимума. Выход целевого продукта определяется конкуренцией реакций (1) и (2). Для качественной оценки влияния температуры на время достижения максимума достаточно учесть, что реакции ускоряются с ростом температуры. А для оценки высоты максимума, необходимо принять во внимание, какая реакция ускоряется сильнее. Для этого нужно сравнить значения энергии активации реакций (1) и (2). Чем больше энергия активации, тем сильнее скорость реакции зависит от температуры. В данном случае энергия активации реакции (2) больше, следовательно, она ускоряется сильнее с ростом температуры. Из всего этого можно сделать вывод, что рост температуры вызывает снижение максимального значения R. Максимумы сдвинуты относительно оси времени из-за падения скорости реакции с падением температуры. На графиках, полученных в ходе работы подтверждается эта закономерность. На графике зависимости выхода от температуры, кривой, соответствующей минимальной температуре соответствует максимальный выход. График зависимости выхода от температуры показывает падение выхода с ростом температуры. Максимальное значение выхода наблюдается при средней температуре и при среднем значении времени пребывания.
