
- •Глава 1 Элементы кинематики
- •§ 1. Модели в механика. Система отсчета. Траектория, длина пути, вектор перемещения
- •§ 2. Скорость
- •§ 3. Ускорение и его составляющие
- •2) Прямолинейное равнопеременное движение. При таком виде движения
- •§ 4. Угловая скорость и угловое ускорение
- •Глава 2
- •§ 5. Первый закон Ньютона. Масса. Сила
- •§ 7. Третий закон Ньютона
- •§ 8. Силы трения
- •§ 9. Зеком сохранения импульса. Центр масс
- •§ 10. Уравнение движения тала переменной массы
- •Глава 3 Работа и энергия
- •§ 11. Энергия, работа, мощность
- •§ 12. Кинетическая и потенциальная энергии
- •§ 13. Закон сохранения энергии
- •§ 14. Графическое представление энергии
- •§ 15. Удар абсолютно упругих и неупругих тал
- •Г лава 4 Механика твердого тела
- •§ 16. Момент инерции
- •§ 17. Кинетическая энергия вращения
- •§ 18. Момент силы. Уравнение динамики вращательного движения твердого тела
- •§ 19. Момент импульса и закон его сохранения
- •§ 20. Свободные оси. Гироскоп
- •§ 21. Деформации твердого тела
- •Глава 5 Тяготение. Элементы теории поля
- •§ 22. Законы Кеплера. Закон всемирного тяготения
- •Каждая планета движется по эллипсу, в одном из фокусов которого находится Солнце.
- •Радиус-вектор планеты за равные промежутки времени описывает одинаковые площади.
- •Квадраты периодов обращения планет вокруг Солнца относятся как кубы боль ших полуосей их орбит.
- •§ 23. Сила тяжести и вес. Невесомость
- •§ 24. Поле тяготения и его напряженность
- •§ 25. Работа в поле тяготения. Потенциал поля тяготения
- •§ 26. Космические скорости
- •§ 27. Неинерционные системы отсчета. Силы инерции
- •1. Силы инерции при ускоренном поступательном движении системы отсчет». Пусть на тележке к штативу на нити подвешен шарик массой т (рис. 40). Пока тележка покоится или движется
- •2. Силы вверим, действующие на тело, покоящееся во вращающейся системе отсчета. Пусть диск равномерно вращается с угловой скоростью вокруг вертикальной оси, проходящей через
- •Глава 6 Элементы механики жидкостей
- •§ 28. Давление в жидкости и газа
- •§ 29. Уравнение неразрывности
- •§ 30. Уравнение Бернулли и следствия из него
- •§ 31. Вязкость (внутреннее трение). Ламинарный и турбулентный режимы течения жидкостей
- •§ 32. Методы определения вязкости
- •§ 33. Движение тел в жидкостях и газах
- •5.3. Сопло фонтана, дающего вертикальную струю высотой имеет форму усеченного
- •5.5. В широком сосуде, наполненном глицерином (плотность падает с устано-
- •Глава 7
- •§ 34. Преобразования Галилея. Механический принцип относительности
- •§ 35. Постулаты специальной (частной) теории относительности
- •§ 38. Преобразования Лоренца
- •§ 37. Следствия из преобразований Лоренца
- •1. Одновременность событий в разных системах отсчета. Пусть в системе к в точках с координатами в моменты времени происходят два события. В системе
- •§ 38. Интервал между событиями
- •§ 39. Основной закон релятивистской динамики материальной точки
- •§ 40. Закон взаимосвязи массы и энергии
- •Г лава 8
- •§ 41. Статистический и термодинамический методы. Опытные законы идеального газа
- •Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
- •Между молекулами газа отсутствуют силы взаимодействия;
- •Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
- •2) Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
- •§ 42. Уравнение Клапейрона — Менделеева
- •§ 43. Основное уравнение молекулярно-кинетической теории идеальных газов
- •§ 44. Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
- •2) Средняя 3) средняя квадратичная
- •§ 45. Барометрическая формула. Распределение Больцмана
- •§ 46. Среднее число столкновений и средняя длина свободного пробега молекул
- •§ 47. Опытное обоснование молокулярно-кинггичоской теории
- •§ 48. Явления переноса в термодинамически неравновесных системах
- •§ 48. Вакуум и методы его получения. Свойства ультраразреженных газов
- •Глава 9 Основы термодинамики
- •§ 51. Первое начало термодинамики
- •§ 52. Работа газа при изменении его объема
- •§ 53. Теплоемкость
- •§ 54. Применение первого начала термодинамики к изопроцессам
- •§ 55. Адиабатический процесс. Политропный процесс
- •§ 56. Круговой процес (цикл). Обратимый и необратимый процессы
- •§ 57. Энтропия, её статистическое толкование и связь с термодинамической вероятностью
- •§ 58. Второе начало термодинамики
- •2)ПоКлаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
- •§ 59. Тепловые двигатели и холодильные машины. Цикл Карно и его к. П. Д. Для идеального газа
- •Глава 10 Реальные газы, жидкости и твердые тела
- •§ 60. Силы и потенциальная энергия межмолекулярного взаимодействия
- •§ 61. Уравнение Ван-дер-Ваальса
- •§ 62. Изотермы Ван-дер-Ваальса и их анализ
- •§ 63. Внутренняя энергия реального газа
- •§ 64. Эффект Джоуля — Томсона
- •§ 65. Сжижение газов
- •§ 66. Свойства жидкостей. Поверхностное натяжение
- •§ 67. Смачивание
- •§ 68. Давление под искривленной поверхностью жидкости
- •§69. Капиллярные явления
- •§ 70. Твердыt тала. Моно- и поликристаллы
- •§ 71. Типы кристаллических твердых тел
- •§ 72. Дефекты в кристаллах
- •§ 73. Теплоемкость твердых тел
- •1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
- •§ 74. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •§75. Фазовые переходы I и п рода
- •§ 76. Диаграмма состояния. Тройная точка
§ 54. Применение первого начала термодинамики к изопроцессам
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются иэопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорвый процесс (V= const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорнос нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
![]()
Как
уже указывалось в § S3, из первого начала
термодинамики![]() для
для
изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
![]()
Согласно формуле (53.4),
![]()
Тогда для произвольной массы газа получим
![]() (54.1)
(54.1)
Изобарный процесс (р=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа


(см.
(52.2)) при увеличении объема от![]() до
до![]() равна
равна
![]() (542)
(542)
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение (42.5) Клапейрона — Менделеева для выбранных нами двух состояний, то
![]()
откуда
![]()
Тогда выражение (54.2) для работы изобарного расширения примет вид
![]() (54.3)
(54.3)
Из
этого выражения вытекает физический
смысл молярной газовой постоянной R:
если
![]() то
для 1 моль газа R=A,
т.
е. R
численно
равна работе изобарного расширения
1 моль идеального газа при нагревании
его на 1 К.
то
для 1 моль газа R=A,
т.
е. R
численно
равна работе изобарного расширения
1 моль идеального газа при нагревании
его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты
![]()
его внутренняя энергия возрастает на величину (согласно формуле (53.4))
![]()
При этом газ совершит работу, определяемую выражением (54.3). Изотермшческий процесс (Т= const). Как уже указывалось § 41, изотермический процесс описывается законом Бойля—Мариотта:
р V= const.


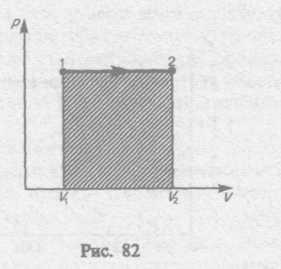
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу (см. рис. 60), расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из выражений (52.2) и (42.5) найдем работу изотермического расширения газа:

Так как при Т=const внутренняя энергия идеального газа не изменяется:
![]()
то
из первого начала термодинамики![]() следует,
что для изотермического
следует,
что для изотермического
процесса
![]()
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
![]() (54.4)
(54.4)
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
§ 55. Адиабатический процесс. Политропный процесс
Адиабатическим
называется процесс, при котором
отсутствует теплообмен![]() между
системой и окружающей средой. К
адиабатическим процессам можно отнести
все
быстропротекающие процессы. Например,
адиабатическим процессом можно считать
процесс распространения звука в среде,
так как скорость распространения
звуковой
волны настолько велика, что обмен
энергией между волной и средой произойти
не
между
системой и окружающей средой. К
адиабатическим процессам можно отнести
все
быстропротекающие процессы. Например,
адиабатическим процессом можно считать
процесс распространения звука в среде,
так как скорость распространения
звуковой
волны настолько велика, что обмен
энергией между волной и средой произойти
не

успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д. Из первого начала термодинамики для адиабатического процесса
следует,
что![]()
![]() (55.1)
(55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
![]() (552)
Продифференцировав
уравнение состояния для идеального
газа
(552)
Продифференцировав
уравнение состояния для идеального
газа![]() получим
получим
![]() (55.3)
Исключим
из (55.2) и (55.3) температуру Т.
(55.3)
Исключим
из (55.2) и (55.3) температуру Т.
![]()
Разделив
переменные и учитывая, что![]() (см.
(53.8)), найдем
(см.
(53.8)), найдем
![]()
Интегрируя
это уравнение в пределах от р1
до
р2
и
соответственно от![]() а
затем
а
затем
потенцируя, придем к выражению
![]()
Так как состояния 1 и 2 выбраны произвольно, то можно записать
![]() (55.4)
(55.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V нля р, T исключим из (55.4) с помощью уравнения Клапейрона — Менделеева
![]()
соответственно давление или объем:
![]() (55.5)
(55.5)
![]() (55.6)
(55.6)
Выражения (55.4) — (55.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина (см. (53.8) и (53.2))
![]() (55.7)
(55.7)
называется
показателем адиабаты (или коэффициентом
Пуассона). Для одноатомных газов
(Ne,
Не и др.), достаточно хорошо удовлетворяющих
условию идеальности,![]()
![]() Для
двухатомных газов
Для
двухатомных газов![]() Значения
Значения![]() вычисленные
вычисленные
по формуле (55.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается
гиперболой (рис. 83). На рисунке видно, что адиабата (pV=const) более крута, чем изотерма (pV= const). Это объясняется тем, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем уравнение (SS.1) в виде
![]()
Если
газ адиабатически расширяется от
объема![]() то
его температура уменьша-
то
его температура уменьша-
ется
от![]() и
работа расширения идеального газа
и
работа расширения идеального газа
![]() (55.8)
(55.8)
Применяя те же приемы, что и при выводе формулы (55.5), выражение (55.8) для работы при адиабатическом расширении можно преобразовать к виду
![]()
где![]()
Работа, совершаемая газом при адиабатическом расширении 1—2 (определяется площадью, заштрихованной на рис. 83), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные
изохорный, изобарный, изотермический
и адиабатический процессы имеют
общую особенность — они происходят
при постоянной теплоемкости. В первых
двух
процессах теплоемкости соответственно
равны
![]() в изотермическом
в изотермическом
процессе![]() теплоемкость
равнав
теплоемкость
равнав
![]() адиабатическом
теплоемкость
адиабатическом
теплоемкость![]()
равна нулю. Процесс, в котором теплоемкость остается постоянной, называется полтрошым.-


Исходя из первого начала термодинамики при условии постоянства теплоемкости (С=const) можно вывести уравнение политропы:
pV" = const, (55.9)
где п=(С—Сp)/(С—Сv) — показатель политропы. Очевидно, что при С=0, п = у, из (55.9) получается уравнение адиабаты; при С=ао, n=1 —уравнение изотермы; при С=СР, n=0 — уравнение изобары, при С=Сv, п= ±оо — уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
