
- •ВВЕДЕНИЕ
- •1. ЭКСТРАКЦИЯ
- •Лабораторная работа № 1
- •2. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
- •Лабораторная работа №2
- •3. ОБНАРУЖЕНИЕ КАТИОНОВ
- •Лабораторная работа №3
- •Лабораторная работа № 4
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7
- •Лабораторная работа № 8
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Лабораторная работа № 12
- •Лабораторная работа № 13
- •Лабораторная работа № 14
- •Лабораторная работа № 15
- •Лабораторная работа № 16
- •Список литературы, рекомендуемый к изучению
Лабораторная работа № 6
Определение соляной и борной кислот при совместном присутствии с двумя индикаторами
Цель работы: определить соляную и борную кислоты при совместном присутствии с двумя индикаторами.
При титровании смеси сильной и слабой кислот встречаются два случая [3]: 1) константа кислотности слабой кислоты очень мала (< 10- 7); 2) константа кислотности слабой кислоты близка к 10-5. В последнем случае ионизация слабой кислоты начинается задолго до точки эквивалентности, соответствующей оттитровыванию сильной кислоты. Оттитровать раздельно такие кислотьг в водвом растворе невозможно. Напротив, когда титруют смесь сильной и слабой кислот с Ка около 10-7, то до начала титрования концентрация ионов водорода будет практически равна концентрации сильной кислоты, так как в ее присутствии ионизация слабой кислоты будет практически полностью подавлена. Поэтому вначале будет оттитрована практически вся сильная кислота, а затем будет оттитровываться и слабая кислота. Борная кислота является очень слабой кислотой (Ка=6,4 10-10), непосредственно ее оттитровать нельзя. Но если в раствор добавить некоторые органические вещества (маннит, глицерин и т.п.), то они образуют с борной кислотой более сильные комплексные кислоты, которые уже можно титровать с таким индикатором, как фенолфталеин.
Реагенты.
Гидроксид натрия, NаОН, 0,1000 М стандартный раствор. Глицерин (предварительно нейтрализованный по фенолфталеину).
Индикаторы: метиловый оранжевый, 0,1%-ный водный раствор; фенолфталеин, 0,1%-ный раствор в 60%-ном этаноле.
Выполнение определения. В бюретку наливают стандартный раствор гидроксида натрия и закрывают бюретку трубкой с натронной известью. Раствор, содержащий соляную и борную кислоты, помещают в мерную колбу вместимостью 50,0 мл, разбавляют водой до метки и хорошо перемешивают. Затем пипеткой отбирают 10,00 мл этого раствора, переносят в коническую колбу вместимостью 100 мл, добавляют 1 каплю раствора метилового оранжевого и титруют раствором
гидроксида натрия до изменения окраски раствора из красной в чистожелтую. Отмечают объем раствора гидроксида натрия, пошедяшй на титрование соляной кислоты. Затем в титруемый раствор добавляют 10 мл глицерина, хорошо перемешивают, добавляют 6…7 капель раствора фенолфталеина и продолжают титрование раствором гидроксида натрия до изменения окраски из желтой в оранжевокрасную. Добавляют еще 5 мл глицерина и, если оранжево-красная окраска исчезла, продолжают титрование раствором гидроксида натрия до появления оранжево-красной окраски. Объем раствора гидроксида натрия, пошедшего на титрование в присутствии фенолфталеина, соответствует содержанию борной кислоты в аликвотной порции задачи.
Вопросы и задания для защиты лабораторной работы «Определение соляной и борной кислот при совместном присутствии»
1.Что называют количественным анализом? Его задачи и роль в контроле качества окружающей среды.
2.В чем сущность объемного анализа? Какие требования предъявляют к реакциям в титриметрии?
3.В чем суть методов прямого, обратного и заместительного титрования? Условия применения каждого из этих методов.
4.Расскажите, как проводят определение по методу пипетирования
ипо методу отдельных навесок. Укажите достоинства и недостатки каждого метода.
5.Что такое стандартные растворы? Как их готовят и для чего?
6.В чем суть протолитической теории Бренстеда – Лоури?
7.На какие группы делят растворители согласно протолитической теории? В чем суть дифференцирующего и нивелирующего эффекта растворителей? Как это используют в аналитической химии?

Лабораторная работа № 7
Определение карбонат- и гидрокарбонат-ионов или карбонат-ионов и щелочи при совместном присутствии
Цель работы: научиться определять при совместном присутствии карбонат- и гидрокарбонат-ионы или карбонат-ионы и щелочь.
Карбонат-ион является двухосновным основанием с константами основности, равными Кb,1 = 2,1 10-4 и Кb,2 = 2,2 10-8. Поскольку отношение Кb,1 : Кb,2=104, то на кривой титрования карбонат-ионов кислотой наблюдаются два отчетливых скачка титрования: первая точка эквивалентности (рН 8,34) ‒ карбонат-ионы переходят в гидрокарбонатионы; вторая точка эквивалентности (рН 4,25) ‒ гидрокарбонат-ионы переходят в угольную кислоту [3].
Если титроватъ смесь ионов СО32- и НСО3- раствором НСl с фенолфталеином (рT = 9,0) до обесцвечивания (V1), то ион СО32- будет оттитрован до НСО3- [fэкз(СО32-) = 1]. Тогда
В оттитрованный по фенолфталеину раствор добавляют метиловый оранжевый (рТ = 4,0) и продолжают титровать кислотой (V2) до изменения окраски раствора из желтой в оранжевую. В этом случае оттитровывают все ионы НСО3-, присутствующие изначально в смеси и образовавшиеся из СО32-. Тогда
Можно титровать отдельные аликвоты, применяя соответственно индикаторы: фенолфталеин (V1)и метиловый оранжевый (V3). Тогда
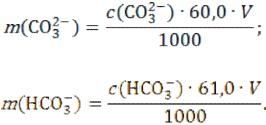
Аналогично можно оттитровать и смесь NаОН и Nа2СО3. По фенолфталеину (V1) оттитровывают всю щелочь и Nа2СО3 до NаНСО3, а по метиловому оранжевому (V2) ‒ NаНСО3 до угольной кислоты. Тогда объем раствора НСl, пошедший на титрование Nа2СО3, будет равен 2V2, а пошедший на титрование NаОН равен V1-V2.
Реагенты.
Соляная кислота, НСl, 0,1000 М стандартный раствор. Индикаторы: метиловый оранжевый, 0,1%-ный водный раствор;
фенолфталеин, 0,1%-ный раствор в 60%-ном этаноле.
Выполнение определения.
1.Определение карбонат-ионов. Раствор смеси СО32- и НСО3- в
мерной колбе вместимостью 50,0 мл разбавляют водой до метки и хорошо перемешивают. Пипеткой отбирают 10,00 мл раствора в коническую колбу для титрования вместимостью 200…250 мл, прибавляют 20 мл воды, 5 капель фенолфталеина и титруют из бюретки раствором НСl до обесцвечивания от одной капли титранта. Измеряют объем НСl (V1).Раствор не выливают, а поступают, как описано ниже.
2.Определение гидрокарбонат-ионов. В оттитрованный по фенолфталеину раствор вводят 2 капли метилового оранжевого и титруют раствором НСl до изменения окраски из чисто-желтой в оранжевую. Измеряют объем НСl (V2).
Содержание ионов (г) рассчитывают по формулам:
где 60,0 и 61,0 ‒ молярные массы эквивалеыта СО32- и НСО3- соответственно;
V ‒ объем мерной колбы с анализируемым раствором.
Вопросы и задания для защиты лабораторной работы «Определение карбонат- и бикарбонат-ионов при совместном присутствии»
1. От каких факторов зависит точность аналитических

определений? Какие виды ошибок Вы знаете?
2.Назовите причины, влияющие на систематическую ошибку.
3.Назовите источники возникновения случайных ошибок.
4.Что такое воспроизводимость? Как вычислить абсолютную и относительную ошибку?
5.Как вычислить среднее квадратичное отклонение? Что такое доверительный интервал и как он определяется?
6.Как вычислить рН в растворах сильных и слабых электролитов?
7.Что такое буферные растворы? Как вычислить рН буферных растворов? Что такое буферная емкость растворов и как она определяется?
6. КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Комплексонометрическое титрование основано на реакциях образования комплексов ионов металлов с аминополикарбоновыми кислотами (комплексонами). Из многочисленных аминополикарбоновых кислот наиболее часто используют этилендиаминтетрауксусную кислоту (Н4Y) [1, 2]
Вследствие низкой растворимоств в воде сама кислота не подходит для приготовления раствора титранта. Для этого обычно используют дигидрат ее двунатриевой соли Nа2Н2Y 2Н2О (ЭДТА). Эту соль можно получить добавлением к суспензии кислоты гидроксида натрия до рН ~5. В большинстве случаев для приготовления раствора ЭДТА используют коммерческий препарат, а затем раствор стандартизуют. Можно также использовать фиксанал ЭДТА.
Реакции взаимодействия различных катионов с ЭДТА в растворе можно представить уравнениями:
