
- •ВВЕДЕНИЕ
- •1. ЭКСТРАКЦИЯ
- •Лабораторная работа № 1
- •2. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
- •Лабораторная работа №2
- •3. ОБНАРУЖЕНИЕ КАТИОНОВ
- •Лабораторная работа №3
- •Лабораторная работа № 4
- •Лабораторная работа № 5
- •Лабораторная работа № 6
- •Лабораторная работа № 7
- •Лабораторная работа № 8
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Лабораторная работа № 12
- •Лабораторная работа № 13
- •Лабораторная работа № 14
- •Лабораторная работа № 15
- •Лабораторная работа № 16
- •Список литературы, рекомендуемый к изучению
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
«Сибирский государственный автомобильно-дорожный университет (СибАДИ) »
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания для лабораторных работ
Составитель С.А. Эмралиева
Омск
СибАДИ
2019
УДК 543
ББК 24.4 А64
Рецензент
канд. биол. наук, доц., О.Е.Бдюхина (ФГБОУ ВО ОмГАУ им. П.А.Столыпина)
Работа утверждена редакционно-издательским советом СибАДИ в качестве методических указаний для лабораторных работ.
А64 Аналитическая химия : методические указания для лабораторных работ / сост. С.А. Эмралиева. – Электрон. дан. – Омск : СибАДИ, 2019. – Режим доступа:……………………………………………, свободный после авторизации. − Загл. с экрана.
Предназначены для проведения лабораторных работ обучающихся по дисциплине «Аналитическая химия». Содержат теоретический материал и ход выполнения 16 лабораторных работ, вопросы для защиты лабораторных работ, список литературы, рекомендуемый к изучению.
Рекомендуется для обучающихся всех форм обучения направления подготовки бакалавриата «Техносферная безопасность».
Имеет интерактивное оглавление в виде закладок.
Работа подготовлена на кафедре «Техносферная и экологическая безопасность».
Текстовое (символьное) издание
Системные требования: Intel, 3,4 150 Мб; WindowsXP/Visa/7 DVD-ROM; 1 Гб свободного места на жестком диске; программа для чтения pdf-файлов:
Adobe Acrobat Reader; Foxit Reader
Издание первое. Дата подписания к использованию 23.01.2019 Издательско-полиграфический комплекс СибАДИ. 644080, г. Омск, пр. Мира, 5 РИО ИПК СибАДИ. 644080, г. Омск, ул. 2-я Поселковая, 1
ФГБОУ ВО «СибАДИ», 2019
ВВЕДЕНИЕ
Дисциплина «Аналитическая химия» преподается студентам направления «Техносферная безопасность» профиля «Защита окружающей среды» на лекциях, а также на лабораторных занятиях. В
методических указаниях представленные лабораторные работы, являющиеся практическим приложением теоретического материала,
изложенного в курсе лекций. По 6 темам курса (методы разделения, маскирования и концентрирования; качественный анализ; количественный анализ; оптические методы анализа; электрохимические методы анализа; хроматографические методы анализа) представлены 16 лабораторных работ:
∙разделение ионов тяжелых металлов методом экстракции;
∙тонкослойная хроматография как метод разделения веществ;
∙обнаружение катионов 1…3 и 4…6 аналитических групп по кислотно-основной классификации;
∙обнаружение анионов;
∙определение соляной и борной кислот при совместном присутствии;
∙определение карбонат- и бикарбонат-ионов при совместном присутствии;
∙комплексонометрическое определение ионов кальция и магния;
∙определение содержания алюминия методом обратного комплексонометрического титрования;
∙определение железа методом дихроматометрического титрования;
∙приготовление и стандартизация раствора тиосульфата натрия для иодометрического титрования;
∙иодометрическое определение меди;
∙определение хлорид – ионов методом осадительного титрования;
∙фотометрическое определение железа;
∙кондуктометрическое определение хлороводородной кислоты;
∙колоночная ионообменная хроматография.
При изучении аналитической химии необходимо научиться надежно и точно определять количественные характеристики реакции, ее состав. При этом у студента воспитывается уважение к точности во всем, что касается эксперимента, к тщательности и аккуратности.
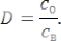
1. ЭКСТРАКЦИЯ
Экстракция — это метод разделения и концентрирования веществ, основанный на распределении вещества между двумя несмешивающимися фазами. В качестве одной из фаз обычно используют воду, в качестве второй — органический растворитель. Экстракционный метод разделения отличается универсальностью, посколысу он используется практически для всех элементов. Преимущества экстракции по сравненшо с другими методами разделения, индивидуального и грушового выделения компонентов связаны с большой скоростью достижения межфазного равновесия, быстрым отделением одной фазы от другой, а также с тем, что соэкстрация мешающих элементов мала [1, 2].
Соединение (обычно в органической фазе), ответственное за образование экстрагируемого соединения, называют экстрагентом. Инертные органические растворители, такие, как хлороформ, тетрахлорид углерода, бензол, применяемые ддя улучшения физических и экстракционных свойств экстрагента, называют разбавителями. Органическую фазу, отделенную от водной фазы и содержащую экстрагированные соединения, называют экстрактом. Перевод вещества из органической фазы в водную называют реэкстракцией, а раствор, используемый для реэкстракции, ‒ реэкстрагентом.
На практике распределение каждого вещества между двумя ограниченно смешивающимися фазами характеризуют коэффициентом распределения, который равен отношению суммарной концентрации всех форм вещества в органической фазе к суммарной концентрации всех форм вещества в водной фазе:
Значение коэффициента распределения зависит от условий экстракции. При довольно высоких значениях коэффициента распределения однократная экстракция позволяет количественно извлечь вещество в органическую фазу. Эффективность однократной экстракции характеризуется степенью извлечения ‒ R ‒ это отношение
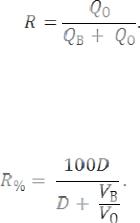
количества Q вещества в органической фазе к общему количеству вещества в системе:
Степень извлечения связана с коэффициентом распределения и объемами водной и органической фаз, выражается в процентах:
Для достижения максимальной степени экстракции число последовательных экстракций может быть не более 5…6.
Условия экстракции при разделении выбирают так, чтобы значение коэффициента разделения двух веществ А и В αА/B = DA/DB. было высоким и DADB. ≈ 1. Для улучшения разделения элементов экстракцию проводят в присутствии маскирующих веществ.
Лабораторная работа № 1
Разделение ионов тяжелых металлов методом экстракции
(смесь катионов Сu(II), Нg(II), Zn(II), Сd(II))
Цель работы: научиться разделять ионы тяжелых металлов методом экстракции.
Схема анализа катионов представлена в табл. 1 [3]. Опыт 1. Обнаружение и отделение Сu(II).
К 3…5 каплям исследуемого раствора добавляют 2…3 капли 0,2 М НNО3, 1…2 капли 1%-ного водного раствора ДЭДТК (диэтилдитиокарбаминат натрия), 5 капель СНС13. Закрывают пробирку пробкой и встряхивают 1 мин. В присутствии меди органическая фаза окрашивается в желто-коричневый цвет.
Если Сu(II) обнаружена, ее отделяют от Нg(II), Zn(II), Сd(II), поскольку она мешает обнаружению последних. Для этого к 20…30 каплям исследуемого раствора в делительной воронке добавляют 1…2 капли 2 М НNО3 до рН 1…2, 20 капель ацетилацетона.

Закрывают делительную воронку пробкой и встряхивают 1 мин. После расслаивания фазы разделяют, сливая водную фазу (нижний слой) во вторую делительную воронку ддя повторной экстракции. Добавляют к ней 10 капель ацетилацетона и встряхивают 1 мин. После расслаивания фазы разделяют. Водную фазу (нижний слой) сливают в делительную воронку. Водная фаза содержит Нg(II), Zn(II) и Сd(II). Органические фазы в первой и второй делительных воронках содержат ацетилацетонат меди и дальше не исследуются.
Таблица 1
Схема анализа катионов меди, ртути, цинка и кадмия
1. |
Обнаружение ионов Сu(II) |
|
|
2. |
Экстракция ацетилацетоном при рН 1…2 |
|
|
Органическая фаза: |
Водная фаза: ионы Нg(II), Zn(II), Сd(II) |
||
ацетилацетонат меди |
|
|
|
|
|
||
Обнаружение Сu(II) |
3. Отделение Нg(II) и экстракция раствором дитизона в ССl4 |
||
в органической фазе |
при рН 1…2 |
|
|
|
|
Органическая фаза: |
Водная фаза: ионы Zn(II), Сd(II) |
|
|
дитизонат ртути |
|
|
|
оранжевого цвета |
|
|
|
|
|
4. Разделение Zn(II) и Сd(II) экстракцией раствором дитизона в ССl4 при рН 4 в присутствии Na2S2O3
Органическая фаза: |
Водная фаза: ионы |
дитизонат цинка |
Сd(II) |
красного цвета |
Обнаружение Сd(II) |
|
|
Опыт 2. Обнаружение и отделение Нg(II).
В водном растворе после отделения Сu(II) прежде всего обнаруживают Нg(II), поскольку Hg(II) мешает обнаружению Zn и Сd. Для этого 2…3 капли водной фазы переносят в пробирку (рН 1…2), добавляют 5 капель ССl4 и каплю раствора дитизона в ССl4. Закрывают пробирку пробкой и встряхивают 2 мин. В присутствии Нg(II) органическая фаза окрашивается в оранжево-красный цвет.
Если Нg(II) присутствует, ко всей водной фазе добавляют 7…8 капель ССl4, 2…3 капли раствора дитизона в СС14. Закрывают воронку пробкой и встряхивают 2 мин. Органическая фаза в присутствии Нg(II) окрашена в оранжево-красный цвет. После расслаивания фазы разделяют, сливая органическую фазу в другую
делительную воронку, а водную фазу ‒ в колбочку.
Примечание. Чтобы подтвердить присутствие Нg(II), реэкстрагируют ее в течение 1…2 мин из органической фазы раствором: 20 капель 1 М КI и 3…4 капли 1 М Н2SО4. В реэкстракте обнаруживают ртуть реакцией с дитизоном. К 4…5 каплям реэкстракта добавляют водный раствор NН3 до рН 8, 5 капель СС14 и каплю раствора дитизона в СС14, встряхивают 1…2 мин. Оранжево-красный цвет органической фазы указывает на присутствие дитизоната ртути.
Опыт 3. Обнаружение и отделение Zn(II).
К 2…3 каплям водной фазы (см. опыт 2), содержащей Zn(II) и Сd(II), добавляют каплю раствора СН3СООNа (рН 4…5), твердый Nа2S2О3 для образования комплексного соединения Сd(II), 5 капель ССl4, каплю раствора дитизона в ССl4. Закрывают пробирку пробкой и встряхивают 1…2 мин. В присутствии цинка органическая фаза окрашивается в малиново-красный цвет. Если цинк присутствует, то ко всей водной фазе в делительной воронке добавляют раствор СН3СООNа до рН 4…5, твердый Nа2S2О3 (1/2 шпателя), 7…8 капель ССl4, 3…5 капель дитизона в ССl4. Закрывают воронку пробкой и встряхивают 3 мин. После расслаивания фазы разделяют. Органическая фаза содержит дитизонат цинка. Водная фаза ‒ комплексные соединения Сd(II) с S2О32-.
Опыт 4. Обнаружение Сd(II).
1)3…5 капель водной фазы (см. опыт 3) переносят в пробирку, добавляют каплю 2 М НСl, 2 М NН3 до рН 3, 5 капель ССl4, каплю дитизона в ССl4. Закрывают пробирку пробкой и энергично встряхивают 1…2 мин. В присутствии кадмия органическая фаза окрашивается в красный цвет. Полученную окраску сравнивают с контрольным опытом, который готовят следующим образом: к нескольким каплям воды добавляют 2 М НСl, каплю раствора СН3СООNа до рН 5, твердый Nа2S2О3, раствор NН3 до рН 8, 5 капель ССl4, каплю раствора дитизона в СС14. Закрывают пробирку пробкой и встряхивают в течение 1…2 мин.
2)3…5 капель водной фазы переносят в пробирку, добавляют 2 М NН3 до рН 8…10 и 2…3 капли 0,01%-ного этанольного раствора реагента на кадмий (тозилхинолин). В присутствии Сd(II) наблюдают желто-зеленую флуоресценцию в ультрафиолетовом свете.
