
1547
.pdfгде знак минус означает, что электрон находится в связанном состоянии. Из формулы следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения п. Целое число п в выражении (1), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с п = 1 является основным (нормальным) состоянием; состояния с п > 1
являются возбужденными.
Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Придавая п различные целочисленные значения, получим для атома водорода (Z = 1), согласно формуле (1), возможные уровни энергии, схематически представленные на рис.1. Энергия атома водорода с увеличением п возрастает, и энергетические уровни сближаются к границе, соответствующей значению п = ∞. Атом водорода обладает, таким образом, минимальной энергией (E0 = -13,55 эВ) при п = 1 и максимальной (Е = 0) при п = ∞. Согласно второму постулату Бора, при переходе атома водорода (Z = 1) из стационарного состояния п в стационарное состояние т с меньшей
hv En Em |
|
me4 |
|
1 |
1 |
|
|||||
|
|
|
|
( |
|
|
|
|
), |
||
8h |
2 0 |
2 |
n |
2 |
m2 |
||||||
откуда частота излучения |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
v |
me4 |
( |
1 |
|
1 |
) R( |
1 |
|
1 |
), |
|||||
|
|
|
2 |
|
2 |
|
2 |
|
2 |
|
2 |
||||||
|
|
3 |
|
m |
|
n |
|
m |
|
n |
|
||||||
|
me4 |
|
8h |
0 |
|
|
|
|
|
|
|
|
|
||||
где R |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8h3 02 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода. Это совпадение убедительно доказывает правильность полученной Бором формулы для энергетических уровней водородоподобной системы. Подставляя, например, в формулу т = 1 и п = 2, 3, 4, ... , получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных уровней (п = 2, 3, 4, ...) на основной
(т = 1).
60

Аналогично, при подстановке т = 2,3,4,5,6 и соответствующих им значений п получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 1). Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
Задание к лабораторной работе
Упражнение 1. Определение зависимости радиуса орбиты, скорости и энергии электрона на орбите от номера орбиты
1. Задавая различные номера орбит, определите с помощью программы значения радиуса орбиты, скорости и энергии электрона для атома водорода и одного из ионизированных атомов (рис.2). Занесите данные в табл. 1 и 2.
Рис.2. Рабочее окно программы
2.Постройте графики зависимостей r,υ и Е от номера уровней.
3.Сделайте выводы:
а) Как зависят эти величины от номера уровня? В каких координатах «спрямляются» эти зависимости?
61

б) Как влияет заряд ядра на величину и поведение этих характеристик электрона?
|
|
Результаты измерений |
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
Атом водорода |
|
n |
r, м |
υ, м/с |
E, эВ |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
|
|
Результаты измерений |
Таблица 2 |
|
|
|
|
|
|
|
|
|
|
Ион Z = |
|
n |
r, м |
υ, м/с |
E, эВ |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
Упражнение 2. Изучение спектра одноэлектронных атомов. Определение постоянной Ридберга
1. Определите с помощью программы длины волн фотонов, которые испускаются атомом при переходе электрона с вышележащих орбит на п–ю. Занесите данные в табл. 3 и 4.
Таблица 3
Результаты измерений
Атом водорода H
n |
λ 1 |
λ 2 |
λ 3 |
λ 4 |
1
2
3
4
62

Таблица 4
Результаты измерений
Атом водорода He+
n |
λ 1 |
λ 2 |
λ 3 |
λ 4 |
1
2
3
4
Таблица 5
Результаты измерений
Атом водорода Li++
n |
λ 1 |
λ 2 |
λ 3 |
λ 4 |
1
2
3
4
2.Зарисуйте схематично спектр атома водорода, а также ионизированных атомов гелия и лития.
3.Из табл. 3–5 выберите несколько спектральных линий. Используя формулу
|
|
R |
|
|
1 |
|
|
|
|
, |
|
||
|
|
Z |
2 |
1 |
1 |
|
|
||||||
|
|
|
|
|
( |
|
|
|
) |
|
|
||
|
|
|
n2 |
m2 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
определите постоянную Ридберга. Заполните табл. 6. |
|
||||||||||||
|
|
Результаты измерений |
Таблица 6 |
||||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
Z |
n |
|
m |
|
|
|
|
R', м-1 |
R'ср, м-1 |
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Сделайте вывод о зависимости вида спектра от заряда ядра. Найдите по табл. 3–5 участки видимого спектра для каждого атома. Сравните вычисленное значение постоянной Ридберга с табличным.
63
ЛАБОРАТОРНАЯ РАБОТА № 8
Радиоактивность
Цели работы: изучить закон радиоактивного распада, определить период полураспада элемента с помощью моделирующей программы. Исследовать радиоактивное семейство 238U.
Основы теории
Явление радиоактивности было обнаружено Беккерелем в 1896 г. Оно заключается в том, что ядра некоторых изотопов способны самопроизвольно, без всякого внешнего воздействия, распадаться, испуская лучи, способные проходить сквозь непрозрачные для видимого света вещества. Исследованиями Пьера и Марии Кюри, Содди и др. было установлено, что не только уран и его изотопы, но и изотопы всех элементов, расположенных в таблице Менделеева за висмутом (Z = 83), радиоактивны.
Радиоактивное излучение бывает трех типов: α - лучи, β - лучи и
γ- лучи.
а- лучи представляют поток ядер гелиевых атомов с зарядовым числом Z = 2 и массовым числом А = 4. α - излучению соответствует α - распад, в ходе которого из ядра вырывается α - частица, в результате чего материнское ядро превращается в дочернее. Последнее имеет зарядовое число на 2, а массовое на 4 единицы меньше материнского. Зная это правило смещения для а - распада,
легко записать уравнение распада любого изотопа:
AX A 4Y 4He |
(1) |
Z Z 2 2 |
|
β - лучи оказались потоком отрицательно заряженных частиц – электронов, имеющих высокую энергию; β - излучение соответствует β - распаду, в котором материнское ядро превращается в дочернее без изменения массового числа, но с увеличением зарядового числа на единицу. Это правило смещения β - распада позволяет записать уравнение распада любого изотопа:
AX |
AY 0e |
(2) |
|
Z |
Z 1 |
1 |
|
Впоследствии оказалось, что β - распад сопровождается испусканием еще одной частицы – антинейтрино, а помимо β - распада существует β+ - распад, который сопровождается испусканием позитрона (античастицы по отношению к электрону) и
64
нейтрино. γ - лучи не отклоняются ни магнитным, ни электрическим полем, не несут электрического заряда. По своей природе они аналогичны рентгеновским лучам, но отличаются от них большей величиной энергии квантов, γ - лучи в виде самостоятельного радиоактивного излучения среди естественно – радиоактивных веществ не встречаются, но они часто сопровождают как α -, так и β - лучи.
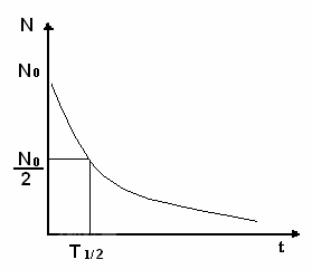
Оба типа распада подчиняются закону радиоактивного распада:
N N0 |
e t , |
(3) |
где N – число радиоактивных |
ядер, оставшихся к |
моменту; |
N0 – начальное число ядер; λ – постоянная распада изотопа; t – время. Вид данной зависимости изображен на рис. 1.
Рис.1. График радиоактивного распада
Постоянная распада представляет собой отношение количества атомов, распадающихся за одну секунду, к числу атомов радиоактивного вещества, находящихся в нем в данный момент времени, т.е., иными словами, величину вероятности того, что атом радиоактивного вещества претерпит в течение секунды радиоактивный распад. Постоянная распада характеризует устойчивость данного изотопа. Еще более наглядной характеристикой устойчивости изотопа является период его полураспада Т1/2,т.е. время, за которое распадается половина от первоначального числа атомов:
T |
|
ln2 |
. |
(4) |
|
||||
1/ 2 |
|
|
|
|
65 |
|
|
|
|

В настоящее время принято называть радиоактивные изотопы, встречающиеся в природе, естественными радиоактивными веществами, в отличие от радиоактивных изотопов, которые получаются искусственно, лабораторным или промышленным путем.
Рис.2. Радиоактивный ряд U238 – Pb206
Довольно часто оказывается, что возникающий в результате радиоактивного превращения новый изотоп является также радиоактивным. Многие естественно-радиоактивные изотопы оказываются между собой генетически связанными. Исходными (часто их называют материнскими) веществами для всех радиоактивных элементов, находящихся в конце таблицы Менделеева, являются уран (238) (рис.2), торий (232), актиний (235) и нептуний (237) (искусственное семейство). Отдельные радиоактивные
66

изотопы являются их дочерними продуктами. Совокупность всех изотопов, возникающих в результате ряда последовательных радиоактивных превращений из одного материнского вещества, принято называть радиоактивным семейством.
Заканчивается цепочка радиоактивных превращений в семействе стабильным изотопом – свинцом (206), (208), (207), висмутом (209).
Если отделить (химическим или иным путем) атомы какого-то радиоактивного изотопа, то затем в результате превращения начнут возникать атомы дочернего продукта. Со временем количество этого продукта будет накапливаться.
Если дочерний продукт является стабильным изотопом, то процесс его накопления будет продолжаться беспредельно, пока материнское вещество не исчезнет вовсе. Однако если дочерний изотоп сам является радиоактивным, то его накопление не будет продолжаться беспредельно, а лишь до определенного уровня.
Определим, от чего зависит этот уровень. Пусть λм – постоянная распада материнского, а λд – дочернего вещества. Закон радиоактивного распада можно записать так:
dN |
N , |
(5) |
|
||
dt |
|
|
где в левой части уравнения стоит скорость распада ядер. Скорость образования дочернего изотопа определится произведением Nм,λм, а скорость распада, убыли этих же ядер произведением Nд, λд. Таким образом, скорость накопления дочернего продукта определится соотношением
dNд M NM д Nд. dt
Если количество изотопов радиоактивного ряда не изменяется во времени, то говорят, что наступило условие радиоактивного равновесия, при котором скорость образования данного дочернего изотопа сравнялась с его скоростью распада. Следовательно, левая часть последнего уравнения обращается в нуль. И тогда выполняется равенство
M |
|
Nä |
|
(T1/2 )ä |
. |
(6) |
ä |
NM |
|
||||
|
|
(T1/2)M |
|
|||
То есть количество изотопов в равновесном состоянии соотносится как их периоды полураспада.
67

Упражнение 1. Определение периода полураспада радиоактивного изотопа
Представьте, что вы изучаете процесс распада некоего изотопа. Вы помещаете какое–то первоначальное количество атомов изотопа (200 млн.) в свинцовый «домик» и с помощью одного из приборов для регистрации числа распадов (например, счетчика Гейгера – Мюллера) проводите в определенные моменты времени отсчет со шкалы электромеханического счетчика числа распадов. Поскольку закон радиоактивного распада имеет статистический, вероятностный характер, то для более точного определения характеристик данный эксперимент повторяется несколько раз.
Рис.3. Рабочее окно программы
1.Выберите пункт меню «Радиоактивный изотоп». Исследуйте зависимость количества распадов ∆N от времени проведения экспериментов (не менее 15 моментов времени). Повторите эксперимент не менее 6 раз (рис.3).
2.Определите среднее количество распадов, среднее количество оставшихся атомов как N0 - ∆N. Заполните табл. 1.
3.Постройте график зависимости <N> =f(t).
4.По графику определите период полураспада элемента.
68

Определите изотоп, который используется в эксперименте (табл.4). Объясните ход зависимости числа радиоактивных ядер от времени.
Таблица 1
Результаты измерений
N0 t,мин ∆N1 ∆N2 ∆N3 ∆N4 ∆N5 ∆N6 <∆N> <N>
5. Ответьте на следующие вопросы:
а) Постоянная распада одного изотопа 0,001 с-1, а другого 300 с -1. Какой из них устойчивее?
б) Сколько атомов изотопа распадется в вашем эксперименте через 3 часа после начала? А сколько останется?
в) Активность препарата 10 Бк, а число радиоактивных атомов - 106. Каков период полураспада изотопа?
Упражнение 2. Исследование радиоактивного ряда 238U
1.Выберите пункт меню «Радиоактивный ряд». При выборе данного меню на экране появится окно (рис.4). Перепишите название элементов ряда с рис. 2.
2.Составьте уравнение радиоактивного распада для каждого изотопа. Выпишите из табл. периоды полураспада соответствующих элементов. Заполните табл. 2.
Таблица 2
Результаты экспериментов
Изотоп |
Уравнение распада |
T1/2 |
|
|
|
3. Проведите эксперимент при первоначальном количестве атомов элемента 238U 10000 - 20000 и времени 8000 -10000 лет.
4. Расставьте изотопы в табл.3 в порядке убывания числа
69
