
Белозеров В.И. Учебное пособие по курсу Техническая термодинамика (оригинал)
.pdf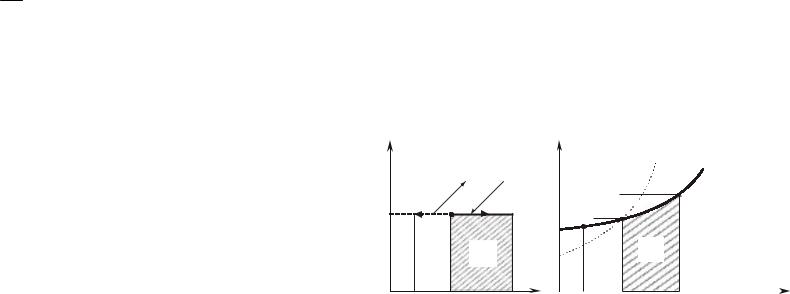
первого закона термодинамики принимает вид
v2 |
|
q ³Pdv l, |
(6.3.3) |
v1 |
|
т.е. все тепло, затраченное на процесс, расходуется на совершение работы изменения объема газа. Для идеального газа
PRT , v
следовательно,
v2 |
RT |
|
v |
(6.3.4) |
||
q l ³ |
|
dv |
RT ln |
2 |
. |
|
v |
v |
|
||||
v |
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
Полученное выражение показывает, что если v |
> v , òî q > 0 è |
|||||
|
|
|
|
2 |
1 |
|
l > 0. Это означает, что при подводе тепла газ расширяется, изотер-
ма направлена слева направо и работа его положительна. Если v < v ,
2 1
то q < 0 и l < 0, т.е. при отводе тепла газ сжимается, изотерма направлена справа налево и работа отрицательна.
Если в изотермическом процессе |
v2 |
|
|
P1 |
, òî |
|
|
|
|||||||||||||
v1 |
P2 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
q |
l |
RT ln |
P1 |
. |
|
|
|
(6.3.5) |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
|
|
|
|
|
|||
Из рис. 6.3.1,б видно, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
q |
T S2 S1 |
|
|
|
|
|
(6.3.6) |
|||||||||
èëè S2 S1 |
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, ò.ê. q = l, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT ln |
v2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
S |
|
S |
v1 |
|
R ln |
v2 |
|
|
R ln |
P1 |
. |
(6.3.7) |
|||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
1 |
T |
|
|
|
|
|
|
|
|
v1 |
|
|
|
P2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Для изотермического процесса |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
u |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
0. |
|
|
|
|
|
|
|
|
(6.3.8) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
q
Для любого термодинамического процесса представляет интерес отношение изменения внутренней энергии u к количеству подведенного или отведенного тепла q
|
|
u |
||
|
|
|
|
. |
|
|
|
||
|
|
q |
||
Для изохорного процесса |
u |
1. |
||
|
||||
|
q |
|||
6.2. Изобарный процесс
Изобарным называется такой процесс изменения состояния рабочего тела, при котором давление его остается постоянным. Линия, изображающая этот процесс графически, называется изобарой.
|
P |
|
|
a) |
Ò |
|
|
v = const |
á) |
|
|
|
|
|
|
|
|
||
|
|
-q |
+q |
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
2 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2χ |
|
|
|
|
|
|
|
p = const |
|
1 |
2 |
|
2χ |
T |
1 |
|
|
|
P = P |
|
|
|
1 |
|
|
|
||
|
|
|
|
|
|
|
|||
1 |
2 |
|
|
|
|
|
|
|
|
|
|
-l |
+l |
|
|
|
|
+q |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
-q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v χ |
v |
v |
v |
|
|
S |
S |
S |
|
2 |
1 |
|
2 |
|
|
1 |
2 |
|
|
|
|
|
|
Ðèñ. 6.2.1 |
|
|
|
|
Связь между термическими параметрами начального и конечного состояний может быть получена из уравнения состояния идеального газа при P = const
v1 |
|
T1 |
, |
(6.2.1) |
|
|
v2 T2
откуда видно, что изобара нагревания направлена слева направо, изобара охлаждения – справа налево (рис. 6.2.1, а).
84 |
81 |
83 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.Ðèñ1.3.6 |
|
|
|
|
|
|
|
|
2 |
1 |
χ |
2 |
|
2 |
|
1 |
|
χ |
2 |
S |
S |
S |
S |
v |
v |
|
v |
|
v |
||
|
|
|
|
|
|
|
|
|
|
||
|
|
+q |
-q |
|
|
|
+l |
|
-l |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
1 |
|
|
|
|
|
|
|
|
=v |
v |
|
|
|
|
|
|
|
|
|
|
|
P |
1 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
χ |
2 |
+q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
á) |
|
|
|
T |
|
|
|
|
χ |
2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
-q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a) |
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
.е.твнутренняяэнергиянеизменяется,аналитическоевыражение |
|||||||||||
|
0, |
|
1 |
|
2 |
|
v |
|
|
1 |
|
|
|
2 |
|
|
|
|
|
||||||
.3.(62) |
|
|
|
|
C |
|
u |
|
u |
|
|
|
|||||||||||||
|
|
|
|
TT |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
Посколькувизотермическомпроцессе |
||||||||||||||||||
|
|
|
|
рамме,называетсяизотермой.(рис1,.3.6.а) |
|||||||||||||||||||||
Pv |
Линия,котораяизображаетизотермическийпроцессна |
||||||||||||||||||||||||
-äèàã- |
|||||||||||||||||||||||||
.3.(61) |
|
|
|
|
|
|
|
|
|
const. |
|
Pv |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
изуравнениясостоянияидеальногогаза,еслипринятьT=const: |
|||||||||||||||||||||||||
Связьмеждутермическимипараметрамиможетбытьполучена |
|||||||||||||||||||||||||
яниярабочеготела,прикоторомтемператураостается.постоянной |
|||||||||||||||||||||||||
Изотермическимпроцессомназываетсятакоеизменениесосто- |
|||||||||||||||||||||||||
|
.3.6Изотермическийпроцесс |
||||||||||||||||||||||||
|
|
|
|
|
P |
|
|
|
|
|
1 |
|
|
2 |
|
P |
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
C |
T |
|
|
C |
|
|
|
q |
|
|||||||||||
|
. |
|
|
|
T |
|
|
|
|
|
|||||||||||||||
|
|
|
|
v |
|
|
|
|
|
1 |
|
|
2 |
|
v |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
C |
|
|
|
|
|
|
|
|
|
u |
|
|
|
||||||||
|
|
|
|
|
T |
|
|
|
C |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дляизобарногопроцесса |
|||||||
|
|
|
|
чтоизобараидетболееполого,чем.изохора |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
P |
>C,то,сравниваяформулы.2.(68)и5),.1.(6видим, |
ПосколькуC |
||||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
. |
|
v |
ln |
P |
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
.2.(69) |
|
|
|
|
|
2 |
|
C |
|
S |
|
S |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сучетом.2.(61) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
82 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
T |
|
|
|
T |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
T |
P |
|
|
|
|
|
|
|
|
P |
|
|
|
³ |
|
|
|
³ |
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|||||||
.2.(68) |
|
|
|
|
|
|
, |
|
2 |
|
ln |
|
C |
|
|
dT |
|
|
C |
|
|
|
dq |
|
|
S |
|
|
S |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
определяетсяформулой |
||||||||||
Еслисчитатьтеплоемкостьпостоянной,тоизменениеэнтропии |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
барномнагреванииегонаодин.градус |
||||||||||||||||||||||||||||
постояннойR:этоработарасширения1кгидеальногогазаприизо- |
||||||||||||||||||||||||||||||||||||||||||||||||
Уравнение.2.(67)позволяетвыяснитьфизическийсмыслгазовой |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
.2.(67) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
RTT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
сучетомуравнениясостоянияидеальногогаза |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
1 |
|
|
|
2 |
|
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
.2.(66) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
Pv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Величинаработывизобарномпроцессевыразитсяпоформуле |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
0 |
|
|
|
|
|
2 |
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
C |
|
t |
P |
C |
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
.2.(65) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
тиоттемпературы,дляизобарногопроцессаможнозаписать |
||||||||||||||||||||||||||||||||||||||||||||||||
Втеплотехническихрасчетах,учитываяизменениетеплоемкос- |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ведливыдлялюбого.процесса |
|||||||||||||||
виситотхарактерапроцесса,поэтомуприведенныеформулыспра- |
||||||||||||||||||||||||||||||||||||||||||||||||
Энтальпияявляетсяфункциейсостояния,иееизменениенеза- |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
1 |
2 |
|
|
|
P |
|
|
|
1 |
|
|
|
|
2 |
|
|
|
P |
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
P |
|
|
|
|
|
|
|
|||||
..2.(64) |
|
t |
|
t |
|
C |
T |
|
|
|
|
|
|
C |
|
|
|
h |
Cdtèh |
|
dh |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
поэтому |
|
|
|
1 |
|
2 |
|
|
P |
|
|
|
1 |
|
|
|
2 |
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
P |
|
|
|
|
|
||||||
.2.(63) |
, |
t |
|
t |
|
C |
T |
|
|
|
|
|
C |
|
|
èq |
Cdt |
|
|
CdT |
dq |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Согласноопределениютеплоемкости |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ходуетсянаизменениеэнтальпии.газа |
|||||||||||||||||||||||||||
Такимобразом,визобарномпроцессевсеподводимоетеплорас- |
||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
|
2 |
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
u |
|
1 |
|
|
2 |
Pv |
1 |
|
2 |
u |
q |
|||||||||||
.2.(62) |
h. |
h |
|
|
Pv |
|
u |
|
|
|
Pv |
|
|
v |
|
u |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дляизобарногопроцессапринимаетвид |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
³Pdv |
|
1 |
|
|
|
2 |
u |
q |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
u |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Аналитическоевыражениепервогозаконатермодинамики |
||||||||||||||||||||||||||||||||||||||||||||||||
Уравнение политропного процесса
Pvn const , |
(6.5.1) |
где п – показатель политропы, изменяющийся для различных процессов от 0 до ±φ.
Для одного и того же процесса показатель политропы n – величи- на постоянная.
Рассмотрим уравнение (6.5.1) при некоторых значениях п:
•при n = 0 получаем Pv0 = P = const – изобарный процесс;
•при n = 1 получаем Pv = const – изотермический процесс;
•при n = k получаем Pvk = const – адиабатный процесс;
ρ |
1 |
|
ρ |
1 |
|
• ïðè n ρφ P φ v |
const (ò.ê. P φ 1, то v = const) – изохорный |
||||
процесс. |
|
|
|
|
|
Таким образом, рассмотренные основные термодинамические процессы являются частными случаями политропных процессов (при условии, что теплоемкость в этих процессах принимается постоянной).
Изобразим политропные процессы в Pv-координатах при различ- ных показателях политропы n (рис. 6.5.1).
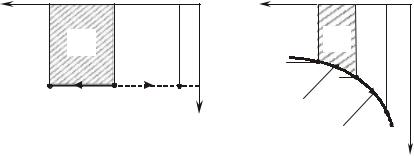
Адиабата делит все процессы в Pv-координатах на две группы:
•процессы, распложенные выше адиабаты; в этой группе процессов тепло подводится;
•процессы, расположенные ниже адиабаты; в этой группе процессов тепло отводится.
Уравнения политропы Pvn = const и адиабаты Pvk = const одинаковы по форме и отличаются только показателем, поэтому зависи-
P |
|
n = φ |
|
|
U > 0, n < 1 |
|
q > 0, n < k |
|
n = 0 |
q < 0, n > k |
1 > n > 0 |
|
|
|
n = 1 |
U < 0, n > 1 |
n = k |
n =+φ φ> n > k |
|
|
v |
Ðèñ. 6.5.1 |
|
|
|
6.4. Адиабатный процесс |
|
|
||||||||
Адиабатным называется процесс изменения состояния рабоче- |
||||||||||||
го тела, протекающего без теплообмена с окружающей средой. |
||||||||||||
Уравнение адиабаты может быть получено из аналитических |
||||||||||||
выражений первого закона термодинамики, которые в данном слу- |
||||||||||||
чае принимают вид |
|
|
|
|
|
|
|
|
|
|
||
dq |
du Pdv |
Cv dT Pdv |
0, |
|
dq |
|
dh vdP |
CP dT vdP |
0, |
|||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cv dT Pdv, |
|
|
|||||
|
|
|
|
|
CP dT vdP. |
|
|
|||||
Разделив первое уравнение на второе, получаем |
|
|||||||||||
|
|
|
|
|
CP |
|
vdP |
, |
|
|
||
|
|
|
|
|
Cv |
|
Pdv |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
CP |
k, ò.å. k |
|
|
vdP |
|
dP |
k |
dv |
|
|
||
ãäå |
|
Pdv |
èëè |
|
|
|
0. |
|
|
|||
Cv |
|
|
|
|
P |
|
|
v |
|
|
||
Интегрируя это уравнение, получаем |
|
|
|
|
||||||||
|
|
|
|
ln P k ln v |
const |
|
|
|||||
èëè |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Pvk |
|
const. |
|
(6.4.1) |
|||
|
P |
|
|
|
|
a) |
|
T |
|
á) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2χ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изотерма |
|
|
|
|
2χ |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
P |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
1 |
|
|
|
|
|
|
P |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
-l |
+l |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v χ |
v |
|
v |
|
v |
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
||||
|
2 |
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ðèñ. 6.4.1 |
|
|
|
|||
88 |
85 |
87 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ся.политропными |
|||||||
данногопроцессаостается.неизменнойТакиепроцессыназывают- |
|||||||||||||||||||||||||||
втечение |
q |
D |
нетвышеуказанныхограничений,новеличина |
||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
'u |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кромерассмотренныхсуществуютпроцессы,укоторыххотяи |
|||||||||||||||||||||||||||
|
|
.5.6Политропныйпроцесс |
|
|
|
|
|
|
|||||||||||||||||||
.4.(69) |
|
|
. |
|
rf |
0 |
|
|
|
|
|
|
q |
|
D |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
'u |
|
|
|
|
|
'u |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дляадиабатногопроцесса |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–.(сжатия) |
c |
рения)и1-2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.4.61,б)адиабатаизображаетсяпрямой1-2(адиабатарасши- |
(ðèñ. |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
1 |
|
1 |
2 |
|
|
|
|
|
|
|
|
=S=.constВTS-координатах |
=S |
=0èS |
–S |
следовательно,S |
|||||||||||||||||||||||
|
|
|
|
|
|
|
0, |
|
TdS |
dq |
|
|
|
|
|
|
|
|
|||||||||
Изменениеэнтропиивадиабатномпроцессеравнонулю,таккак |
|||||||||||||||||||||||||||
|
|
|
. |
2 |
2 |
|
1 |
1 |
|
|
|
1 |
k |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
.4.(68) |
|
|
|
Pv |
Pv |
|
|
1 |
|
l |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
èëè |
|
|
|
|
|
|
2 |
1 |
|
k1 |
|
|
|
|
|
|
|
|
|
|
||||||||
.4.(67) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
T |
T |
|
|
|
R |
|
|
|
l |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k1 |
v |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
òî |
, |
|
R |
|
C |
à.ê.ò |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
, |
|
2 |
|
1 |
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
C |
l |
|
|
|
|
|
|
|
|
||||||||||
.4.(66) |
|
|
|
|
|
TT |
|
|
|
|
|
|
|
|
|
||||||||||||
тоработаадиабатногопроцессаможетбытьнайденапоформуле |
|||||||||||||||||||||||||||
|
|
|
, |
|
2 |
|
1 |
|
v |
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
||||
|
|
|
T |
|
|
|
C |
|
|
uu |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
Посколькудлялюбогопроцесса |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тие–ее.увеличением |
||||||||
провождаетсяуменьшениемтемпературыгаза,аадиабатноесжа- |
|||||||||||||||||||||||||||
ренняяэнергияувеличивается,поэтомуадиабатноерасширениесо- |
|||||||||||||||||||||||||||
шается;еслипроисходитсжатиеиработагазаотрицательна,товнут- |
|||||||||||||||||||||||||||
расширяетсяиработаположительна,товнутренняяэнергияумень- |
|||||||||||||||||||||||||||
86
цессесовершаетсязасчетизменениявнутренней.энергииЕслигаз |
|||||
Этоозначает,чтоработаизмененияобъемавадиабатномпро- |
|||||
|
l. |
2 |
u |
1 |
|
.4.(65) |
|
u |
|
||
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
+l=0èëè |
–u |
адиабатногопроцессаq=u |
||
Аналитическоевыражениепервогозаконатермодинамикидля |
|||||
|
|
|
|
|
|
|
|
|
¹ |
2 |
© |
|
|
|
2 |
|
|
|
|
|
|
|
|
||||
.4.(64) |
|
. |
|
|
|
|
|
¸ |
P |
¨ |
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
k |
|
§P· |
|
|
|
T |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
k1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откудаокончательнонаходим |
|||||||
|
|
¹ |
2 |
© |
|
|
|
¹ |
|
|
2 |
|
© |
1 |
|
|
|
|
|||||||||
|
, |
¸ |
|
|
T |
¨ |
|
|
|
¸ |
|
|
|
P |
¨ |
|
v |
|
|
|
|
||||||
|
1 |
|
|
|
|
|
1 |
|
2 |
|
|
|
|
||||||||||||||
|
|
·k1 |
|
|
§T |
|
§P·k |
|
v |
|
|
|
|||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•междуPиT:изформул.4.(62)и.4.(63)получаем |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
¹ |
1 |
© |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
.4.(63) |
|
; |
|
|
|
|
|
¸ |
|
v |
¨ |
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
k1 |
· |
|
v |
§ |
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
иокончательно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
1 |
|
2 |
2 |
1 |
|
1 |
|
|
|
|
|
2 |
|
|
v |
1 |
v |
||||||||||||
k1 |
Tv |
|
k1 |
Tv |
|
èëè |
k |
v |
2 |
|
|
k |
v |
1 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
нияидеальногогазаPv=RT,получаем |
|||||||||||||||||||
•междуTиv:сопоставляяформулы.4.(61)иуравнениесостоя- |
|||||||||||||||||||||||||||
|
|
|
|
|
|
¹ |
|
1 |
|
© |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
.4.(62) |
|
; |
|
|
¸ |
|
v |
¨ |
|
|
|
P |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
2 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
· |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
k |
|
§v |
|
|
|
P |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
•междуPиvизуравненияадиабаты.4.(61) |
||||||||||||||||||||||||||
конечногосостоянийгазавыражаетсятремяуравнениями: |
|||||||||||||||||||||||||||
переменны,поэтомусвязьмеждуихзначениямидляначальногои |
|||||||||||||||||||||||||||
Вадиабатномпроцессевсетритермическихпараметра(P,v,T) |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
чеизотермы,.к.тk>1.(рис4.6..1,а) |
||||||||||||||||
Графическиадиабата,изображаемаялинией1-2,несколькокру- |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уравнением.адиабаты |
|||||
ПолученноесоотношениеназываютуравнениемПуассонаили |
|||||||||||||||||||||||||||

вания не изменяется.
Для идеального газа внутренняя энергия не зависит от объема, а в процессе дросселирования газ не совершает работы и не участвует в теплообмене, поэтому его внутренняя энергия остается постоянной:
du 0, dT 0, dh 0 .
Для реального газа внутренняя энергия зависит от объема, поэтому при дросселировании
du z 0, dT z 0, dh 0.
В зависимости от начальных параметров температура реальных газов в конце процесса дросселирования может быть выше, ниже или равна начальной температуре (температура инверсии).
Процесс дросселирования сопровождается трением и завихрениями и является необратимым процессом, поэтому не может быть изображен каким-либо графиком.
Для лучшего понимания физики процессов, происходящих в потоке при его дросселировании, обратимся к первому закону термодинамики для потока (при отсутствии трения) для любого обратимого и необратимого потока
|
|
|
|
|
|
|
|
|
w2 |
w2 |
|
|
|
|
|
||
q |
h |
|
h |
|
|
|
2 |
1 |
g z |
|
z |
l . |
|||||
2 |
1 |
|
|
|
2 |
||||||||||||
âíåø |
|
|
|
|
|
|
2 |
|
|
1 |
|
òåõí |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для случая q |
|
|
|
0, |
z |
|
z |
, |
l |
0, |
w | w |
, следует |
|||||
âíåø |
|
|
|
|
1 |
2 |
|
òåõí |
|
|
1 |
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
h1 |
h2 . |
|
|
|
|
|
||
Следовательно, постоянство энтальпий является свойством любого обратимого и необратимого адиабатного горизонтального потока малой скорости, не совершающего работы, а не «привилегией» дросселируемого потока.
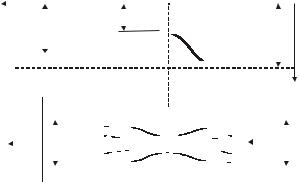
Здесь рассматривалось состояние дросселируемого вещества до дросселя и за дросселем. В самом же дросселе энтальпия может изменяться: проходя через сужение, поток ускоряется, его кинети- ческая энергия возрастает, а, следовательно, энтальпия уменьшается, за дросселем сечение потока снова возрастает, поток замедляется (тормозится), его кинетическая энергия уменьшается и энтальпия увеличивается до прежнего состояния (рис.6.6.2).
|
|
Таблица 6.5.1 |
|
|
|
Изменение внутренней энергии |
Расширение газа |
Сжатие газа |
|
|
|
U > 0 |
n < 1 |
n > 1 |
|
|
|
U = 0 |
n = 0 |
n = 0 |
|
|
|
U < 0 |
n > 1 |
n < 1 |
|
|
|
Знак теплоты |
Расширение газа |
Сжатие газа |
|
|
|
q > 0 |
n < k |
n > k |
|
|
|
q = 0 |
n = k |
n = k |
|
|
|
q < 0 |
n > k |
n < k |
|
|
|
мости, выведенные для адиабатного процесса, остаются справедливыми и для политропного процесса при замене показателя k показателем n. Таким образом, зависимости между основными терми- ческими параметрами имеют вид
|
§ v ·n 1 |
|
§ v |
|
·n |
|
§ P · |
n 1 |
|
||||||||
T |
P |
|
T |
n |
|
|
|||||||||||
1 |
¨ |
2 |
¸ |
; |
1 |
¨ |
|
2 |
¸ |
; |
1 |
¨ |
1 |
¸ . |
(6.5.2) |
||
|
|
|
|
||||||||||||||
|
|
|
|
|
|
||||||||||||
T2 |
© v1 ¹ |
|
P2 |
© v1 ¹ |
|
T2 |
© |
P2 ¹ |
|
||||||||
Величина работы вычисляется по формулам
l |
R |
T |
T |
, l |
1 |
Pv |
P v |
. |
(6.5.3) |
|
|
||||||||
|
n 1 1 |
2 |
|
n 1 1 1 |
2 2 |
|
|
||
Согласно первому закону термодинамики для политропного процесса
q u |
|
u |
l Cv T |
T |
|
R |
|
T |
T |
|
§C |
|
|
R |
· |
T |
T |
. |
|
2 |
|
v |
|
|
¸ |
||||||||||||||
|
1 |
2 |
1 |
|
n 1 |
1 |
2 |
|
¨ |
|
n 1 |
2 |
1 |
|
|||||
|
|
|
|
|
|
|
|
|
© |
|
|
¹ |
|
|
|
||||
Сравнивая полученное выражение с формулой q = C(T – T ), на-
2 1
ходим зависимость
C Cv |
|
R nCv Cv R nCv CP |
||||
|
|
|
|
|
||
n 1 |
n 1 |
|
n 1 |
|||
|
|
|
||||
или, учитывая, что CP k,
Cv
92 |
89 |
91
.е.тэнтальпиягазаилижидкостиврезультатепроцессадросселиро- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
.6.(62) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
2 |
|
h |
|
1 |
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
| |
1 |
|
1 |
|
|
|
||||||
тогдауравнение.6.(61)приметвид |
w, |
койкскоростиw,.е.тw |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
послесуженияокажетсяблиз- |
|
,тоскоростьрабочеготелаw |
âîf=f |
||||||||||||||||||||||||||||||||||||||||||||||||||||
Посколькусечениетрубыпередсужениемипосленегоодинако- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
.6.(61) |
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
2 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
h |
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
w |
2 |
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
2 |
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
h |
|
|
1 |
|
|
|
|
|
h |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
w |
|
|
|
|
|
|
|
|
|
|
|
2 |
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
ноu+Pv=h,иуравнениепринимаетвид |
||||||||||||||||||||||||||||||||||||||||||
2 |
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
1 |
|
|
|
1 |
|
1 |
|
|
|
|
|
|||||||||||||||||||
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
2 |
|
|
|
|
|
|
Pv |
|
|
|
u |
|
|
1 |
|
|
|
|
|
Pv |
u |
|
||||||||||||||||||||||||||||||||
2 |
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
селированияадиабатным,можнонаписать |
|||||||||||||||||||||||||||||||||||||||||||
жидкостиилигазадоипосле.дросселированияСчитаяпроцессдрос- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Напишемуравнениепервогозаконатермодинамикидляпотока |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
стия,отплотностирабочеготелаидругих.факторов |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
скоростирабочеготела,ототносительнойвеличинысуженияотвер- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
Величинападениядавлениязависитотначальныхпараметрови |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ностьюоткрытый.шибер) |
|||||||||||||
мятием(примеры:кран,вентиль,задвижканапаропроводе,непол- |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.Ðèñ1.6.6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
|
|
>P |
|
P |
|
|
|||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||||||
v |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
1 |
||
|
|
|
f |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
f |
|||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
w |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
90 |
|
теканиячерезсужениевканаленазываетсядросселированиемили |
|||||||||||||||||||||||||||
Эффектпадениядавленияструирабочеготелавпроцессепро- |
|||||||||||||||||||||||||||
|
|
Такоесужениеназываютместным.сопротивлением |
|||||||||||||||||||||||||
костизасужениембудетвсегдаменьше,чемпередним.(рис6.6..1) |
|||||||||||||||||||||||||||
сужение,азатемсечениеувеличивается,тодавлениегазаилижид- |
|||||||||||||||||||||||||||
Изопытаизвестно,есливтрубеиливдругомканалеимеется |
|||||||||||||||||||||||||||
6.6..ДросселированиеЭффектТомсона–Джоуля |
|||||||||||||||||||||||||||
|
n1 |
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
nk |
C |
C |
гдеC–теплоемкостьполитропногопроцесса |
|||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
Cln |
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|||||
.5.(67) |
|
|
|
|
|
, |
2 |
|
|
|
S |
|
S |
|
|
||||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
формуле |
|
Изменениеэнтропииполитропногопроцессаопределяетсяпо |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
n1 |
v |
|
|
|
|
|||||||||
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
C |
|
|
||||||||
|
|
|
k |
n |
|
|
|
|
T |
nk |
q |
|
|||||||||||||||
.5.(66) |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
1 |
n |
|
|
|
|
1 |
|
|
|
|
2 |
|
|
v |
|
|
|
u |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
T |
T |
|
|
C |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Дляполитропногопроцессавеличина |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
≠ |
|
1 |
|
♥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
ln♦ |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||||||||
.5.(65) |
|
|
|
|
|
|
|
|
|
. |
|
∙ |
|
v |
♣ |
|
|
|
|
|
|
n |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
≠ |
|
2 |
|
♥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
P |
ln♦ |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
♣P∙ |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
–прямаялиниявлогарифмическихкоординатахили |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
lnP=nlnv=const |
|
|
||||||||||||||||||
=const,получаем |
ЛогарифмируяуравнениеполитропыPv |
||||||||||||||||||||||||||
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.цесса |
|
Формулой.5.(64)определяетсятеплоемкостьполитропногопро- |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
1 |
n |
|
|
|
|
|
|
|||||
.5.(64) |
|
|
|
|
|
|
|
|
|
. |
C |
nk |
C |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||

§ wT · |
§ wT · |
||||
ним между собой ¨ |
|
¸ |
è ¨ |
|
¸ . |
|
|
||||
© wP ¹h |
© wP ¹S |
||||
§ wT ·
Производная ¨ ¸ , которая называется коэффициентом обрати-
© wP ¹S
мого адиабатного (изоэнтропного) расширения и обозначается D ,
S
может быть представлена в следующем виде: из соотношения
§ wT · § wP · § wS · |
1 |
|
|
|
|
||||||||||
¨ |
|
¸ ¨ |
|
|
¸ ¨ |
|
|
¸ |
|
|
|
|
|||
|
|
|
|
|
|
|
|||||||||
© wP ¹S © wS |
¹T © wT ¹P |
|
|
|
|
||||||||||
|
|
|
§ wP · |
§ wT · |
§ wS · |
||||||||||
с учетом уравнения Максвелла ¨ |
|
|
¸ |
|
¨ |
|
¸ |
è ¨ |
|
¸ |
|||||
|
|
|
|
|
|||||||||||
|
|
|
© wS |
¹T |
© wv |
¹P |
© wT ¹P |
||||||||
лучим
§ wT · DS ¨ ¸ © wP ¹S
ò.å.
|
§ wv · |
|
|
|
|
|
§ wv · |
|
|
||||
T |
¨ |
|
¸ |
|
|
§ wT · |
T ¨ |
|
¸ |
v |
|||
|
|
|
|
||||||||||
|
© wT ¹P |
|
|
© wT |
¹P |
|
|
||||||
|
|
|
|
, Dh ¨ |
|
¸ |
|
|
|
|
, |
||
|
|
CP |
|
|
CP |
|
|||||||
|
|
|
|
© wP ¹h |
|
|
|
||||||
DS |
Dh |
|
v |
, DS > Dh , |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
CP |
|
|
|
|
|
|||
CP ïî-
T
т.к. v и C всегда положительны.
P
Таким образом, процесс обратимого адиабатного расширения (с отдачей внешней работы) обеспечивает более эффективное с термодинамической точки зрения охлаждение газа или жидкости, чем процесс адиабатного дросселирования, т.е. необратимого адиабатного расширения.
96
Если поток с трением, тогда из |
h |
|
|
||||
|
|
|
|
|
|
||
(1.5.16) |
|
|
|
|
|
|
|
wdw |
vdP dl |
, |
P |
|
|
||
1 |
|
|
|||||
|
|
|
|||||
|
|
òð |
|
|
|
P |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
2 |
|
а если при дросселировании w |0, то |
t |
1 |
t |
||||
1 |
|||||||
2 |
2 |
||||||
|
|||||||
|
|
|
|||||
dl |
vdP, |
(6.6.3) |
|
|
|
||
|
òð |
|
|
|
|
|
|
т.е. в таком потоке давление вдоль |
2χ |
|
|
||||
потока падает (dP < 0) вследствие |
|
S |
|||||
|
|
|
|||||
затраты потоком работы на преодо- |
|
|
|
||||
|
|
|
|
Ðèñ. 6.6.2 |
|
|
|
ление трения (dl |
> 0). Åñëè áû |
|
|
|
|||
|
|
òð |
|
|
|
|
|
dl =0, òî dP = 0, P=const. |
|
|
|
|
|||
òð |
|
|
|
|
|
|
|
Рассмотрим вопрос о том, как меняется температура реального |
|||||||
газа или жидкости в процессе адиабатного дросселирования. По- |
|||||||
§ wT ·
скольку h=const, то нужно знать ¨ ¸ .
© wP ¹h
Из соотношений
§ wT · § wP · § wh ·
°¨ ¸ ¨ ¸ ¨ ¸ °© wP ¹h © wh ¹T © wT ¹P
° |
§ wh · |
¨ ¸
°© wT ¹P®CP
°§ wh · |
|
|
|
§ wv · |
|||||||
°¨ |
|
|
¸ |
|
|
v T ¨ |
|
¸ |
|||
wP |
|
wT |
|||||||||
°© |
|
|
¹T |
|
© |
|
|
¹P |
|||
¯ |
|
|
|
|
|
|
|
|
|
|
|
получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
§ wv · |
|
|||
|
§ wT · |
T ¨ |
|
¸ |
v |
||||||
|
|
||||||||||
|
|
© wT |
¹P |
||||||||
¨ |
|
|
|
¸ |
|
|
|
|
|
|
|
|
|
|
|
|
|
CP |
|
||||
|
© wP |
¹h |
|
|
|
|
|||||
1
. (6.6.4)
§ wT ·
Величина ¨ ¸ называется коэффициентом адиабатного дрос-
© wP ¹h
селирования, или дифференциальным дроссель-эффектом, его обо-
§ wT ·
значают Dh ¨ ¸ .
© wP ¹h
93

95 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
етинтерессравнениеэтихдвухспособовохлаждения.газовСрав- |
||||||||||||||||||||||||||
ногорасширения(сотдачейвнешнейработы),поэтомупредставля- |
||||||||||||||||||||||||||
ниягазовявляетсяпроцессобратимогоадиабатного,.е.тизоэнтроп- |
||||||||||||||||||||||||||
Ранееупоминалосьотом,чтоэффективнымспособомохлажде- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.инверсии |
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
>0,.е.твобластиподкривой |
D |
детохлаждатьсятольковслучае |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ствеэффективногоспособаохлаждения.газовПонятно,чтогазбу- |
||||||||||||||||||||||||||
Адиабатноедросселированиеможетбытьиспользовановкаче- |
||||||||||||||||||||||||||
|
сии(600°Сивыше)заисключениемводорода–(80°С)и.гелия |
|||||||||||||||||||||||||
Большинствогазовимеетдовольновысокуютемпературуинвер- |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.ñèè |
диаграммесостоянияданноговеществаназываетсякривойинвер- |
||||||||||||||||||||||||||
фекта.Томсона–ДжоуляГеометрическоеместоточекинверсиина |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
=0,называетсяточкойинверсииэф- |
|
D |
газа(жидкости),вкотором |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зываетсяразличнымвразличныхобластях.состоянияСостояние |
||||||||||||||||||||||||||
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
îêà- |
D |
Какпоказываетопыт,дляодногоитогожевеществазнак |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ваальсовскогогазаэффектТомсона–Джоулянеравен.нулю |
||||||||||||||||||||||||
реальныхгазови.жидкостейКакпоказываютрасчетыдляван-дер- |
||||||||||||||||||||||||||
Такимобразом,эффектТомсона–Джоуляимеетместотолькодля |
||||||||||||||||||||||||||
|
|
|
P |
©wv¹ |
|
|
|
|
|
|
|
|
|
P |
¹ |
|
wT |
© |
|
|
|
|
||||
|
|
|
|
|
|
È |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
. |
|
¸ |
|
|
¨ |
v |
0,T |
|
|
v |
|
¸ |
|
|
¨ |
T |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
§wT· |
|
|
|
wv· |
§ |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
определяетсяследующимобразом: |
ратуройинверсии, |
|||||||||||||||||||||||
ведетсебякакидеальный,атемпературагаза,называемаятемпе- |
||||||||||||||||||||||||||
сябезизменения.температурыДлятретьегослучаяреальныйгаз |
||||||||||||||||||||||||||
|
|
|
|
|
|
T |
P |
¹ |
©wT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
,тоондросселирует- |
|
|
|
|
|
¸ |
|
Посколькудляидеальногогаза¨ |
||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
v |
|
§wv· |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
селированиятемпературавеществане.изменяется) |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¼ |
|
P |
©wT¹ |
¬ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
=0(впроцессеадиабатногодрос- |
dT |
=0, |
» |
|
|
¸ |
|
¨ |
.3)Åñëè« |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
º |
|
|
v· |
§ |
ª |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
говещества.увеличивается) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¼ |
|
|
P |
©wT¹ |
¬ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
||||||
>0(температурадросселируемо- |
|
|
<0, |
» |
|
¸ |
|
¨ |
T |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
º |
|
|
|
v· |
§ |
ª |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w |
|
||
селированиятемпературадросселируемоговещества.уменьшается) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¼ |
|
P |
©wT¹ |
¬ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¸ |
|
¨ |
T |
|
<0(впроцессеадиабатногодрос- |
dT |
|
>0, |
» |
|
|
|
.1)Åñëè« |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
º |
|
|
v· |
§ |
ª |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
w |
|
|||
94
|
|
.Ðèñ3.6.6 |
|
|
|
|
1 |
|
2 |
|
T |
T |
|
T |
|
|
1 |
|
|
|
|
|
h=const |
2 |
|
1 |
|
|
|
=const |
P |
|
h |
|
|
|
|
2 |
|
|
|
=const |
P |
|
|
|
|
|
|
¼ |
|
P |
©wT¹ |
¬ |
||
|
|
P |
|
|
v |
|
|||||
|
|
|
|
|
|
|
|
|
|
T |
|
всегда>.0) |
C |
(поскольку |
» |
|
|
¸ |
|
¨ |
íèåì« |
||
|
|
|
|
|
º |
|
|
v· |
§ |
ª |
|
|
|
|
|
|
|
|
|
w |
|
||
|
h |
|
|
|
|
|
|
|
|
|
|
определяетсявыраже- |
D |
Изуравнения.6.(64)следует,чтознак |
|||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
получимтемпературузадросселемT. |
|||||||||
2 |
|
1 |
|
|
|
|
|
|
|
|
|
дяточкупересеченияизоэнтальпыh=constсизобаройP=const, |
|||||||||||
11
наhT-диаграмме(точка1)инай- |
èT |
нанесяточкуспараметрамиP |
|||||||||
|
2 |
|
|
1 |
|
|
|
|
|
1 |
|
задросселем,то, |
идавлениеP |
егодавлениеPитемператураT, |
|||||||||
Еслиизвестносостояниегаза(жидкости)переддросселем,.е.т |
|||||||||||
эффектаудобновыполнятьспомощьюhT-диаграммы6.6.(рис..3) |
|||||||||||
Определениевеличиныинтегральногоадиабатногодроссель- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
уменьшитсядоt=180°С.е.(тна.270°С!!!) |
||||||||||
|
2 |
|
|
|
1 |
|
|
|
|
1 |
|
P=1кгс/см,температура |
èt=450°Ñäî |
2 |
параприP=300кгс/см |
||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
шой.величиныНапример,приадиабатномдросселированииводяного |
|||||||||||
Интегральныйдроссель-эффектможетдостигатьвесьмаболь- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
иT–температурыдоиза.дросселем |
ãäåT |
|||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
dP, |
h |
³D |
1 |
2 |
|
|
|
|
|
|
.6.(65) |
|
T |
T |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сяпосоотношению |
|
селеназываетсяинтегральнымдроссель-эффектом;онвычисляет- |
|||||||||||
годросселированияпризначительномперепадедавленийнадрос- |
|||||||||||
Изменениетемпературыгаза(жидкости)впроцессеадиабатно- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
.Томсона–уля |
|
|
|
|
|
|
h |
|
|
|
|
|
|
частоназываюткоэффициентомДжо- |
D |
Томсона;–Джоулявеличину |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
жидкостейприадиабатномдросселированииназываетсяэффектом |
|||||||||||
|
|
|
|
|
|
|
|
|
h |
|
|
.0Явлениеизменениятемпературыгазови |
Dz |
Вобщемслучае |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
§ |
a |
· |
v b RT , |
|
|
¨P |
|
|
¸ |
(7.1.1) |
|
v |
2 |
||||
© |
|
¹ |
|
|
|
учитывает реальные свойства газа – наличие межмолекулярного взаимодействия в газах и собственный объем молекул.
Уравнение (7.1.1) – это кубическое уравнение относительно v, следовательно, оно имеет три корня, причем возможны три случая:
1)один корень действительный и два мнимых;
2)все три корня действительные и различные;
3)все три корня действительные и равные между собой. Случай трех действительных равных между собой значений при
данном P соответствует критическому давлению. Случай одного действительного и двух мнимых корней соответствует сверхкрити- ческим давлениям, т.к. при заданных P и T возможно единственное значение v, а мнимые корни не имеют физического смысла. Три действительных и различных корня соответствуют докритическим давлениям.
Сверхкритические изотермы ван-дер-ваальсовского газа каче- ственно соответствуют изотермам реального газа. Докритические изотермы вместо горизонтального участка, соответствующего фазовому переходу «жидкость – пар», имеют волнообразный участок (рис. 7.1.3). Участок 1-2 соответствует метастабильному состоянию жидкости (перегретая жидкость), а участок 5-4 – метастабильному состоянию пара (переохлажденный пар); 1-3-5 – это участок изотермы, соответствующий фазовому переходу «жидкость – пар». В отличие от участков 1-2 и 5-4 эта прямая соответствует стабильным состояниям вещества. Участок 2-3-4 имеет волнообразный харак-
тер и поскольку на этом участке
|
|
|
§ wP · |
|
P |
|
|
¨ |
¸ >0, |
|
|
|
© wv ¹T |
|
|
k |
|
то он соответствует физически нереа- |
|
|
|
|
||
a |
|
|
|
|
4 |
|
|
лизуемым состояниям и лишен физи- |
|
|
|
|
|
|
|
|
|
ческого смысла. |
|
1 |
|
|
Положение изотермы 1-3-5 может |
|
|
|
|
|
|
3 |
5 |
b |
быть определено с помощью правила |
|
|
|
|
||
2 |
|
v |
Максвелла, согласно которому положе- |
|
|
|
|
ние прямой 1-3-5 относительно волно- |
|
Ðèñ. 7.1.3 |
|
|
|
|
Глава 7
РЕАЛЬНЫЙ ГАЗ. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНОГО ГАЗА
7.1. Опыты Эндрюса. Критическая точка.
Уравнение Ван-дер-Ваальса
Давно было известно, что ряд веществ, находящихся при комнатной температуре в газообразном состоянии, удается перевести в жидкое состояние путем сжатия при постоянной температуре: вна- чале газ сжимается, затем, когда давление газа достигнет величи-
ны P при данной температуре, начинается конденсация газа. После
S
превращения газа в жидкость дальнейшее сжатие будет приводить к увеличению давления жидкости; при этом из-за малой сжимаемости жидкости значительное увеличение давления приводит к весьма малому уменьшению удельного объема.
При уменьшении давления, действующего на жидкость, вещество пройдет те же самые состояния в обратном порядке: оно расширится до точки кипения, произойдет испарение, а затем получившийся пар будет расширяться до атмосферного давления.
До 1869 г. жидкости и их пары считались существенно различными фазами, как, например, твердое тело и жидкость. Это опроверг Т. Эндрюс (английский физик) после проведения опытов в 1857–1869 гг. с углекислотой.
Измеряя зависимость v от P на разных изотермах, Эндрюс установил, что чем выше температура, тем меньше разница между удельными объемами газообразной и жидкой фаз. С повышением температуры величина удельного объема сухого насыщенного пара vs быстро уменьшается, а величина удельного объема насыщенной жидкости (кипящей) vc увеличивается, следовательно, чем выше температура на изотерме, тем меньше величина разности (vs – vc), т.е. с повышением температуры уменьшается разница между плотностями жидкой и газовой фаз.
Характер зависимости v от P по изотермам изображен на рис. 7.1.1.
100 |
97 |

99 |
|
|
|
.Ðèñ2.1.7 |
|
ченийиимеющеевид |
|
|
|
||
T |
|
зом,наосновеумозрительныхзаклю- |
|
Ãàç |
|
Ваальса,полученное,главнымобра- |
|
êð |
|
реального.газаУравнениеВан-дер- |
|
|
|
||
v>v |
|
ляетвопрособуравнениисостояния |
|
|
|
||
|
|
Определенныйинтереспредстав- |
|
|
Жидкость |
отличаетсяотуравнения.Клапейрона |
|
|
уравнениесостоянияреальногогаза |
||
êð |
взаимодействие,врезультатечего |
||
v=v |
|||
|
|||
|
|
||
|
|
ственнымобъемомииспытывают |
|
êð |
|
P |
|
v<v |
|
ществемолекулыобладаютсоб- |
|
|
|
||
|
|
ственногообъема,товреальномве- |
|
молекулысчитаютсяневзаимодействующимиинеимеющимисоб- |
|||
койприродыреальногоиидеальногогазов:есливидеальномгазе |
|||
состоянияидеального.газаЭтоопределяетсяразличиемфизичес- |
|||
ствавгазообразнойижидкойфазахсильноотличаютсяотдиаграмм |
|||
Каквидноиз.рис2,.1.7диаграммысостоянияреальноговеще- |
|||
|
|
ческой.изохорой |
|
|
êð, |
|
|
,называетсякрити- |
ра,соответствующаяудельномуобъемуv=v |
||
êð |
|
|
|
справа–областьгазообразногосостояния(изохорыv>v.)Изохо- |
|||
êð |
|
|
|
отлиниинасыщениянаходитсяобластьжидкости(изохорыv<v), |
|||
|690 |
|
|6000 |
Углерод |
||||
|
|
|
|
|
|
|
|
151 |
|
1490 |
Ртуть |
||||
|
|
||||||
|
|
|
|
|
|
|
|
22,129 |
374,15 |
Âîäà |
|||||
|
|||||||
|
|
|
|
|
|
|
|
6,38 |
|
243,1 |
Этиловыйспирт |
||||
|
|
||||||
|
|
|
|
|
|
|
|
11,28 |
|
132,3 |
Аммиак |
||||
|
|
||||||
|
|
|
|
|
|
|
|
5,07 |
|
118,4– |
Кислород |
||||
|
|
||||||
|
|
|
|
|
|
|
|
7,412 |
|
31,04 |
Углекислота |
||||
|
|
||||||
|
|
|
|
|
|
|
|
3,39 |
|
147,0– |
Àçîò |
||||
|
|
||||||
|
|
|
|
|
|
|
|
1,29 |
|
239,9– |
Водород |
||||
|
|
||||||
|
|
|
|
|
|
|
|
0,228 |
|
267,9– |
Гелий |
||||
|
|
||||||
|
|
|
|
|
|
|
|
,ÌÏà |
êð |
P |
Ñ |
,θ |
êð |
T |
Вещество |
|
|
||||||
|
|
|
|
|
|
|
|
Критическиепараметрынекоторыхвеществ
Таблица1.1.7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
98 |
линияфазовогоперехода«жидкость–пар»(линия.насыщения)Слева |
||||||||||||||||||||||||
стваизображенынаPT-диаграмме,накоторуюнанесеныизохорыи |
||||||||||||||||||||||||
На.рис2.1.7областигазообразногоижидкогосостоянийвеще- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
ногоижидкогосостояний.вещества |
||||||||||||||
ВопытахЭндрюсабылаустановленанепрерывностьгазообраз- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
путемизотермического.сжатия |
||||||||||||
Присверхкритическихтемпературахгазнеможетбытьсжижен |
||||||||||||||||||||||||
|
|
|
|
|
T |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¹ |
©wv2 |
|
|
©wv¹ |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
.0 |
¸ |
|
|
|
¨ |
|
0 |
¸ |
|
|
¨ |
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
· |
|
§w |
|
|
êð |
P· |
|
§ |
|
|
|
|
|
|
|
|||
|
|
|
|
|
êð |
|
2 |
|
|
|
w |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
региб,.е.т |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
êð |
|
|
|
|
|
3)изотермаT=constимеетгоризонтальнуюкасательнуюипе- |
||||||||||||||||||||||||
|
|
|
2)обращаетсявнольитеплотапарообразованияr; |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
êð |
c |
|
|
|
s |
|
c |
|
|
s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
=v; |
v |
= |
=0èv |
v |
– |
1)v |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
тидвухфазногосостояния«жидкость–.пар»Вкритическойточке |
||||||||||||||||||||||||
киетемператураидавлениеявляютсямаксимальнымидляоблас- |
||||||||||||||||||||||||
рехода«жидкость–пар»,начинающейсявтройной.точкеКритичес- |
||||||||||||||||||||||||
Критическаяточкаявляетсяконечнойточкойлиниифазовогопе- |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.íèåì |
|
|
|
|
|
|
|
|
|
|
|
êð |
|
êð |
|
|
|
|
|
|
|
|
|
||
называетсякритическимсостоя- |
|
èT=T |
|
яниевеществаприP=P |
||||||||||||||||||||
êð |
|
|
êð |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
иT.Состо- |
ственнодавлениеитемпературавнейназываютсяP |
|||||||||||||||||||||||
жидкойигазовойфазами,называетсякритическойточкой,соответ- |
||||||||||||||||||||||||
Точканалиниинасыщения,вкоторойисчезаетразличиемежду |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
êð |
|
|
|
|
|
|
|
|
|
)этаразностьнестанетравной.нулю |
|
значимееT |
|||||||||||||||||
турыпродолжаетсядотехпор,покапринекоторойтемпературе(обо- |
||||||||||||||||||||||||
)сповышениемтемпера- |
v |
– |
s |
Процессуменьшенияразности(v |
||||||||||||||||||||
|
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ния)насыщенияуменьшаетсявеличинатеплотыпарообразованияr. |
||||||||||||||||||||||||
повышениемтемпературы(давле- |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.Ðèñ1.1.7 |
|
|
|
||
Исследованияпоказали,чтос |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
.уменьшается |
s |
èv |
c |
v |
v |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
||
участкаизотермымеждуточками |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
насыщения)длинагоризонтального |
|
|
t |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
шениемтемпературы(давления |
|
|
t |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
ничные.кривые)Каквидно,сповы- |
|
|
|
|
|
|
k |
|
|
|
|
|||||||||||||
изотермах–такназываемыепогра- |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
наразных |
s |
èv |
c |
рехода(значенияv |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
чалаиконцапроцессафазовогопе- |
|
|
|
|
1 |
|
k2 |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t>t>t |
|
|
|
|
|
||
Нарисункесоединеныточкина- |
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
