Белозеров В.И. Учебное пособие по курсу Техническая термодинамика (оригинал)
.pdf
Глава 5
ПРИМЕНЕНИЕ ОСНОВНЫХ ЗАКОНОВ ТЕРМОДИНАМИКИ
ÊИДЕАЛЬНЫМ ГАЗАМ
5.1.Идеальный газ. Уравнение состояния идеального газа
Идеальные газы – это такие газы, у которых отсутствуют силы сцепления между молекулами, а объем, занимаемый молекулами газа, по сравнению с объемом, в котором находится газ, пренебрежимо мал.
Во многих случаях, например, при высоких температурах и низких давлениях, когда расстояния между молекулами велики, можно принимать при расчетах реальные газы как идеальные.
Как было показано, уравнение состояния для 1 кг идеального газа имеет вид
|
|
|
|
Pv RT, |
(5.1.1) |
ãäå R |
k |
, |
Äæ |
; m – масса молекулы; k = 1.38 10-23 |
Äæ/ãðàä – |
|
êã ãðàä |
||||
|
m |
|
|
||
постоянная Больцмана.
Заменив в этом выражении удельный объем v = V/m, получим
PV mRT
– уравнение состояния идеального газа для произвольного количе- ства массы (m, кг). Многие расчеты упрощаются, если вести их не
на килограмм, а на киломоль (кмоль) газа.
Киломолем называется количество вещества, масса которого
численно равна (в кг) его мольной массе (32 кг О , 44 кг СО |
è ò.ä.): |
2 |
2 |
мольная масса P = nΠm (êã), |
|
ãäå nΠ – одинаковое для всех тел число, равное числу молекул в 1 кмоле. Объем молекулы не зависит от рода газа и определяется его давлением и температурой.
либо при наличии теплообмена, но при неизменной температуре среды T (изотермическое расширение или сжатие ИР при Т ):
0 |
0 |
LÈÐ S12ba1 ,
где S – площадь обратимого процесса. Часть работы, равная площади, неизбежно расходуется на вытеснение среды, следовательно,
Lmax S12c1.
полез
б). Тот же результат получается из уравнения (***). ИР обладает свойствами идеального тела, и температура в точках 1 и 2 равна
Т , следовательно, U = U . Второе слагаемое – количество тепла,
0 1 2
подведенное к источнику работы при постоянной температуре,
S > S ; поскольку тепло подводится, второе слагаемое положитель-
21
íîå (S |
), третье слагаемое отрицательное, ибо V > V |
(S |
). |
12ba1 |
2 |
1 |
añ2ba |
2). Предположим, что изолированная система состоит из источ- ника работы, обладающего свойствами идеального газа, и среды (рис. 4.5). Начальное состояние ИР характеризуется точкой 1 (P = = P , T ). Процесс идет до тех пор, пока не установится равновесие
01
âсистеме (точка 2), т.е. ИР находится в точке (Р , Т ). В системе с
0 0
единственным ИР процесс из точки 1 в точку 2 можно осуществить только при помощи обратимых процессов 1 o а – адиабатный и
а o 2 – изотермический.
Lmax
можно определить двумя путями – либо графическим, либо
полез
по формулам.
Система находится в механически равновесном, но термически
неравновесном состоянии при Т |
z Ò . |
|
|
|||
|
|
ÈÐ |
среды |
|
|
|
Единственно возможный об- |
|
|
|
|
||
ратимый переход из 1 в 2 – ади- |
|
|
|
|
||
абатное расширение и изотерми- |
P |
|
d |
|||
ческое сжатие. |
|
|
2 1 |
|||
|
|
|
|
|||
|
Sda2d S1da1 |
|
P |
|
|
|
|
S1a 21. |
0 |
|
|
|
|
max |
|
|
|
|
||
Lполез |
|
|
|
|
||
3). В начальном состоянии |
|
|
|
|
||
|
|
|
|
|
|
T = const |
система неравновесна и в тер- |
|
|
1 |
|||
|
|
|
|
|||
мическом, и в механическом от- |
|
a |
T = const |
|||
|
|
|
|
0 |
||
ношениях (рис. 4.6), т.е. Р , Т |
|
|
|
|
||
|
|
|
|
|||
11
(ИР)> Р ,Т (среды). |
b |
e |
c v |
00
Ðèñ. 4.5
64 |
61 |

63
етсядлякаждогореальногопроцесса.отдельно |
|||
|
ñèñò |
' |
|
–довольнонепростаязадача,котораяреша- |
S |
Определение |
|
|
|
|
|
тивностиработытепловых.установок |
|||
ниеСтодолы–Гюинаходитширокоеприменениеприанализеэффек- |
|||
менившегоэтоуравнениедлярешениятехнических.задачУравне- |
|||
нениев1889,.гисловацкоготеплотехника.АСтодолы,впервыепри- |
|||
нифранцузскогофизика.МГюи,которыйвпервыевывелэтоурав- |
|||
Уравнение(****)называютуравнениемГюи–Стодолыпоиме- |
|||
системыврезультатепротекающихвнейнеобратимых.процессов |
|||
|
|
|
¼ |
|
2 |
|
1 |
|
|
|
01 |
|
02 |
|
|
¬ |
ñèñò |
|
|
|
|
|
º |
|
|
|
|
|
|
|
|
ª |
'S |
|
|||||
–увеличениеэнтропии |
|
S |
S |
|
|
|
S |
|
S |
Â(****) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
ваюттакжеэнергетической.потерей |
|||||||||||||
Lиногданазы- |
' |
идляпотериработоспособности.теплаВеличину |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Этоуравнениеноситуниверсальныйхарактер–оносправедливо |
|||||||||||||||||||
|
|
ñèñò |
|
|
0 |
|
полез |
|
|
полез |
|
|
|
|
|
|
|||
(****) |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T'S |
|
|
L |
|
L |
|
'L |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
max |
|
|
|
|
|
|
Дляизолированнойсистемыпотеряработоспособности |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лезнаяработа.тепла |
||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
будетменьше,чеммаксимальнаяпо- |
|
.е.тполезнаяработатеплаQ |
|||||||||||||||||
TT
,Ê.Ö.ÎK Ê.Ö.HK
ларавна.нулюПринеобратимомцикле Еслитемпературыисточниковравны,тоработоспособностьтеп-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
62 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
полез |
|
|
|
|
|
|
|
|
|
|
|
. |
0 |
тембольше,чемменьше |
|
.å.ò |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lcmax |
|
||
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
¹ |
1 |
|
|
© |
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
, |
¸ |
|
1 |
¨ |
1 |
T |
1 |
полез |
|
|
|
||
|
|
|
|
0 |
|
Q |
Ê.Ö.Î |
Q |
max |
L |
|
|
|
||||
|
|
|
|
|
· |
|
§ |
|
K |
|
c |
|
|
|
|
||
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
||
Наибольший.д.п.куобратимогоциклаКарно,следовательно, |
|||||||||||||||||
|
|
|
|
наявработувцикле,тембольше,чемвыше.д.п.к |
|||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
циклможетбыть.полезнойИзвестно,чтодолятеплаQ,превращен- |
|||||||||||||||||
среданеподвергаетсясжатиюилирасширению,.е.твсяработаза |
|||||||||||||||||
объемРТвсовершениикруговогопроцессанеизменен,поэтому |
|||||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
чтоработоспособностьтепланезависитотдавлениясредыР,.к.т |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
,сообщаемойРТот.ГИВажноотметить, |
шаетсятолькозасчетQ |
||||||||||||||||
внутренняяэнергиянеизменяетсязацикл,поэтомуработасовер- |
|||||||||||||||||
Посколькурабочеетелосовершаетзамкнутыйпроцесс,тоего |
|||||||||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
ляетсяокружающаясредастемпературойТ |
|||||||||||
можетбытьполученазасчетэтоготеплаприусловии,чтоХИяв- |
|||||||||||||||||
полез |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
||
,которая |
|
|
,называетсятамаксимальнаяполезнаяработа |
ðîéÒ |
|||||||||||||
Lcmax |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Работоспособностьютепла,отбираемогоотГИстемперату- |
|||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нобольшойисточник,имеющийтемпературуТ. |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0 |
|
|
метрами(Р,Т),вкачествеГИобычнорассматриваетсябесконеч- |
|||||||||||||||||
ХИбудемрассматриватьсредуспрактическинеизменнымипара- |
|||||||||||||||||
ихолодного(ХИ))ирабочеготела,совершающего.циклВкачестве |
|||||||||||||||||
рассматриватьсостоящейиздвухисточниковтепла(горячего(ГИ) |
|||||||||||||||||
Когдаговоримобэтомпонятии,изолированнуюсистемуследует |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
тоспособность.тепла) |
||||
чениеимеетпонятиеомаксимальнойполезнойработетепла(рабо- |
|||||||||||||||||
Ещебольшеепрактическоезна- |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
0 |
0 |
|
|
.Ðèñ6.4 |
|
|
|
|
|
|
|
|
|
|
|
|
(Ð,Ò.) |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Т)ипараметрысреды |
(Ð, |
потока |
v |
|
|
0 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
на,еслизаданыпараметрыэтого |
|
|
a |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сергияпотокаоднозначноопределе- |
|
|
|
2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изуравненияследует,чтоэк- |
|
|
|
|
|
|
|
||||||||||
|
0 |
|
0 |
0 |
|
|
|
|
|
|
|
S=const |
|
|
|
||
S. |
S |
|
|
|
|
ex |
|
|
|
|
|
|
|
||||
|
hhT |
|
|
|
|
|
|
|
|
||||||||
сергиейиобозначаютex: |
|
|
1 |
|
|
|
|||||||||||
|
|
T |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
собностипотоканазываютегоэк- |
|
|
|
|
|
P |
|||||||||||
|
|
|
|
|
|
||||||||||||
Величинуудельнойработоспо- |
|
|
|
|
|
|
|
||||||||||

разделив на V, получим
n |
|
Uñì U1r1 U2r2 K Un rn ¦Ui ri . |
(5.3.3) |
i 1 |
|
Зная плотность смеси, можно определить ее удельный объем:
vñì |
1 |
1 |
. |
(5.3.4) |
|
Uñì |
|
n |
|||
|
|
||||
|
|
¦Ui ri |
|
|
|
|
|
|
i 1 |
|
|
Найдем плотность для случая, когда она задана массовыми до-
ëÿìè. Åñëè V m , V1
U
ñì
в (5.2.2), получаем
m
U
ñì
m1 |
, V |
m2 |
, V |
mn |
и т.д., то, подставляя |
||
U |
|
|
|||||
2 |
U |
2 |
n |
U |
n |
||
1 |
|
|
|
||||
m1 m2 m3 K mn .
U1 U2 U3 |
Un |
Разделим почленно на m:
|
1 |
|
|
g1 |
|
g2 |
|
|
g3 |
K |
gn |
, |
|
|
|
|
|
||||||||||||||||
|
Uñì |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
U1 |
|
|
U2 |
|
|
|
|
U3 |
|
|
|
|
|
|
|
Un |
|
|
|
|
|
||||||||||
следовательно, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uñì |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
. |
(5.3.5) |
|||||
|
|
g |
|
|
|
g |
|
|
|
g |
|
|
|
|
|
|
|
g |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
2 |
|
|
3 |
|
|
|
|
|
|
n |
|
|
|
n |
g |
|
|
|
|
||||||||
|
|
|
1 |
|
|
|
|
|
|
K |
|
|
|
|
|
¦ |
|
i |
|
|
|
||||||||||||
|
U |
|
U |
|
U |
|
|
|
U |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
2 |
3 |
|
|
n |
Ui |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i 1 |
|
||||||||||||||
Удельный объем смеси определяется как |
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
v |
|
|
|
1 |
|
|
|
|
n |
g |
i |
. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
Uñì |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
ñì |
|
|
|
|
¦i 1 Ui |
|
|
|
|
|
|
|
|
|
|
|
(5.3.6) |
|||||||||
Во многих случаях удобно задание газовой смеси по числу киломолей каждого газа смеси п , п ,…. Очевидно,
12
n1 n2 n3 K n, |
(5.3.7) |
где п – полное число киломолей газовой смеси.
Задание числовых значений п , п , … является заданием газовой
12
смеси по мольному составу.
Этим же свойством обладает и киломоль газа, содержащий одно и то же число молекул:
V |
kn |
T |
, |
(à) |
|
||||
Π |
Π P |
|
|
|
ãäå VΠ – объем киломоля газа.
Таким образом, а) число молекул в киломоле всех тел одинаково, определено из опыта и равно 6,064 1026 (число Авогадро); б) объем киломоля газа определяется его давлением и температурой и не зависит от рода газа.
С другой стороны, для киломоля газа с массой m кг, занимающего объем VΠ, имеем из (5.1.1)
PVΠ PRT ,
откуда
|
|
VΠ |
PR |
T |
. |
|
|
|
(b) |
||
|
|
|
|
||||||||
|
|
|
|
|
P |
|
|
|
|
||
Равенства (а) и (b) дают |
|
|
|
|
|
|
|
|
|
||
RΠ PR knΠ 1,38 1023 6,064 1026 |
8314 |
Äæ |
|
||||||||
|
, |
||||||||||
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
кмоль град |
|
откуда |
|
|
|
|
|
|
|
|
|
|
|
R |
RΠ |
8314 Äæ |
|
. |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
PP êã ãðàä
Таким образом, уравнение киломоля газа имеет вид
PVΠ 8314 T. |
(5.1.2) |
Из этого уравнения можно подсчитать объем киломоля газа при любых условиях; так, при Р = 101325 Па и t =0°С
|
|
3 |
|
VΠ 22,41 |
ì |
|
. |
|
|
||
|
|
кмоль
68 |
65 |
67 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
nn |
|
|
|
|
2 |
2 |
|
|
|
11 |
|
|
|
|
ñì |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
...ΥV |
ΥV |
|
ΥV |
|
V |
Υ |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ìàññ: |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
|
2 |
|
1 |
1 |
1 |
|
|
||
и.д.тПодставимв.2.(53)выражениядля |
|
ΥV |
|
|
m |
, |
ΥV |
m |
òîâ |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
ñì |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
||||||
амассыкомпонен- |
, |
V |
Υ |
m |
,томассасмеси |
|
|
|
Υ |
Поскольку |
||||||||||||||||||||||||||
m |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.долями |
|||
Найдемплотностьдляслучая,когдасмесьзаданаобъемными |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
.е.тсуммаобъемныхдолейравна.единице |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
i1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
i |
¦ |
|
n |
|
|
|
|
2 |
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|||||||||
.3.(52) |
|
|
|
r, |
|
|
Kr |
rr |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Разделив.2.(52)наV,получим |
|||||||||||||||||||||||
|
|
|
|
|
V |
n |
|
|
|
V |
|
2 |
|
|
|
V |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
. |
n |
|
|
;Kr |
2 |
|
|
|
r |
; |
1 |
|
|
r |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
V |
|
|
|
|
V |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
объемнуюдолюкомпонента,то |
Еслиобозначитьчерезr |
||||||||||||||||||||||||||||||||||
|
|
газа,входящеговсмесь,кобъемувсей.смеси |
||||||||||||||||||||||||||||||||||
Объемнойдолейназываетсяотношениепарциальногообъема |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
.е.тсуммамассовыхдолейравна.единице |
|||||||||||||||||||||||||||||
|
|
|
|
1 |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
i |
¦g |
n |
Kg |
3 |
g |
2 |
g |
|
1 |
|
1 |
|
|
|
|
|
|
|
|||||||||||||||
.3.(51) |
, |
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Разделив.2.(53)наm,получим |
|||||||||||||||||||||||
|
|
|
|
m |
|
|
n |
;Kg |
|
m |
|
|
2 |
|
; |
|
|
m |
|
1 |
|
|
|
|
|
|
|
|
|
|
||||||
|
. |
|
|
n |
|
|
2 |
|
|
|
|
g |
|
1 |
|
|
g |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
m |
|
|
|
|
|
|
m |
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
массовуюдолюкомпонента,то |
||||||||||||||||||||
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
входящеговсмесь,кмассевсей.смесиЕслиобозначимчерезg |
||||||||||||||||||||||||||||||||||||
ными.долямиМассовойдолейназываетсяотношениемассыгаза, |
||||||||||||||||||||||||||||||||||||
Составгазовойсмесиможетбытьзаданмассовымиилиобъем- |
||||||||||||||||||||||||||||||||||||
|
.3.5Методызаданиягазовойсмеси |
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||
–массасоставляющих.газов |
гдеm–массасмеси;m,m,,…m |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
n |
K |
2 |
|
|
|
1 |
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
||||||||
.2.(53) |
|
|
|
, |
|
m |
m |
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
66
щихгазов: Очевидно,чтомассасмесибудетравнасуммемасссоставляю- .объемов Следовательно,объемгазовойсмесиравенсуммепарциальных
|
|
|
n |
2 |
1 |
|
–парциальные.объемы |
,…V |
гдеV–объемсмеси;V,V, |
||
|
i1 |
|
|
|
|
|
i |
n |
2 |
1 |
V |
.2.(52) |
¦V, |
VKV |
V |
||
|
n |
|
|
|
|
|
ПоаналогиисзакономДальтонаможнонаписать,что |
||||
|
называютсяпарциальнымиили.приведенными |
||||
давлениекаждогогазабудетравнодавлению.смесиТакиеобъемы |
|||||
21
каждаячастьгазабудетзаниматьобъемыV,Vи;.д.тприэтом Составныечастивзятойсмесиможномысленноразбитьтак,что
n2 1
–парциальные.давления |
,P,,…P |
гдеР–давлениесмеси;P |
|||
|
i1 |
|
|
|
|
|
i |
n |
2 |
1 |
P |
.2.(51) |
¦P, |
PP...P |
|||
|
n |
|
|
|
|
|
|
равносуммепарциальныхдавлений,.е.т |
|||
ЗаконДальтонаустанавливает,чтообщеедавлениегазовойсмеси |
|||||
|
|
|
|
|
.парциальными |
21
одногогазабудетравноР,адругогоР.Этидавленияиявляются нималполныйобъемV,которыйзанималасмесь;приэтомдавление частивзятойсмесимысленноразобьемтак,чтобыкаждыйгаззаоднородныхгазовбудетоднаитаже;обозначимееТ.Составные щаясявобъемеVпридавленииР.Температуракаксмеси,таки Пустьданасмесь,состоящаяиздвухидеальныхгазовинаходявхимическоевзаимодействиедругс.другом приэтомсчитается,чтогазыявляютсяидеальнымииневступают Газоваясмесьподчиняетсятемжезаконам,чтоиоднородныегазы; стенкисосудасвоедавление,котороеназываетсяпарциальным. симоотдругихгазов,занимаетполныйобъемсмесииоказываетна компонентами.Каждыйгаз,входящийвсмесь,ведетсебянезависгораниятопливаи.п.тГазы,составляющиесмесь,называются однородныегазы,такисмесигазов,например,воздух,продукты Втепловыхдвигателяхвкачестверабочихтелприменяютсякак
.2.5Газовые.смесиЗаконДальтона

В зависимости от выбранной количественной единицы вещества различают
• массовую теплоемкость, отнесенную к 1 кг массы; она обозна-
ª |
Äæ º |
|
чается буквой C и имеет размерность « |
|
» ; |
|
||
¬ |
êã ãðàä ¼ |
|
• объемную теплоемкость, отнесенную к 1 м3 газа при нормальных физических условиях, обозначаемую Сcи имеющую размерность
ª |
|
Äæ º |
|
« |
|
|
» ; |
3 |
|
||
¬ |
ì |
ãðàä ¼ |
|
• мольную теплоемкость, отнесенную к 1 кмолю газа; она обо-
ª |
Äæ |
º |
значается PС и имеет размерность « |
|
» . |
|
||
¬ |
кмоль град ¼ |
|
Из определения теплоемкости следует, что количество тепла Q, |
||
которое нужно сообщить массе m, кг или объему V , м3 (приведен-
0
m
ному к нормальным физическим условиям), или числу киломолей ,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
чтобы повысить температуру газа от t |
до t градусов, можно под- |
|||||||||||||
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
считать по формуле |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q Cm t |
|
t |
|
CcV |
t |
|
t |
|
PC |
m |
t |
|
t |
, Äæ, (5.4.1) |
|
|
P |
|
|||||||||||
|
2 |
1 |
|
0 |
|
2 |
1 |
|
|
|
2 |
1 |
|
|
где C, C c, PC – соответственно массовая, объемная и мольная теплоемкости.
Массовая, объемная и мольная теплоемкости связаны между собой следующими зависимостями:
|
C |
|
PC |
, |
|
Äæ |
|
; P |
ª |
|
êã |
º |
; |
|
|
||||||
|
|
|
|
|
|
|
|
|
« |
|
|
|
» |
|
(5.4.2) |
||||||
|
|
P |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
êã ãðàä |
|
|
¬кмоль¼ |
|
|
|
|||||||||||
Cc |
PC |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
, |
|
Äæ |
; |
V |
|
22, 41 |
|
|
ì |
; |
(5.4.3) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
22, 41 ì3 ãðàä |
|
|
Π |
|
|
|
|
кмоль |
|
|
|||||||||||
Cc |
UC, |
|
|
|
Äæ |
|
; U |
ª |
êã |
º. |
|
|
|
|
(5.4.4) |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
3 |
ãðàä |
|
|
« |
3 |
» |
|
|
|
|
|
||||
|
|
|
|
|
|
ì |
|
|
¬ |
ì |
¼ |
|
|
|
|
|
|||||
Если выражение (5.3.7) разделить на п, то получится задание газовой смеси по относительному мольному составу, но
n |
|
n |
V |
||
1 |
1 |
|
Π |
||
|
|
|
|
|
, |
n |
|
n VΠ |
|||
ãäå VΠ – объем 1 кмоля газа при параметрах смеси, поэтому n1VΠ V1, nVΠ V ,
тогда |
|
|
|
|
|
|
n1 |
V1 |
r1 |
, |
|
|
n |
|
V |
||
|
|
|
|
||
т.е. относительный мольный состав газовой смеси совпадает с ее относительным объемным составом.
Расчет Π и R для газовой смеси
ñì
Пусть газовая смесь задана по мольному составу, т.е. известны значения п , п ,…. Полное число молей смеси
12
n1 n2 n3 K n,
а масса смеси
n1P1 n2P2 n3P3 K m . |
(à) |
|||||
Мольная масса газовой смеси |
|
|
|
|
|
|
|
Pñì |
m |
, |
|
|
|
|
|
|
|
|
||
|
n |
|
|
|
||
|
|
|
|
|
|
|
ò.å. |
|
|
|
|
|
|
Pñì |
n1P1 n2P2 |
n3P3 |
K |
|
||
|
|
|
|
. |
(5.3.8) |
|
|
n |
|
||||
|
|
|
|
|
||
Переход к расчету P при задании смеси по объемному составу
ñì
можно сделать путем почленного деления выражения (а) на п:
|
|
P |
|
n1 |
P |
n2 |
P |
|
K. |
||||
|
|
|
|
|
|
|
|||||||
|
|
ñì |
|
n |
1 |
|
n |
2 |
|
||||
Как указывалось |
n1 |
r |
, |
|
n2 |
|
r |
,K, поэтому |
|||||
|
|
|
|
|
|||||||||
|
n |
1 |
|
|
n |
|
2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
72 |
69 |
71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.емкостью |
дальнейшембудемназыватьудельнуютеплоемкостьпростотепло- |
|||||||||||||||||||||||
.дусТакуютеплоемкостьназываютудельной.теплоемкостьюВ |
|||||||||||||||||||||||
него),чтобыповысить(илипонизить)еготемпературунаодингра- |
|||||||||||||||||||||||
обходимоподвестикединицеколичествавещества(илиотвестиот |
|||||||||||||||||||||||
Теплоемкостьюназываетсятоколичествотеплоты,котороене- |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
знать.теплоемкость |
||||
рабочеетеловпроцессенагреванияилиохлаждения,необходимо |
|||||||||||||||||||||||
Дляопределенияколичестватепла,котороеполучаетилиотдает |
|||||||||||||||||||||||
|
.4.5Теплоемкость |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
i |
P |
|
|
|
|
1 |
i |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
¦ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
i |
g |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
. |
|
|
|
|
|
|
|
n |
|
|
|
i |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
i |
P |
|
|
|
|
|
r |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
i |
g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
апереходотмассовыхдолейкобъемным–поформуле |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
¦rP |
|
|
|
|
|
|
|
|
|
|
|||||
|
, |
|
|
|
|
|
|
|
n |
|
|
i |
g |
|
|
|
|
|
|||||
|
|
|
|
i |
|
i |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
rP |
|
|
|
|
|
|
|
|
|
|
|
||
реходотобъемныхдолейкмассовымпроизводитсяпоформуле |
|||||||||||||||||||||||
мулывзаимногопереходаотодногосоставасмесик.другомуПе- |
|||||||||||||||||||||||
Исключаявсематематическиепреобразования,приведемфор- |
|||||||||||||||||||||||
|
|
|
|
cì |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
. |
|
|
R |
|
i |
|
|
|
|
|
i |
|
|
|
|
|
|
|
|||
.3.(514) |
|
i |
|
|
|
|
|
Pg |
|
|
P |
|
|
|
|
|
|||||||
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
компонентанауравнениесостояниясмеси,получаем |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
гдеn–числомолейкомпонента;или,деляуравнениесостояниядля |
|||||||||||||||||||||||
|
|
n |
|
|
|
|
i |
|
|
|
|
V |
i |
|
|
|
|
||||||
.3.(513) |
, |
i |
|
P |
|
|
|
|
|
Pr |
|
|
i |
|
P |
P |
|
|
|
|
|||
|
|
n |
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|||||
i |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
ПозаконуМариотта–БойляможнозаписатьPV=PV,откуда |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ïðèv=.const |
T |
p |
Шарля |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ïðèP=const; |
|
|
|
T |
|
|
v |
Гей–Люссака |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
v |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ныдавлениям; |
|
стояннойтемпературе,тоудельныеобъемыобратнопропорциональ- |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
|
||||
–еслиизменениепроисходитприпо- |
|
|
p |
|
|
|
|
|
v |
|
Бойля–Мариотта |
|||||||||||||||||||||||||||||
2 |
|
|
|
|
|
1 |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|
v |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вспомнимгазовыезаконы: |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отспособазадания.смеси |
|||||||||||
Рассмотримопределениепарциальныхдавленийвзависимости |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
i |
i |
|
1 |
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ñì |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
¦gR. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
.3.(512) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
ñì |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
илипоформуле |
|
P |
послепредварительногоопределения |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ê |
|
кмоль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ñì |
|
ñì |
|
|
|
|
|
|
|
||||||||
.3.(511) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8314 |
|
|
|
|
|
|
R |
|
P |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Äæ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отношению |
Величинагазовойпостояннойдлясмесиподсчитываетсяпосо- |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
n |
P |
|
|
|
|
|
2 |
P |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
n |
g |
2 |
g |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
ñì |
|
|
|
|
|
|
|
|||||||||
.3.(510) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
Делячислительизнаменательна |
||||||||||||||||||||||||||
|
,получим |
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
n |
P |
|
|
|
|
|
|
2 |
P |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
n |
|
|
|
2 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
m |
|
|
|
m |
|
|
|
|
|
ñì |
|
|
|
|
|
|
||||||||
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
P |
|
|
|
|
|
|
1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
,n |
P |
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
и,.д.ттогда |
|
2 |
|
|
|
|
|
|
1 |
n |
учтем,что |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
m |
|
|
||
|
|
|
|
n |
|
|
|
|
|
2 |
|
|
1 |
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
Kn |
|
n |
|
n |
|
|
|
|
|
ñì |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Еслисмесьзаданапомассовомусоставу,тодляподсчета |
||||||||||||||||||||||||||||||||||||||||
|
|
n |
|
n |
|
|
|
|
|
2 |
2 |
|
|
1 |
1 |
|
|
|
|
|
ñì |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
||||||||||||||||||
.3.(59) |
. |
|
KrP |
|
rPrP |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Если считать теплоемкости C и C постоянными, то
Pv
qP CP T2 T1 è qv |
Cv T2 T1 , |
|
||
следовательно, |
|
|
|
|
qP qv CP T2 T1 Cv T2 T1 P v2 v1 . |
(5.6.3) |
|||
Из уравнения состояния |
|
|
|
|
pv = RT è pv |
= RT , |
|
||
1 |
1 |
2 |
2 |
|
откуда |
|
|
|
|
R T2 |
T1 |
P v2 v1 . |
(5.6.4) |
|
Учитывая (5.6.3), можно записать |
|
|
||
CP T2 T1 Cv T2 T1 R T2 T1 |
|
|||
èëè |
|
|
|
|
|
CP |
Cv |
R. |
(5.6.5) |
|
|
|
|
|
Уравнение (5.6.5) называется уравнением Майера.
Сравнивая (5.6.1) и (5.6.5), находим, что удельная газовая постоянная представляет собой работу, совершаемую 1 кг газа при изменении температуры на 1°С в процессе при постоянном давлении.
Если (5.6.5) умножить на молекулярную массу Π, то получим зависимость между мольными теплоемкостями
|
|
|
|
|
|
ΠCP ΠCv |
ΠR, |
(5.6.6) |
|
|
|
|
|
|
|
|
|
ãäå ΠR 8314 |
Äæ |
. |
|
|
||||
|
|
|
||||||
кмоль К |
|
|
||||||
|
|
|
|
|
|
|
|
|
 |
термодинамике часто используется соотношение |
|||||||
|
CP |
|
ΠCP |
k, называемое показателем адиабаты. |
|
|||
|
Cv |
ΠCv |
|
|||||
|
|
|
|
|
|
|||
При проведении расчетов, связанных с идеальными газами, зна- чение мольных теплоемкостей часто принимают на основании данных молекулярно-кинетической теории газов. По этой теории мольные теплоемкости идеальных газов не зависят от температуры, а являются функцией только их атомности (табл. 5.6.1). Для реальных газов величина k зависит от температуры и давления.
5.5. Зависимость теплоемкости от температуры.
Истинная и средняя теплоемкости
Теплоемкость идеальных газов зависит от следующих факторов: от физических свойств газов, от условий, при которых протекает процесс изменения состояния, и от температуры. Теплоемкость реальных газов зависит, кроме того, и от давления.
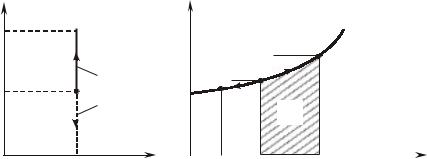
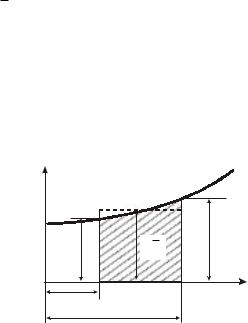
Рассмотрим зависимость теплоемкости от температуры. Опыты показывают, что количество тепла, затрачиваемого на нагревание единицы количества газа на одинаковое число градусов при различ- ных температурах, различно. Так, например, для нагревания единицы количества вещества от 0 до 100°С требуется одно количество тепла, а для нагревания от 100 до 200°С – другое, обычно больше первого. Это значит, что теплоемкости для интервалов различных температур неодинаковы.
Зависимость теплоемкости от температуры можно выразить графически (рис. 5.5.1).
Различают среднюю и истинную теплоемкости.
Средней теплоемкостью C называется отношение теплоты q, подведенной или отведенной в процессе, к изменению температуры (t – t ) при условии, что разность температур является конечной ве-
21
личиной.
Допустим, что для нагревания 1 кг газа затрачено q Дж тепла, при
этом температура газа повысилась от t до t , тогда средняя тепло-
1 |
2 |
емкость в интервале температур от t до t |
определится из уравне- |
1 |
2 |
íèÿ
|
|
|
t2 |
|
q |
, |
Äæ |
. (5.5.1) |
|
C |
|
||||||||
t1 |
t2 |
t1 |
êã ãðàä |
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
||||
Если разность температур (t – t ) бесконечно мала и в
21
пределе стремится к нулю, то получаем истинную теплоемкость, которую можем записать так:
C |
|
|
1χ |
|
2 |
|
|
|
1 |
|
2χ |
|
|
|
Oχ |
|
|
|
|
C |
|
C |
2 |
C |
|
|
|
|
|
1 |
|
|
O |
|
|
a |
|
b |
|
|
t |
t |
|
|
1 |
t |
|
|
|
|
|
2 |
|
|
Ðèñ. 5.5.1 |
|
76 |
73 |