
- •Минобрнауки россии
- •1. Литературная часть
- •1.1Колориметрические методы
- •1.1.1 Буферный метод
- •1.1.2 Безбуферный метод
- •1.1.3 Недостатки колориметрических методов.
- •1.2 Потенциометрические методы.
- •1.2.1 Нормальный элемент Вестона
- •1.2.2 Электроды сравнения
- •1.2.2.1 Водородный электрод
- •1.2.2.2 Каломельный электрод
- •1.2.2.3 Хлореребрянный электрод
- •1.2.2.4 Индикаторные электроды
- •1.2.3 Преимущества и недостатки различных потенциометрических методов определения pH
- •2. Экспериментальная часть
- •2.2 Методика определения pH буферных раствор.
- •3. Обсуждение результатов
- •3.2 Определение pH c использованием двойной хингидронной цепи.
- •3.3 Определение pH при помощи стеклянного электрода.
2.2 Методика определения pH буферных раствор.
Хингидронно – каломельная цепь. Для составления хингидроннокаломельной цепи к исследуемому раствору прибавляют на кончике перочинного ножа хингидрон, размешивают и опускают в раствор неплатинированный платиновый электрод.[3] Исследуемый раствор посредством солевого мостика с насыщенным раствором КСl соединяют с каломельным электродом (см. рис 10).
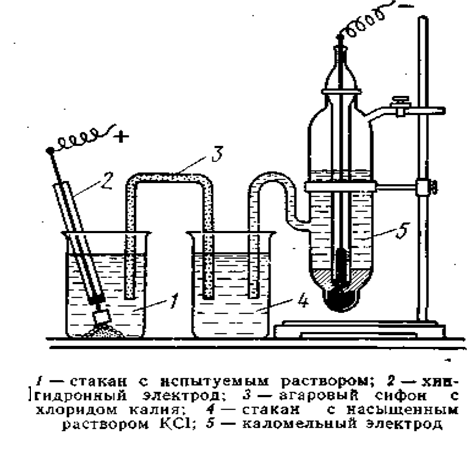
Рис.10.Схема хингидронно-каломельной гальванической цепи.
Схематически эта цепь изображается следующим образом:
![]()
В ней положительным является хингидронный электрод, а отрицательным — каломельный. Э.д.с. цепи
E=φхг – φкал. Подставив в формулу значения электродных потенциалов хингидронного и каломельного электродов, после соответствующих преобразований, получим следующую формулу для определения pH^
pH= (φхг0 – φкал-Ех)/(2,303* (RT)/F) = (φхг0 – φкал-Ех)/(0,0002T)
Электродный потенциал каломельного электрода :
φкал = φкал0 – (RT/F) * la aCl-.
Нормальный потенциал хингидронного электрода в зависимости от температуры определяется по формуле :
φхг0 = 0,6992 – 0,00074 (t-25)
Двойная хингидронная цепь. [4]
Рис.
11. двойная хингидронная цепь
Для определения pH так же применяют двойную хингидронную цепь, т.е. цепь состоящую из двух хингидронных электродов. Один из них содержит раствор с известным pH и является поэтому электродом сравнения. На рис. Представлена двойная хингидронная цепь . Эту цепь можно записать как:
-Pt|хг,H+(ax)|KCl|H+(aст), хг|Pt+
Рассматриваемая цепь является концентрационной, так как ее электроды отличаются только концентрацией ионов водорода. Двойная хингидронная цепь составляется следующим образом: в один стакан наливают раствор, pH которого известен (pHст). В другой стакан наливают исследуемый буферный раствор (pHx). В оба стакана добавляют хингидрон и вставляют платиновые электроды. В целях устранения диффузионного потенциала цепь соединяют через агар-агаровый мостик с насыщенным раствором KCl.
Знаки элетродов в выше приведенном рисунке казаны для случая, если аст>ах. Если это не выполняется знаки зяряда электрода будут обратными. Значение э.д.с. указанной двойной хингидронной цепи равна E=φхг(ст) – φхг
Подставляя в это уравнение значение потенциалов хингидронных электродов, получим
E= φхг0+ (2.303RT)/F* lgaст - φхг0 – (2.303RT)/F* lgax = (2.303RT)/F*lg (aст/ax) =2*10-4T pHст – 2*10-4T pHx
Отсюда pHx=E/(2*10-4T) + pHст
Учитывая, что в качестве стандартного раствора берется раствор Вейбеля, уравнение примет следующий вид:
pHx=E/(2*10-4T) +2,04
При исследовании растворов, в которых активность ионов H+ больше таковой в растворе электрода сравнения, следовательно ах>аст . Э.д.с. цепи равна:
E=φхг – φхг(cт) = 2*10-4T lg ax/aст=2*10-4T pHст – 2*10-4T pHx
Отсюда: pHx= pHст - E/ (2*10-4T)= 2.04 – E/ (2*10-4T)
Для определения pH измеряется э.д.с. двойной хингидронной цепи компенсационным методом, с помощью потенциометра. pH вычисляют пользуясь соответственно формулами в зависимости от типа гальванической цепи.
Стеклянный электрод. [4]

Рис.12 Схема электродной системы: 1-стеклянный электрод; 2-внутренний электрод ; 3-проточный хлорсеребряный электрод сравнения; 4-электролитический контакт ; 5-насыщенный раствор KCl; 6-пористая перегородка; 7-винт; 8-провода для подключения электродной ячейки к pH-метру.
При проведении измерений со стеклянным электродом чаще сего используют pH- метр. Прибор предназначен для определения pH от7 до 14. в качестве датчиков э.д.с. используется датчик, состоящий из измерительного стеклянного и вспомогательного хлорсеребряного электродов. Для измерения pH стеклянный электрод помещают в исследуемый раствор. Последний соединяют при помощи электролитического мостика с электродом сравнения – хлорсеребряный. Получают цепь . Схема которой можно записать следующим образом:
Ag| AgCl, HCl (0,1H) | стеклянная мемб | исслед. Раст. | KCl, AgCl|Ag
внутренний электрод электрод сравнения
В этой цепи φ1 – потенциал внутреннего хлорсеребряного электрода в 0,1 Н HCl, φ2 – потенциал на границе стеклянная мембрана – 0,1 Н HCl, φ3 – потенциал на границе стеклянная мембрана исследуемый раствор, φ4 – диффузионный потенциал на границе этого раствора и раствора KCl, φ5 – потенциал хлорсеребряного электрода сравнения. Потенциалы φ1, φ2, φ5 – постоянны, φ4 - можно пренебречь, в виду его малого значения, а потенциал φ3 зависит от активности ионов водорода в растворе. Э.д.с. этой цепи будет изменятся с изменение потенциала φ3 , следовательно, и с изменением pH. [4]
При изменении pH с помощью стеклянного электрода мы использовали pH- МЕТР pH-150 МИ.
Рис. 13 pH- МЕТР pH-150 МИ.
