
- •Минобрнауки россии
- •1. Литературная часть
- •1.1Колориметрические методы
- •1.1.1 Буферный метод
- •1.1.2 Безбуферный метод
- •1.1.3 Недостатки колориметрических методов.
- •1.2 Потенциометрические методы.
- •1.2.1 Нормальный элемент Вестона
- •1.2.2 Электроды сравнения
- •1.2.2.1 Водородный электрод
- •1.2.2.2 Каломельный электрод
- •1.2.2.3 Хлореребрянный электрод
- •1.2.2.4 Индикаторные электроды
- •1.2.3 Преимущества и недостатки различных потенциометрических методов определения pH
- •2. Экспериментальная часть
- •2.2 Методика определения pH буферных раствор.
- •3. Обсуждение результатов
- •3.2 Определение pH c использованием двойной хингидронной цепи.
- •3.3 Определение pH при помощи стеклянного электрода.
1.2.1 Нормальный элемент Вестона
В качестве элемента с известной ЭДС используют нормальный элемент Вестона (рис. 4). Положительный электрод элемента содержит металлическую ртуть. Над ней помещается слой пасты из ртути и сернокислой закиси ртути Hg2SO4, сверху – насыщенный раствор сернокислого кадмия. В состав отрицательного электрода входит амальгама кадмия, в которой содержание кадмия постоянно и составляет 12,5%.

Рис.4. Нормальный элемент Вестона
Над амальгамой находится насыщенный раствор серно-кислого кадмия.
Электрод, содержащий более активный (легко окисляющийся) металл, заряжен отрицательно по отношению к электроду, содержащему менее активный металл. Этим объясняется тот факт, что в нормальном элементе электрод, содержащий кадмий, заряжен отрицательно, а электрод, содержащий ртуть – положительно.
Источником электрической энергии нормального элемента является реакция: Cd + Hg22+ <—> Cd2+ + 2Hg.
Электродвижущая сила нормального элемента при 20оС равна 1,0183 В.
В процессе работы нормальный элемент нужно замыкать только на короткое время. При использовании нормального элемента таким образом он сохраняет постоянное значение ЭДС и может служит долгое время [6].
1.2.2 Электроды сравнения
Для многих электроаналитических методов желательно иметь полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел бы от состава изучаемого раствора. Электрод, удовлетворяющий этим требованиям называется электродом сравнения.
Электрод сравнения должен быть прост в изготовлении и должен сохранять практически постоянный и воспроизводимый потенциал при прохождении небольших токов. Этим требованиям удовлетворяют электроды различных систем.
1.2.2.1 Водородный электрод
Водородный электрод представляет платиновую проволоку или пластинку, опущенную в раствор. Содержащий ионы водорода. Платина не принимает участия в электродных процессах возникновения потенциала. Ее роль сводится лишь к тому, что она поглощает водород и, будучи проводником, делает возможным перемещения электронов от одного электрода к другом [3].
На поверхности электрода устанавливаются равновесие
H2 ⇌2H ⇌2H+2e-
В результате этих процессов на границе между платиной и раствором ионов водорода образуется двойной электрический слой, обуславливающий скачок потенциала. Величина этого потенциала при данной температуре зависит от активности водородных ионов в растворе и от количества поглощенного платиной газообразного водорода, которое пропорционально его давлению:
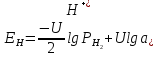 (14)
(14)
где
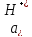 – активность ионов водорода в растворе;
– активность ионов водорода в растворе;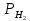 – давление, под которым поступает
газообразный водород;U=2.303
– давление, под которым поступает
газообразный водород;U=2.303
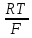
Исследования показывают, что чем боьше давление для насыщения платины водородом, чем более отрицательное значение принимает потенциал водородного электрода.
Нормальным водородным электродом называется электрод, состоящий из платины, насыщенной водородом под давлением 1 атм и погруженной в раствор с активностью ионов водорода, равной единице. По международному соглашению потенциал нормального водородного электрода условно принят равным нулю, с этим электродом сопоставляют потенциалы всех электродов.
При Здесь = 1 атм выражение для потенциала водородного электрода удет иметь вид:
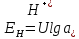 (15)
(15)
или
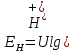 (16)
(16)
Это уравнение справедливо для разбавлденных растворов.При насыщении водородного электрода водородом под давлением в 1 атм, потенциал его зависит только от концентрации ионов водорода в растворе. В связи с этим водородный электрод может применятся не только как электрод сравнения, но и как индикаторный электрод, потенциал которого находится в прямой зависимости от присутствия ионов водорода в растворе [4].
Приготовление водородного электрода представляет значительные трудности. Нелегко добиться того, чтобы давление газообразного водорода при насыщении им платины равнялось 1 атм ровно. Кроме того, газообразный водород должен поступать со строго постоянной скоростью. Необходимо применить совершенно чистый водород, т.к. уже весьма малые количества некоторых примесей, особенно H2S и H3As, «отравляют» поверхность платины, и тем самым припятствуют установлению равновесия H2⇌2H++2e=. Получение водорода высокой степени чистоты связано со значительным усложениние аппаратуры и процесса работы, поэтому на практике чаще применяются другие более простые электроды сравнения.
Существуют различные конструкции сосудов для создания водородного электрода (рис 5) [3].
 Рис.5.
Водородные электроды
Рис.5.
Водородные электроды
