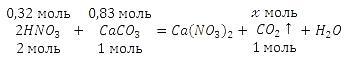- •Спецификация теста по химии 9 класса по теме « Углерод » Составлена на основе рабочей программы по химии под редакцией о.С.Габриелян
- •Структура проверочной работы.
- •Распределение заданий по видам проверяемых умений и способам действий.
- •Продолжительность выполнения теста по химии
- •Система оценивания выполнения отдельных заданий и тестовой работы в целом.
- •Критерии оценивания заданий
- •Элементы ответа части с
- •Количество баллов
- •Инструкция по выполнению работы.
Критерии оценивания заданий
|
Часть |
Содержание критериев |
Балл |
|
А |
правильно указанный ответ |
1 |
|
|
неправильно указанный ответ |
0 |
|
В |
ответ не содержит ошибок |
2 |
|
|
ответ содержит несколько вариантов, один из которых правильный |
1 |
|
|
неправильный ответ |
0 |
|
С |
ответ правильный и полный, содержит все названные элементы |
4 |
|
|
правильно записаны три первых элемента из названных выше |
3 |
|
|
правильно записаны два из названных выше элементов |
2 |
|
|
правильно записаны один из названных выше элементов |
1 |
|
|
все элементы ответа записаны неверно |
0 |
Элементы ответа части с
1) Составлено уравнение реакции.
2) Вычислено, сколько азотной кислоты (HNO3) (в граммах) содержится в 200 грамм 10-процентного раствора азотной кислоты (HNO3) по формуле
3) Найдено химическое количество данных веществ .
4) Вычислен объем углекислого газа (CO2), который выделяется в ходе реакции по формуле, устанавливающей связь между химическим количеством вещества и объемом
Количество баллов
|
Количество баллов |
Менее 5 |
6-8 |
8-10 |
10-12 |
|
Отметка |
2 |
3 |
4 |
5 |
Норма выполнения базового уровня 65%
Инструкция по выполнению работы.
На выполнение работы отводится 15 минут. Работа состоит из
3 частей, включающих в себя 7 заданий.
При выполнении работы Вы можете пользоваться Периодической
системой химических элементов Д.И. Менделеева, таблицей растворимости
солей, кислот и оснований в воде, электрохимическим рядом напряжений
металлов и непрограммируемым калькулятором.
При выполнении заданий Вы можете пользоваться черновиком.
Советуем выполнять задания в том порядке, в котором они даны. Для
экономии времени пропускайте задание, которое не удаётся выполнить сразу,
и переходите к следующему. Если после выполнения всей работы у Вас
останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются.
Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Часть А содержит 4 задания (А1–А4). К каждому заданию даётся
четыре варианта ответа, из которых только один верный. При выполнении
задания части А. Обведите кружком номер выбранного ответа в
тестовой работе. Если Вы обвели не тот номер, то зачеркните
обведённый номер крестиком, а затем обведите номер нового ответа.
|
А1. Электронная конфигурация атома углерода. А) 1S2 2S2 2P6 3S2 3P2 Б) 1S2 2S2 2P4 В) 1S2 2S2 Г) 1S2 2S2 2P2
|
|
А2.Углерод НЕ может проявлять степень окисления
А) -4 Б) +6 В) +2 Г) 0 |
|
|
|
А3.Аллотропным видоизменением углерода НЕ является
А) карбин Б) алмаз В) карбид Г) графит
|
|
А4. Схема диссоциации угольной кислоты по второй ступени А) H 2 СО 3 = 2H+ + CO 3 2- Б) HCO 3 - = H+ + CO 3 2- В) H 2 CO 3 = H+ + 2CO 32- Г) H 3CO 3 = H 2O + CO 2
Часть В состоит из 2 заданий (В1–В2), на которые нужно дать краткий ответ в виде набора цифр. Для заданий части 2 ответ записывается в тестовой работе в отведённом для этого месте. В случае записи неверного ответа зачеркните его и запишите рядом новый.
|
|
В1. Вещество, с помощью которого распознают карбонаты.
|
|
В2. Установите соответствие между газом и его применением
ГАЗ ПРИМЕНЕНИЕ
1) СО А)Топливо 2) СО2 Б) "Сухой" лед В)Газированная вода Г) Восстановитель в металлургической промышленности Д) Огнетушители
|
|
Часть С включает в себя 1 задание (С1), выполнение которого предполагает написание полного, развёрнутого ответа, включающего необходимые уравнения реакций и расчёты Ответы на задания части С записываются на отдельном листе.
|
|
С1. Объем выделившегося углекислого газа (CO2),который понадобится при действии 200 г 10% раствора азотной кислоты (HNO3) на 90 г мела, содержащего 8% нерастворимых в кислоте примесей? |
Таблица правильных ответов части А,В,С
|
№ Задания |
Ответ |
№ Задания |
Ответ |
|
А1 |
Г |
В1 |
Соляная кислота |
|
А2 |
Б |
В2 |
1-А,Г; 2-Б,В,Д |
|
А3 |
В |
|
|
|
А4 |
Б |
|
|
|
Решения задачи части С Запишем уравнение реакции выделить углекислый газ (CO2):
Вычислим, сколько азотной кислоты (HNO3) (в граммах) содержится в 200 грамм 10-процентного раствора азотной кислоты (HNO3) по формуле:
m (HNO3) = 200 г ⋅ 0,1 = 20 (г). Если раствор 10-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,1. Учитывая,
что мел содержит 8% примесей, следовательно,
в состав мела входит 92% (0,92) карбоната
кальция (CaCO3).
Вычислим, сколько карбоната кальция
(CaCO3)
(в граммах) содержится в 90 грамм мела
по формуле:
m (CaCO3) = 90 г ⋅ 0,92 = 82,8 (г). Учитывая, что молярные массы азотной кислоты (HNO3) и карбоната кальция (CaCO3) соответственно равны 63 и 100 г/моль (смотри таблицу Менделеева), найдем химическое количество данных веществ по формуле:
Получаем: n (HNO3) = 20 г / 63 г/моль = 0,32 (моль), n (CaCO3) = 82,8 г / 100 г/моль = 0,83 (моль). По уравнению реакции определим, какое вещество находится в избытке, а какое в недостатке. Напомню, расчет следует вести по недостатку.
Из уравнения реакции следует, что на 1 моль карбоната кальция (CaCO3) требуется в 2 раза больше азотной кислоты (HNO3), то есть на 0,83 моль карбоната кальция (CaCO3) необходимо 1,66 азотной кислоты (HNO3), следовательно, 0,32 моль недостаточно для 0,83 карбоната кальция (CaCO3), который взят в избытке и прореагирует не полностью. Так как карбонат кальция (CaCO3) взят в избытке, расчет следует вести по числу молей азотной кислоты (HNO3). Составим соотношение: 2 моль HNO3 надо, чтобы выделить углекислый газ 1 моль 0,32 моль HNO3 надо, чтобы выделить углекислый газ х моль Откуда:
Вычислим объем углекислого газа (CO2), который выделяется в ходе реакции по формуле, устанавливающей связь между химическим количеством вещества и объемом:
V (CO2) = 0,16 моль ⋅ 22,4 л/моль = 3,58 (л). Ответ : выделить углекислый газ объемом 3,58 литра.
| |||
|
ФИО ______________________________ Класс ________ Вариант № ___ | ||||||
|
А1 |
А2 |
А3 |
А4 |
В1 |
В2 |
С1 |
|
|
|
|
|
|
|
|
|
Решение части С | ||||||
Бланк ответов.