7.2. Способы получения |
331 |
Задача 7.1. Назовите по систематической номенклатуре следующие соединения.
а) |
|
|
CH3 |
б) |
в) CH2 |
|
C |
|
CH |
|
CH |
|
CHCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H C CH2
CH2
7.2.СПОСОБЫ ПОЛУЧЕНИЯ
Многие диены могут быть получены теми же методами, что и алкены (см. разд. 5.2).
Дегалогенирование дигалогенидов действием металлов
Например, первый член ряда диенов — аллен — получают отщеплением брома от 2,3-дибромпропена действием металлического цинка:
CH2 |
|
CBr |
|
CH2Br + Zn |
|
CH2 |
|
C |
|
CH2 + ZnBr2. |
|
|
|
|
|
|
|
|
|
|
2,3-дибромпропен |
|
|
аллен |
Дегидрирование алканов и алкенов
Практическое значение имеет дегидрирование бутан-бутеновой фракции, получаемой в ходе крекинга нефти:
CH3CH2CH2CH3 |
+ CH3 |
CH |
|
CH |
|
CH3 |
Cr2O3/Al2O3 |
|
|
|
|
|
|
600–680 °C |
бутан |
|
2-бутен |
|
|
 2CH2
2CH2 CH CH
CH CH CH2 + 3H2
CH2 + 3H2
1,3-бутадиен
Этот процесс аналогичен получению этилена дегидрированием этана и является одним из наиболее эффективных промышленных методов синтеза 1,3-бутадиена.
Дегидратация алкандиолов
Реакция проводится в присутствии или минеральных кислот, например при получении 1,3-бутадиена из 1,4-бутандиола
|
|
CH2CH2CH2CH2 |
H3PO4 |
CH2 |
|
CH |
|
CH |
|
CH2 + 2H2O |
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
1,3-бутадиен |
332 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глава 7. Диены |
или гетерогенных катализаторов на основе оксида алюминия |
|
OH |
OH |
Al2O3 |
|
|
|
CH3 |
CH3 |
+ 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH3)2C |
|
C(CH3)2 |
|
CH2 |
|
C |
|
C |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
420–470 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,3-диметил-2,3-бутандиол |
|
|
2,3-диметил-1,3-бутадиен |
|
Дегидрогалогенирование дигалогеналканов
Реакции элиминирования дигалогеналканов, сопровождающиеся как и при дегидратации диолов образованием сопряженных диенов, отличаются высокой региоселективностью. В зависимости от температуры реакция идет с отщеплением одной (при 78 °C) или двух (при 160 °C) молекул НХ.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2CH2CH2CH2 |
2KOH |
CH2 |
|
CH |
|
CH |
|
CH2 + 2KCl + 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
(этанол), t |
|
|
|
|
|
|
|
Cl |
Cl |
|
1,3-бутадиен |
1,4-дихлорбутан
Среди продуктов реакций элиминирования всегда преобладает более стабильный, т. е. сопряженный, диен.
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
KOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH |
|
CH2 |
|
|
C |
|
|
CH2CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-бром-4-метил-1-гексен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
CH |
|
|
|
|
CH |
|
|
CH3 |
|
|
+ CH2 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CH2CH3 |
|
CH |
|
CH2 |
|
C |
|
CHCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-метил-1,3-гексадиен (78%) |
4-метил-1,4-гексадиен (следы) |
Синтез 1,3-бутадиена из этанола по Лебедеву
Эта реакция имеет исторический интерес. Она лежит в основе первого в
СССР промышленного метода получения 1,3-бутадиена. В настоящее время 1,3-бутадиен из этанола не производят.
2C H OH |
ZnO + MgO |
|
CH |
|
CH |
|
CH |
|
CH |
+ 2H O + H |
|
|
|
|
|
|
2 |
5 |
400 °C |
2 |
2 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
этанол |
|
|
|
1,3-бутадиен |
|
|
Окисление винилкупратов
Один из современных лабораторных методов синтеза 1,3-диенов заключается в окислении винилкупратов. Винилкупраты образуются как промежу-
7.3. Физические свойства и строение |
333 |
точные соединения из винильных литийорганических соединений и солей одновалентной меди и тотчас же окисляются до 1,3-диенов:
R Br
C C
C
HH
R
RLi
C |
|
C |
|
Cu2Br2, O2 |
H |
|
|
|
–20 °C |
H |
H |
|
|
|
|
|
H |
R |
|
|
|
|
|
алкенилбромид |
алкениллитий |
1,3-диен |
Ретрореакция Дильса–Альдера
Лабораторным способом получения 1,3-бутадиена может служить пропускание циклогексена через кварцевую трубку при 650 °С в смеси с парами воды (Н.Д. Зелинский, 1934 г.). В этих условиях протекает ретрореакция Дильса–Альдера.
|
|
t |
+ |
CH2 |
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
циклогексен 1,3-бутадиен |
этилен |
Задача 7.2. Завершите следующую реакцию. Назовите ее продукты по систематической номенклатуре.
CH3 |
|
|
|
CH |
|
CH2 |
|
CH2 |
|
|
|
CH |
|
CH3 |
Al2O3 |
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
OH |
|
|
|
7.3.ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ
7.3.1.Физические свойства
Физические свойства диенов подобны свойствам других алифатических углеводородов. Низшие диены С3–С4 — газы, не имеющие цвета. Средние диены представляют собой бесцветные жидкости, не смешивающиеся с водой.
7.3.2.Пространственное и электронное строение 1,3-бутадиена
Ниже даны различные способы представления электронного строения 1,3-бутадиена.
В терминах правила октетов:
H  C
C 
 C
C  C
C 
 C
C  H
H
H H H H
В терминах гибридизации АО:
π(p—p)-связи
 H
H
H2C C
C CH2
CH2
H
σ(Csp2—Csp2)-связи
Двойные связи в молекуле 1,3-бутадиена сопряжены, что находит отражение во многих его свойствах. В частности, длина связи в молекуле 1,3-бу- тадиена заметно отличается от стандартного значения.
CH2 CH CH
CH CH CH2
CH2
 0,148 нм (0,153 нм в этане)
0,148 нм (0,153 нм в этане)
О повышенной кратности связи С2–С3 в 1,3-бутадиене говорит и способность его молекулы принимать две конформации: s-цис- (цисоидная) и s-транс- (трансоидная):
|
|
H 3 |
4 |
|
|
|
H |
H° = 16,7 кДж/моль |
1 |
|
2 C |
|
CH2 |
|
|
C |
|
CH2 |
(4,0 ккал/моль) |
|
|
|
|
|
|
|
|
|
|
CH2 |
|
C |
|
|
|
|
|
H C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
(s)-транс-1,3-бутадиен |
|
|
(s)-цис-1,3-бутадиен |
|
(трансоидная конформация) |
|
(цисоидная конформация) |
|
Теория резонанса описывает сопряжение двойных связей в молекуле 1,3-бутадиена набором следующих резонансных структур:
CH2 CH CH CH2
CH CH2 
 CH2
CH2 CH CH
CH CH CH2
CH2
 CH2
CH2 CH
CH CH CH2
CH CH2
По определению, энергию сопряжения приравнивают к снижению энергии молекулы вследствие делокализации электронов. Энергию сопряжения π-орбиталей в диенах можно оценить различными способами, например разностью между рассчитанной по аддитивности и экспериментально измеренной теплотами гидрирования.
Показанные на рис. 7.1 значения теплот гидрирования алкенов и диенов свидетельствуют о том, что диены с сопряженными двойными связями заметно стабильнее, чем диены с изолированными двойными связями. Как видно, уровень энергии диена с сопряженными двойными связями ниже уровня энергии диена с изолированными двойными связями на 3,9 ккал/моль (16,3 кДж/моль):
Еπ(делок) = Нгидр(эксп.) — Нгидр(адд.) = –56,5 + 60,4= 3,9 ккал/моль
7.3. Физические свойства и строение |
335 |
1,4-пентадиен
1,3-пентадиен
1-пентен Hгидр = –60,4 ккал/моль
Hгидр = –56,5 ккал/моль
Hгидр = –30,2 ккал/моль
Рис. 7.1. Сравнение теплот гидрирования некоторых алкенов и диенов
Значение 3,9 ккал/моль и является экспериментальной оценкой энергии сопряжения π-орбиталей в сопряженных диенах.
В то же время высказывается мнение, что оценки степени сопряжения двойных связей в 1,3-диенах по данным длин связей и теплот гидрирования являются не вполне корректными, поскольку они не учитывают того факта, что центральная σ(С–С)-связь в 1,3-диенах образована sp2-гибридизо- ванными атомами углерода.
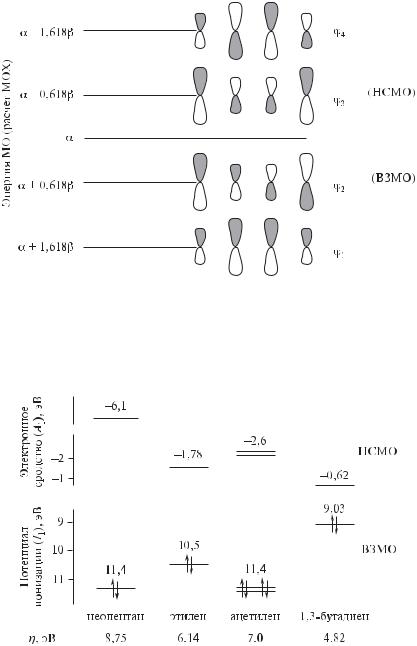
Энергия делокализации π-электронов в молекуле 1,3-бутадиена может быть определена и по результатам квантово-химических расчетов. Для этого, например, по данным метода МОХ рассчитывают π-электронную энергию (Eπ) 1,3-бутадиена:
зан
Eπ = ∑ giεi = 2(α + 1,618β) + 2(α + 0,618β) = 4α + 4,472β. i = 1
Оценивают энергию его π-электронов в предположении локализации двойных связей, т. е. по аддитивности (Eπ(лок)):
Eπ(лок) = 2[2(α + β)] = 4α + 4β,
где 2(α + β) — энергия π-электронов двойной связи в этилене.
Энергию делокализации π-электронов (Eπ(делок)) в 1,3-бутадиене определяют по разности полученных величин:
Eπ(делок) = Eπ — Eπ(лок) = 0,472β.
На рис. 7.2 показаны графические изображения молекулярных π-орби- талей 1,3-бутадиена по данным расчета методом МОХ.
1,3-Бутадиен отличается более лабильной электронной оболочкой молекулы по сравнению с алкенами и алкинами: его потенциалы ионизации ниже, а электронное сродство выше, чем у изученных до сих пор углеводородов.
Рис. 7.2. Энергетическая диаграмма молекулярных π-орбиталей 1,3-бутадиена
Рис. 7.3. Энергетическая диаграмма граничных молекулярных орбиталей и значения «жесткости» (η) электронных оболочек ряда углеводородов
На это указывают граничные энергетические уровни, измеренные по данным одноэлектронных реакций фотоионизации и присоединения электрона,
M + hν |
|
|
M |
+ e |
(I1), |
|
|
M + e |
|
|
|
M |
|
(A1), |
|
|
|
|
и значения «жесткости» электронных оболочек ряда ранее изученных углеводородов и 1,3-бутадиена (рис. 7.3).
Как видим, 1,3-бутадиен имеет заметно более «мягкую» электронную оболочку молекул по сравнению с любым из изученных ранее углеводородов. Это объясняет повышенную реакционную способность 1,3-бута- диена и других сопряженных диенов в реакциях электрофильного присоединения.
7.4.РЕАКЦИИ
7.4.1.Электрофильное присоединение к сопряженным диенам
Гидрогалогенирование
При присоединении галогеноводородов к сопряженным диенам образуются два структурных изомера. Ниже показан пример реакции 1,3-бутадиена с HBr.
1,2-присо-
единение  CH3 CH CH
CH3 CH CH CH2
CH2
Br
3-бром-1-бутен
CH2 CH CH
CH CH CH2 + HBr
CH2 + HBr
1,3-бутадиен
1,4-присо-  CH3 CH
CH3 CH CH CH2Br единение
CH CH2Br единение
1-бром-2-бутен
Механизм присоединения галогеноводородов включает следующие стадии.
Стадия 1 — образование π-комплекса:
CH2 CH CH
CH CH CH2 + HBr
CH2 + HBr  CH2
CH2 CH CH
CH CH CH2
CH2
H
Br
Стадия 2 — перегруппировка π-комплекса в σ-комплекс с образованием резо- нансно-стабилизированного карбокатиона аллильного типа (скоростьлимитирующая стадия):
CH2 |
|
|
CH |
|
CH |
|
|
CH2 |
|
|
CH2 |
|
|
CH2 |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
–Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
медленно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
аллильные положения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CH |
|
CH |
|
CH2 |
|
CH3CH CH |
|
|
CH2 |
|
|
CH3CH |
|
|
CH |
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбокатион аллильного типа |
|
|
|
|
|
|
Стадия 3 — стабилизация карбокатиона взаимодействием с бромид-ионом:
CH3CH |
|
CH |
|
CH2 |
|
Br |
CH3CH |
|
CH |
|
CH2 |
+ CH3CH |
|
CH |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
быстро |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
Br |
|
|
|
|
|
|
|
|
3-бром-1-бутен |
1-бром-2-бутен |
Карбокатионы, образующиеся в реакциях электрофильного присоединения к сопряженным диенам, принято называть карбокатионами аллильного типа. Такие карбокатионы характеризуются повышенной устойчивостью. Они более устойчивы, чем третичные карбокатионы. По этой причине сопряженные диены в реакциях электрофильного присоединения более реакционноспособны, чем алкены и алкины.
CH2 CH CH
CH CH CH2 > CH3 C
CH2 > CH3 C CH2 > CH3 C
CH2 > CH3 C CH
CH
CH3
уменьшение реакционной способности в реакциях AdE
Поскольку в карбокатионе аллильного типа имеется два реакционных центра (в силу особенностей строения диена они могут быть равноценны), присоединение бромид-иона на следующей стадии может протекать в двух направлениях. Поэтому при электрофильном присоединении к сопряженному диену обычно образуется смесь продуктов 1,2-присоединения (прямое присоединение) и 1,4-присоединения (сопряженное присоединение).
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Сопряженным присоединением (или 1,4-присоединением) называют реакцию присоединения, в которой реагент присоединяется по концам сопряженной цепи с миграцией двойной связи; наиболее известные примеры — сопряженное присоединение к 1,3-диенам и α,β-ненасыщенным карбонильным соединениям.
Относительные количества продуктов 1,2- и 1,4-присоединения зависят от условий проведения реакции — температуры, природы растворителя,
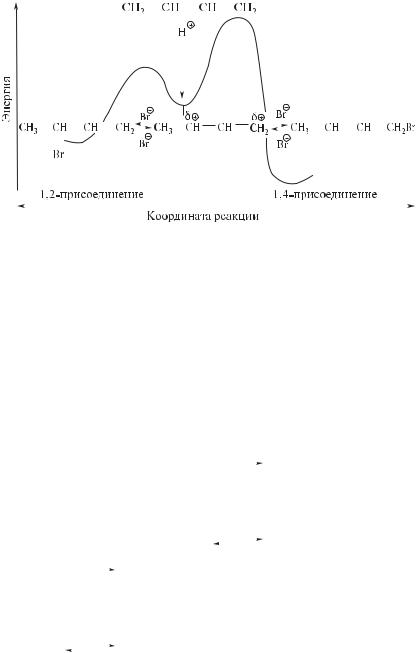
Рис. 7.4. Энергетическая диаграмма реакции присоединения бромоводорода к 1,3-бутадиену
продолжительности процесса. Продукт 1,4-присоединения термодинамически более устойчив, в то время как 1,2-присоединение протекает с боль-
шей скоростью (E1,2акт < E1,4акт).
Если гидробромирование диенового углеводорода проводят при низкой температуре, обратная реакция дегидробромирования не протекает. В этих условиях реакция контролируется кинетикой и основным продуктом реакции оказывается продукт 1,2-присоединения. Речь идет, таким образом, о кинетически контролируемой реакции. Энергетическая диаграмма присоединения бромоводорода к 1,3-бутадиену показана на рис. 7.4.
–80 °C
CH2 |
|
CH |
|
CH |
|
|
CH2 + HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,3-бутадиен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 °C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
|
CH |
|
|
CH2 |
|
|
CH |
|
|
CH |
|
|
CH2Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-бром-2-бутен |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3-бром-1-бутен |
(1,4-аддукт, 19%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1,2-аддукт, 81%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
CH |
|
|
CH |
|
CH2 |
+ CH3 |
|
|
CH |
|
CH |
|
CH2Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1,4-аддукт, 56%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
Если реакция идет при повышенной температуре, имеет место и обратная реакция дегидробромирования. В реакционной смеси накапливается продукт 1,4-присоединения, так как он термодинамически более стабилен (по правилу Зайцева как более замещенный алкен). В этих условиях состав продуктов реакции определяется термодинамическим контролем. Важно отметить, что при повышенной температуре индивидуальный 1,2-аддукт постепенно превращается в равновесную смесь с 1,4-аддуктом. Например, нагревание до 45 °С реакционной смеси, полученной при –80 °С, ведет к получению 15% 1,2-аддукта и 85% 1,4-аддукта. При повышенной температуре речь идет, таким образом, о термодинамически контролируемой реакции.
Несимметричные диены присоединяют HBr по правилу Марковникова. В кинетически контролируемых условиях (т. е. при низкой температуре) реакция идет по типу 1,2-присоединения; при этом промежуточно образуется более стабильный карбокатион (А):
CH3
CH2 C CH
C CH CH2 + H
CH2 + H
2-метил-1,3-бутадиен
|
|
|
|
CH3 |
|
Br |
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
C |
|
CH |
|
CH2 |
CH3 |
|
C |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
Br |
|
|
|
|
CH3 |
|
|
3-бром-3-метил-1-бутен |
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В термодинамически контролируемых условиях (т. е. при повышенной температуре) образуется продукт 1,4-присоединения (более замещенный алкен):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
CH3 |
|
C |
|
CH |
|
CH2 |
CH3 |
C |
CH |
CH2 |
|
|
|
|
|
|
|
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
CH |
|
CH2 |
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-бром-3-метил-2-бутен |
Задача 7.3. Изобразите все резонансные структуры для следующих карбокатионов. CH2
a) CH2 |
|
CH |
|
CH |
|
CH |
|
CH2 |
б) CH2 |
|
CH |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|



 H
H CH2
CH2
 CH CH
CH CH CH2
CH2 0,148 нм (0,153 нм в этане)
0,148 нм (0,153 нм в этане) CH CH2
CH CH2 
 CH2
CH2 CH CH
CH CH CH2
CH2
 CH2
CH2 CH
CH CH CH2
CH CH2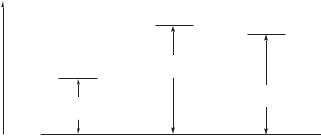

 CH3 CH CH
CH3 CH CH CH2
CH2 CH CH
CH CH CH2 + HBr
CH2 + HBr CH3 CH
CH3 CH CH CH2Br единение
CH CH2Br единение CH CH
CH CH CH2 + HBr
CH2 + HBr  CH2
CH2 CH CH
CH CH CH2
CH2
 C CH
C CH CH2 + H
CH2 + H

 CH
CH 2CH
2CH CH CH
CH CH CH
CH C
C C
C 
 C
C  C
C 
 C
C  H
H CH CH
CH CH CH
CH CH
CH CH
CH ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!