
Травень В.Ф. - Органическая химия. В 3 т. Т. 1
..pdf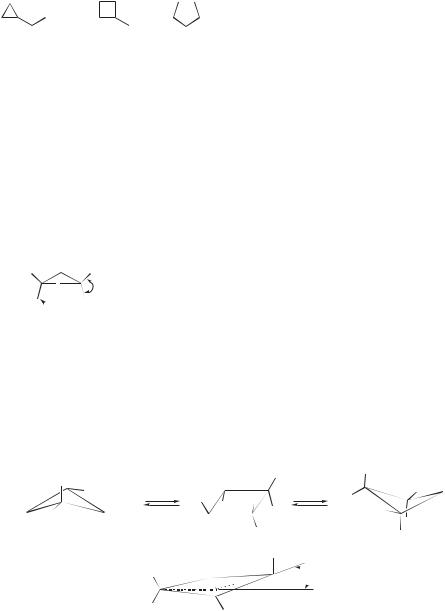
4.3. Физические свойства и строение |
201 |
Задача 4.2. Расположите следующие соединения
а) в порядке повышения их теплоты сгорания |
б) в порядке роста их стабильности |
4.3.2.Пространственное строение
Циклопропан
Три атома углерода циклопропана лежат в одной плоскости, а все С–Н- связи у соседних С-атомов являются заслоненными. Поэтому энергия напряжения циклопропана складывается прежде всего из суммы углового напряжения (109,5 – 60 = 49,5°) и торсионного напряжения (заслоненные взаимодействия шести пар С—Н-связей ориентировочно могут быть оценены величиной 25 кДж/моль, или 6 ккал/моль).
H1,510 Å
H H
H
115°
H
H H
H
1,089 Å
Циклобутан
Молекула циклобутана лишь слегка изогнута и может считаться практически плоской. Энергия напряжения циклобутана также складывается из энергий углового напряжения (109,5 – 90 = 19,5°) и торсионного напряжения (заслоненные взаимодействия восьми пар С–Н-связей у соседних С-атомов).
H H H H H H HH H
HH H  H H
H H H H H H H H H
H H H H H H H  H
H
H H H H H
HH
H
 H
H



 H
H 25°
25°
 H
H
HH
Циклопентан
Каждый атом углерода в кольце циклопентана последовательно выходит из плоскости так, что молекула циклопентана приобретает форму конверта
202 |
Глава 4. Циклоалканы |
(торсионное напряжение). При этом все пять конформеров циклопентана, показанных ниже, имеют одинаковую энергию.
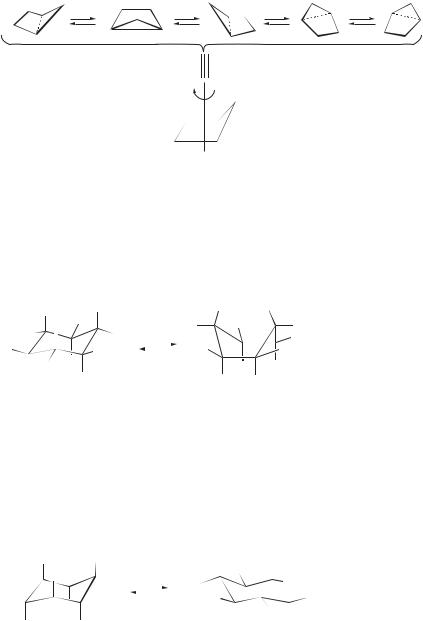
Циклогексан
Молекула циклогексана может принимать несколько конформаций. Ниже показаны конформации «кресло» и «ванна». В обеих конформациях валентные углы и длины связей С—С и С—Н имеют стандартные значения. Обе конформации свободны от углового напряжения. Однако, они различаются другими типами напряжения (прежде всего, торсионного). Разность их свободных энергий ( G°) достигает величины 27 кДж/моль (6,5 ккал/моль).
H |
H |
|
|
|
|
|
H |
H |
H H |
H |
|
|
|
|
H |
H |
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
H |
|
H |
|||||
H |
H |
|
|
|
|
H |
|
H |
|
|
|
|
|||||
|
|
|
|
|
||||
H H |
H |
|
|
|
|
|
H |
H |
H |
|
|
|
|
|
|||
|
|
|
|
|
H |
H |
||
«кресло» |
|
|
|
|
|
«ванна» |
||
Наиболее стабильной является конформация «кресло», поскольку в ней отсутствует также и торсионное напряжение. Конформация «кресло» не имеет конфигурационной жесткости изомера. Она способна претерпевать превращения «кресло I» 
 «кресло II». При этом аксиальные заместители (их связи с атомами углерода цикла ориентированы параллельно вертикальной оси симметрии молекулы) в «кресле I» становятся экваториальными заместителями (их связи направлены в сторону от вертикальной оси симметрии молекулы) в «кресле II» и наоборот.
«кресло II». При этом аксиальные заместители (их связи с атомами углерода цикла ориентированы параллельно вертикальной оси симметрии молекулы) в «кресле I» становятся экваториальными заместителями (их связи направлены в сторону от вертикальной оси симметрии молекулы) в «кресле II» и наоборот.
H |
Ha |
|
|
|||||
a |
|
|
|
|
|
|
He |
|
Ha |
инверсия |
|
||||||
H |
He |
|||||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
e |
He |
|
|
|
цикла |
H |
|||||
Ha |
e |
He |
||||||
|
||||||||
Ha |
Ha |
|
||||||
|
|
|||||||
«кресло I» |
«кресло II» |
(аксиальные Н-атомы) |
(экваториальные Н-атомы) |
4.3. Физические свойства и строение |
203 |
Энергетический барьер перехода «кресло I» 
 «кресло II» для циклогексана составляет 45,2 кДж/моль (10,8 ккал/моль). Совершается этот переход очень быстро: половина всех молекул циклогексана при 25 °С претерпевает его каждые 10–5 с.
«кресло II» для циклогексана составляет 45,2 кДж/моль (10,8 ккал/моль). Совершается этот переход очень быстро: половина всех молекул циклогексана при 25 °С претерпевает его каждые 10–5 с.
При составлении названия замещенного циклогексана по номенклатуре ИЮПАК, находящегося в той или иной конформации, ориентацию заместителя указывают буквенным индексом, который берут в скобки.
H |
H |
|
|
CH3 |
CH3 |
|
|
(е)-метилциклогексан |
(а)-метилциклогексан |
Задача 4.3. Определите, какой из стереоизомеров более стабилен в каждой из следующих пар и разъясните это.
а) цис- или транс-1-Изопропил-2-метилциклогексан;
б) CH3 |
CH3 |
CH3 |
CH3 |
|
CH3 |
|
CH3 |
в) CH3 |
CH3 |
CH3 |
CH3 |
|
CH3 |
|
CH3 |
Задача 4.4. Какое соединение из каждой пары соединений обладает бóльшей теплотой сгорания?
а) цис- или транс-1,2-диметилциклогексан; б) цис- или транс-1,3-диметилциклогексан; в) цис- или транс-1,4-диметилциклогексан. Дайте объяснение.
4.3.3. Природа связей в циклопропане
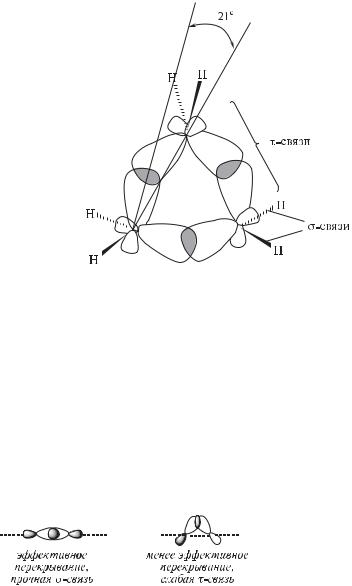
Характер связей в средних циклоалканах (С5—С8) не отличается от характера связей в алканах, поскольку все атомы углерода в циклоалканах находятся в состоянии sp3-гибридизации. Углерод-углеродные связи в малых циклоалканах имеют, однако, особый характер. В частности, в молекуле циклопропана по геометрическим причинам валентные углы С—С—С должны быть равны 60°. Однако sp3-гибридные орбитали атомов углерода, образующие эти связи, направлены не вдоль межъядерной оси, а под углом
204 |
Глава 4. Циклоалканы |
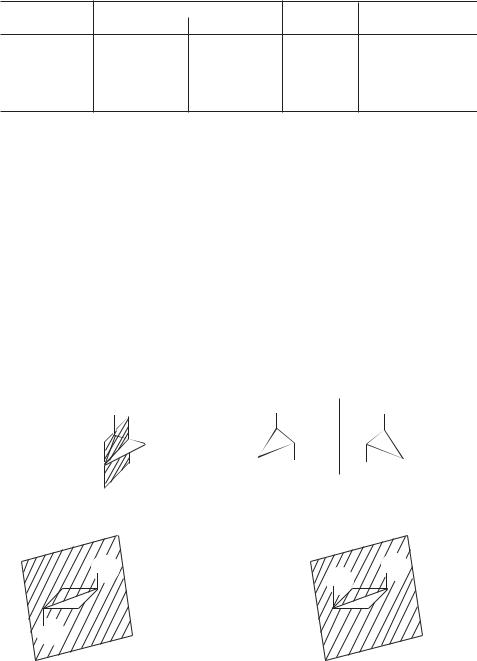
Рис. 4.1. σ- и τ-cвязи в молекуле циклопропана
~21° к ней, как показано на рис. 4.1. В молекуле циклопропана, таким обра-
зом, σ(С—С)-связи трансформированы в так называемые τ-связи (изогнутые, или банановые, связи).
Конечно, τ-связи являются более слабыми, нежели σ-связи. Это объясняется менее благоприятными условиями перекрывания соответствующих атомных орбиталей в τ-связях. Как показано ниже, орбитали соседних атомов перекрываются наиболее эффективно, когда они направлены вдоль линии связи. Эффективность перекрывания снижается, когда атомные орбитали ориентированы под углом к линии связи, что имеет место в малых циклоалканах.
Четыре гибридные орбитали каждого атома углерода в циклопропане оказываются, таким образом, неэквивалентными: орбитали, образующие С—Н-связи, имеют бoльший s-характер, а орбитали, образующие С—С-свя- зи, — бoльший p-характер. Указанные особенности находят отражение и в значениях энергий МО.
Из анализа фотоэлектронных спектров следует, что энергия высших занятых С—С-орбиталей при переходе от циклопентана к циклопропану по-
4.4. Реакции |
205 |
Таблица 4.2. Оценка энергий С—С- и С—Н-связей в циклоалканах по данным их потенциалов ионизации
|
Потенциал ионизации, эВ |
|
Циклоалкан |
|
|
Высшая занятая |
Высшая занятая |
|
|
(С–С) МО |
(С–Н) МО |
|
|
|
Циклопентан |
11,82 |
11,01 |
Циклобутан |
10,7 |
11,7 |
Циклопропан |
10,5 |
13,2 |
|
|
|
вышается примерно на 1,3 эВ, а энергия высших занятых С—Н-орбиталей в том же ряду снижается на ~2 эВ (табл. 4.2).
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Потенциал ионизации электронов с ВЗМО циклопропана равен потенциалу ионизации π-электронов с ВЗМО этилена (см. разд. 5.3.2).
К этому можно добавить, что циклопропан и этилен близки и по силе СН-кислотности: их значения рКа равны 39 и 37 соответственно.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Банановой связью (τ-связь) называют связь σ-типа, не имеющую максимального перекрывания составляющих эту связь атомных орбиталей, поскольку они не направлены вдоль межъядерной оси. Такая связь имеется, в частности, между атомами углерода в циклопропане.
4.4.РЕАКЦИИ
Повышенный p-характер С—С-связей циклопропана и меньшая эффективность перекрывания атомных орбиталей в них находятся в полном соответствии с высокой реакционной способностью производных циклопропана. Многие реакции циклопропана сопровождаются раскрытием цикла. В этих реакциях особую активность проявляют электрофильные агенты, поскольку ВЗМО циклопропана имеет высокую энергию (соответственно низкому значению первого потенциала ионизации). Циклобутан в меньшей степени склонен к реакциям с раскрытием цикла. Средние циклоалканы по своей реакционной способности близки к соответствующим алканам и склонны прежде всего к реакциям радикального замещения.
206 |
Глава 4. Циклоалканы |
4.4.1. Реакции с водородом
Эта реакция, как и последующие реакции с электрофильными агентами, протекает неодинаково для различных циклоалканов. Низшие циклоалканы, и прежде всего циклопропан, реагируют с раскрытием цикла. При этом циклопропан проявляет наиболее высокую реакционную способность. Например, в реакции с водородом над Ni-катализатором молекула циклопропана раскрывается при 80 °С, а циклобутана — при 200 °С. При применении Pt-катализатора 3-членный цикл раскрывается уже при комнатной температуре, а 4-членный — при 50 °С.
|
H2, Pt |
CH3CH2CH3 |
|
20 °C |
|
циклопропан |
пропан |
|
|
H2, Pt |
CH3CH2CH2CH3 |
|
50 °C |
|
циклобутан |
бутан |
|
Циклоалканы, имеющие в цикле пять и более атомов углерода, с водородом в этих условиях не реагируют.
H2, Pt реакция не идет
реакция не идет
50 °C
циклогексан
4.4.2.Реакции с минеральными кислотами
Циклоалканы относятся также неодинаково и к ионным реагентам. Например, с сильными минеральными кислотами циклопропан реагирует с раскрытием цикла, а средние циклоалканы в реакцию не вступают.
|
HBr |
CH CH CH Br |
|
1) H2SO4 |
CH CH CH OH |
|||||||
|
t |
3 |
2 |
2 |
|
2) H2О |
|
3 |
2 |
2 |
||
циклопропан |
1-бромпропан |
циклопропан |
1-пропанол |
|||||||||
|
HBr |
реакция не идет |
|
|
H2SO4 |
реакция не идет |
||||||
|
t |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
циклогексан |
|
|
|
циклогексан |
|
|
|
|||||
Молекула циклобутана не раскрывается под действием указанных реагентов.
4.4. Реакции |
207 |
4.4.3.Реакции с галогенами
Если хлорирование циклопропана проводят при нагревании, то основным продуктом оказывается 1,3-дихлорпропан:
|
Cl2 |
Cl |
|
CH2CH2CH2 |
|
Cl |
|
|
|
|
|||
|
t |
|||||
циклопропан |
|
1,3-дихлорпропан |
||||
Фотохимическое хлорирование при низкой температуре дает значительное количество хлорциклопропана. Реакция идет по тому же радикальноцепному механизму, что и хлорирование алканов:
|
|
|
Cl |
Cl |
|
Cl |
||||
|
|
|
|
|
||||||
|
Cl2, hν |
|
|
|
|
|
|
|
||
|
+ H2C |
|
CH2 |
|
CH2 |
|||||
|
|
|
|
|
|
|||||
циклопропан |
|
хлор- |
1,3-дихлорпропан |
|||||||
|
|
циклопропан |
|
|
|
|||||
При нагревании с бромом циклопропан реагирует также с раскрытием цикла.
|
Br2 |
Br |
|
CH2CH2CH2 |
|
Br |
|
|
|
|
|||
|
t |
|||||
циклопропан |
|
1,3-дибромпропан |
||||
Циклобутан в реакции хлорирования преимущественно образует хлорциклобутан. Аналогично реагируют и средние циклоалканы.
|
|
|
|
Cl |
|
|
|
Cl |
|
|
Cl2, hν |
+ HCl; |
|
Cl2, hν |
+ HCl |
||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
цикло- |
|
|
хлорцикло- |
цикло- |
|
|
хлорцикло- |
|
бутан |
|
|
бутан |
гексан |
|
|
гексан |
|
Монохлорирование циклогексана протекает особенно гладко при применении хлористого сульфурила в качестве хлорирующего агента; реакцию проводят в присутствии пероксида бензоила как инициатора радикальных реакций. Выход хлорциклогексана при этом достигает 90%:
|
|
|
Cl |
+ SO2Cl2 |
пероксид |
+ HCl + SO2 |
|
|
|
||
|
|
||
циклогексан |
|
|
хлорциклогексан |
Задача 4.5. Завершите реакции. Назовите продукты реакций.
a) |
Br2 |
б) CH3 |
CH3 |
HBr |
CCl4 |
|
|||
|
|
|
|

208 |
Глава 4. Циклоалканы |
Задача 4.6. Завершите реакции. Определите конфигурацию преобладающего продукта монохлорирования по R,S-номенклатуре. Дайте его полное название по номенклатуре ИЮПАК.
a) |
CH3 |
б) |
CH3 |
|
в) |
CH3 |
||
|
|
Cl2, hν |
|
CH3 |
Cl2, hν |
|
Cl2, hν |
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
|
|||
|
|
|
|
|
|
|
||
4.5.СТЕРЕОИЗОМЕРИЯ ЗАМЕЩЕННЫХ ЦИКЛОАЛКАНОВ
4.5.1.Монозамещенные циклоалканы
Как показано выше, среди других циклоалканов циклогексан наиболее гладко подвергается реакциям замещения. Его галогенируют, нитруют, окисляют, дегидрируют над катализатором. Поэтому стереохимические свойства замещенных циклоалканов далее будут рассмотрены на примере производных циклогексана.
Значения свободных энергий ( G°) монозамещенных циклогексанов свидетельствуют о том, что экваториальная ориентация заместителя предпочтительнее, чем аксиальная. Это связано с тем, что при аксиальной ориентации возникает взаимодействие между заместителем и аксиально расположенными атомами водорода при третьем и пятом углеродных атомах (1,3-диаксиальное отталкивание, или напряжение Прелога).
H |
R |
|
|
|
H |
|
|
|
||
|
H |
|
|
|
|
|
|
|
||
3 |
1 |
|
|
4 |
|
|
2 |
|||
|
2 |
|
Кравн |
3 |
|
|||||
|
|
|
|
|
H |
|
R |
|||
4 |
|
|
|
|
|
|
|
6 |
|
|
5 |
6 |
|
|
|
|
1 |
||||
|
|
5 |
|
|||||||
|
|
|
|
|
|
|
||||
аксиальный конформер |
|
|
|
экваториальный конформер |
||||||
G° = – RT ln Kравн.
В соответствии с этим продукт монохлорирования циклогексана находится преимущественно в форме (е)-хлорциклогексана:
Cl
H |
|
|
|
Cl |
|
|
|
||
|
|
|
H
(а)-хлорциклогексан (е)-хлорциклогексан
G° = –2,1 кДж/моль (0,5 ккал/моль), Kравн = 2,33.
4.5. Стереоизомерия замещенных цилкоалканов |
209 |
Таблица 4.3. Предпочтительность экваториальной ориентации заместителя в монозамещенных циклогексанах C6H11R
R |
Ориентация |
Kравн |
G°, |
|
аксиальная, % экваториальная, % |
кДж/моль (ккал/моль) |
|||
|
|
F |
40 |
60 |
1,5 |
–1,0 (–0,24) |
CH3 |
5 |
95 |
19 |
–7,3 (–1,70) |
(CH3)2CH |
3 |
97 |
32,3 |
–8,6 (–2,10) |
(CH ) C |
<0,01 |
>99,99 |
>9999 |
–22,8 (–5,50) |
3 3 |
|
|
|
|
Для ряда циклогексанов С6Н11R значения G° и Kравн сравниваются в табл. 4.3. Для других монозамещенных циклогексанов разности свободных энергий экваториального и аксиального конформеров приведены ниже.
R |
Cl |
Br |
I |
OH |
CH2CH3 |
C6H5 |
COOH |
CN |
– G °, |
|
|
|
|
|
|
|
|
кДж/моль |
2,1 |
2,1 |
1,9 |
4,2 |
7,5 |
13,0 |
5,9 |
0,8 |
ккал/моль |
0,5 |
0,5 |
0,45 |
1,0 |
1,8 |
3,1 |
1,4 |
0,2 |
4.5.2. Дизамещенные циклоалканы
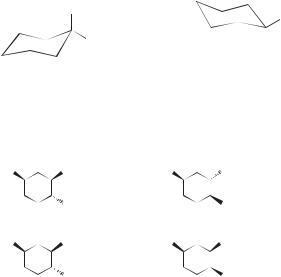
Стереоизомерия дизамещенных циклоалканов определяется тем, что они могут существовать как в виде цис- и транс-изомеров, так и в виде оптических изомеров. Ниже показаны соответствующие примеры.
зеркальная плоскость
|
CH |
CH3 |
CH |
|
3 |
|
3 |
|
CH |
|
|
|
3 |
|
|
|
|
CH3 |
CH |
|
|
|
3 |
молекула ахиральна (мезо-форма), |
молекула хиральна, существует |
||
так как имеет плоскость симметрии |
в виде энантиомеров |
||
|
CH3 |
|
CH3 |
|
|
|
CH3 |
CH3 |
молекулы ахиральны, так как |
|
|
|
имеют плоскость симметрии |
|
|

210 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глава 4. Циклоалканы |
|||||
|
|
|
|
|
зеркальная плоскость |
|
|
|
|
|
|
CH3 |
|||||||||
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|
CH3 H3C |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
молекула хиральна, |
молекулы ахиральны, так как |
|||||||||||||||
|
|
существует в виде энантиомеров |
|
имеют плоскость симметрии |
|||||||||||||||||
|
|
зеркальная плоскость |
|
|
|
|
|
|
|
|
зеркальная плоскость |
||||||||||
|
|
CH3 |
CH3 |
|
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
||||||
|
|
|
|
|
|
|
|
|
молекулы хиральны, |
|
|
|
|
|
|
|
|
||||
|
CH3 |
CH3 |
|
|
существуют в виде |
CH3 |
|
|
CH3 |
||||||||||||
|
|
|
|
|
энантиомеров |
|
|
||||||||||||||
Стереохимия дизамещенных циклогексанов рассмотрена ниже на примере его дихлор- и диметилзамещенных.
1,1-Дихлорциклогексан
Это соединение присутствует среди продуктов дихлорирования циклогексана в виде единственного конформера. Формально для него можно изобразить две структуры, но эти структуры идентичны.
Cl(1) |
|
|
|
Cl(1) |
|
|
|
|
|
Cl(2) |
|
|
|
Cl(2) |
|
|
|
||
|
|
|
|
(а,е)-1,1-дихлорциклогексан (е,а)-1,1-дихлорциклогексан
1,2-Дихлорциклогексан
цис-1,2-Дихлорциклогексан является хиральным соединением, поскольку его молекула не обладает элементами симметрии. Однако формы I и II имеют одинаковую энергию, они переходят одна в другую при обращении цикла, что исключает возможность выделения их в энантиомерно-чистом виде. Формы I и II называют конформационными энантиомерами.
Cl |
зеркальная плоскость |
Cl |
|
|
|
|
|
|
|
|
|
|
|
Cl |
|||
|
|
|
|
|
||||
H |
|
|
H |
|
|
|
||
|
|
|
|
|
|
Cl |
||
Cl |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|||
H |
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
H |
||
120 °C |
I |
II |
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
