
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
272 |
Глава 14. Галогеналкены и галогенарены |
Замещение галогена в неактивированных галогенаренах начинается со
стадий отщепления, а завершается стадиями присоединения. Этот механизм поэтому часто называют механизмом отщепления–присоединения
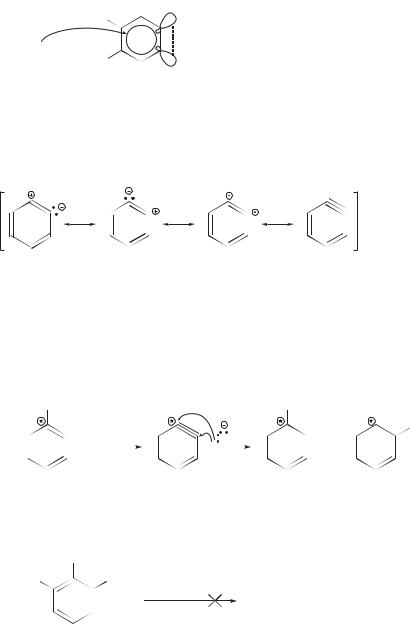
(ариновый механизм). Он показан ниже на примере замещения хлора в хлорбензоле на аминогруппу. Его особенностью является образование дегидробензола (арин) в качестве ключевого промежуточного соединения.
Стадия 1 — отщепление протона от молекулы хлорбензола под действием основания — амид-иона:
Cl |
NH2 |
Cl |
|
+ NH3 |
|
|
|
|
H |
|
|
Стадия 2 — выброс хлорид-иона с образованием неустойчивого промежуточного соединения — дегидробензола:

 Cl
Cl
+  Cl
Cl
Стадия 3 — присоединение нуклеофила — амид-иона — к дегидробензолу:
 NH2
NH2 
 NH2
NH2
Стадия 4 — протонирование промежуточного карбаниона:
NH2 |
|
NH3 |
|
|
NH2 |
|
|
|
|
+ NH2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
H
анилин
Для реакции галогенаренов с KNH2 в жидком аммиаке обнаружен следующий ряд реакционной способности:
Ar–Br > Ar–I > Ar–Cl > Ar–F.
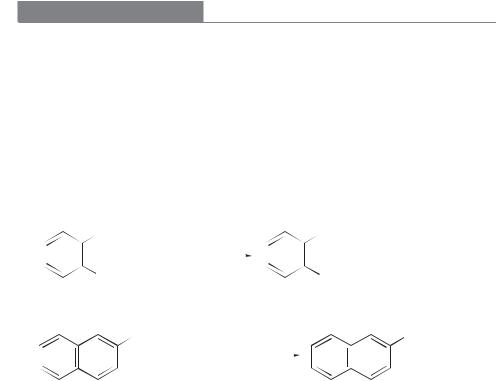
Дегидробензол — неустойчивое промежуточное соединение. В дегидробензоле между двумя атомами углерода кроме обычных σ- и π-связей имеется еще дополнительная связь за счет бокового перекрывания sp2-орбита- лей. Эта дополнительная связь располагается в плоскости молекулы и перпендикулярна π-электронному облаку бензольного кольца. Она, однако, лишь в некоторой мере аналогична второй π-связи в молекуле алкина,
276 |
Для углубленного изучения |
Многие другие нуклеофилы могут быть арилированы по аналогичной схеме: карбоксилат-ионы, алкоксид-ионы, амины, тиолат-ионы, ацетилениды [3, 4]:
|
X |
Ph2NH |
|
|
NPh2 |
|
|
|
|
||
|
|
CuL(PPh3)Br (10 мол.%) |
|
|
|
|
|
|
|||
|
|
t-BuOK, PhMe, 50–110 °C |
|||
R |
|
R |
|||
Полагают, что эти реакции начинаются с окислительного присоединения арилбромида к меди(+1) (путь A ) и образования медьорганического соединения в качестве реакционноспособного интермедиата; при этом атом металла приобретает заряд (+2):
Ar–Br + Cu(I)  Ar–Cu–Br,
Ar–Cu–Br,
Ar–Cu–Br + CN  Ar–CN + Cu(I) + Br
Ar–CN + Cu(I) + Br
Завершаются реакции стадией восстановительного элиминирования, в которой образуется продукт замещения, а атом меди возвращает первоначальную степень окисления (+1). Реакция может протекать и по пути B , как показано на схеме.
|
CuX |
|
MNu или |
|
RX |
|
|
|
CuY |
HNu + основание |
|
|
|
||
|
|
A |
B |
|
|
Y |
CuNu |
|
R—Cu—X |
||
|
|
||
|
MNu или |
|
|
|
HNu + основание |
Nu |
RX |
|
|
|
|
RNu |
|
R—Cu—X |
|
Часто эти реакции проводят в гетерогенных условиях с применением порошка металлической меди, которая и оказывается источником каталитической меди(+1). Применение растворимых солей меди, например, трифлата меди(+1), позволяет проводить арилирование и в гомогенных условиях.
Палладий-фосфиновые комплексы найдены еще более эффективными катализаторами реакций нуклеофильного замещения в галогенаренах
Реакции, катализируемые соединениями меди и палладия |
277 |
(бром-, иод-, хлорарены как с электронодонорными, так и с электроноакцепторными заместителями) [5, 6]:
|
|
|
Pd[P(C |
H ) |
] |
, (CH ) |
SiCN |
||||
H |
CO |
I |
6 |
5 |
3 |
4 |
|
|
3 |
3 |
|
|
|
|
|
|
|
|
|
|
|||
3 |
|
|
|
(C |
H ) |
N |
|
|
|||
|
|
|
|
|
2 |
|
5 |
3 |
|
|
|
H CO |
CN (89%) |
3 |
|
Эти реакции протекают как каталитический цикл, включающий Pd(0)- и Pd(+2)-интермедиаты.
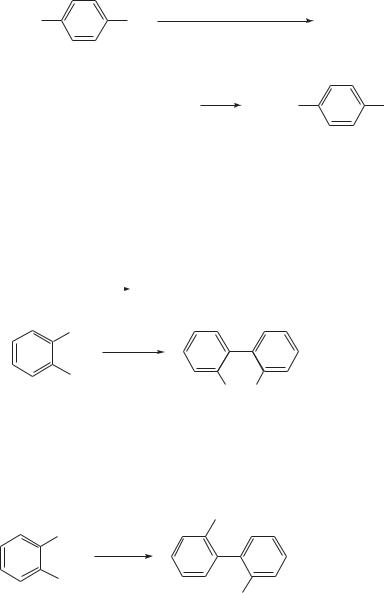
Применение в синтезе производных ароматических углеводородов находит и реакция Ульмана (1901 г.) — конденсация галогенаренов под дей-
ствием порошка металлической меди. И эта реакция проводится при высокой температуре (100–350 °С). В качестве растворителя применяют толуол, диметилформамид, нитробензол или проводят реакцию без растворителя.
|
Cu |
|
|
Ar–X + Ar'–X |
|
Ar–Ar' |
(Х = Cl, Br или I) |
|
|||
|
t |
|
|
Cl
2 |
Cu (бронза) |
|
220 °C |
||
|
NO2
NO2 NO2
Эту реакцию называют также реакцией биарильной конденсации. Хорошие выходы наблюдаются в реакциях галегенаренов, содержащих электроноакцепторные группы [7]. Трифлат меди позволяет проводить биарильную конденсацию при значительно более низких температурах и в гомогенных условиях [8].
NO2
NO2
CF3SO3Cu
NH3
24 ч, 25 °C
Br
O2N

278 |
Дополнения |
Дополнения!
ГАЛОГЕНУГЛЕВОДОРОДЫ В ОКРУЖАЮЩЕЙ СРЕДЕ
Галогенпроизводные углеводородов с большим трудом подвергаются в природе каким-либо превращениям и создают поэтому значительные экологические проблемы.
Например, простейшие галогенпроизводные метана обратили на себя пристальное внимание в начале 80-х годов прошлого века, когда весь мир заговорил о проблеме озонового слоя, а точнее — об «озоновой дыре». Именно в те годы было обнаружено, что озоновый слой, защищающий все живое на Земле от жесткого УФ-излучения, постепенно истощается. Поскольку речь идет об озоне, содержащемся в стратосфере, проблема его сохранения сразу превратилась в глобальную проблему всего человечества.
Среди различных путей разрушения озонового слоя химики обратили внимание на процессы, протекающие с участием фторхлоруглеродов.
CFCl3 |
CF2Cl2 |
фтортрихлорметан |
дифтордихлорметан |
(хладон-11) |
(хладон-12) |
Эти соединения известны под названием «хладоны». Они негорючи и нетоксичны. В огромных количествах их производят в развитых странах всего мира и применяют в качестве хладоагентов в холодильных установках. Отличительное свойство этих соединений — термическая и окислительная устойчивость. Это положительное свойство фторхлоруглеродов является причиной и их отрицательных качеств. Они неспособны разлагаться в нижних слоях атмосферы (тропосфера) и поэтому достигают стратосферы. Под действием жесткого УФ-излучения фторхлоруглероды подвергаются в стратосфере гомолитической диссоциации:
|
|
• |
• |
CCl3F |
|
CCl2F + Cl |
|
|
|||
Образовавшиеся радикалы вступают в реакцию с озоном — реакцию, которая и ведет к уничтожению озонового слоя:
• |
ClO + O2 |
Cl + O3 |
Согласно международным соглашениям, в последнее десятилетие развитые страны систематически сокращают производство и применение хладонов.
В качестве заменителей фторхлоруглеродов были предложены фторхлоруглеводороды. Они содержат связь С–Н, менее устойчивы и разруша-
ются еще в тропосфере. Однако соединения такого рода относятся к числу парниковых газов; они увеличивают парниковый эффект, который считают

 слабое перекрывание sp
слабое перекрывание sp у аминогруппы и у соседнего атома углерода. Этот результат объясняется равной вероятностью атаки нуклеофила по обоим концам тройной связи дегидробензола:
у аминогруппы и у соседнего атома углерода. Этот результат объясняется равной вероятностью атаки нуклеофила по обоим концам тройной связи дегидробензола:



 O
O  Cl
Cl O
O  Cl
Cl
 Cl
Cl
 OCH
OCH