
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
14.3. Физические свойства и строение |
263 |
Температуры кипения в большей мере зависят от дипольного момента молекулы: изомеры с более высоким дипольным моментом характеризуются более высокой температурой кипения. о-Дихлорбензол, имеющий наиболее полярную молекулу по сравнению с другими изомерами, кипит при более высокой температуре.
|
|
Cl |
|
Cl |
|
Cl |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
Cl |
|
о-дихлорбензол |
м-дихлорбензол п-дихлорбензол |
||||
μ, D |
2,5 |
1,72 |
0 |
|||
Т. кип., °С |
181 |
173 |
170 |
|||
14.3.2.Электронное строение
Как видно из данных табл. 14.1, связи Csp2—Cl укорочены и менее полярны, а следовательно, и более прочны по сравнению со связями Csp3—Cl. То же самое относится и к связям атомов углерода с другими галогенами.
Причиной упрочения связи Csp2—X является наличие сопряжения p-ор- битали НЭП галогена и π-орбиталей двойной углерод-углеродной связи или ароматического ядра. Далее показаны электронные эффекты в винилхлориде и хлорбензоле.
Таблица 14.1. Характеристика связей С–Cl
Соединение |
Длина связи, нм |
Дипольный момент, D |
|
|
|
CH3CH2–Cl |
|
|
этилхлорид |
0,179 |
2,05 |
CH2=CH–Cl |
|
|
винилхлорид |
0,169 |
1,44 |
С6Н5–Cl |
|
|
хлорбензол |
0,169 |
1,58 |
14.4. Реакции |
265 |
14.4.РЕАКЦИИ
Вполном согласии с отмеченными выше характеристиками связей
Csp2—Hal винилгалогениды и галогенарены проявляют пониженную реакционную способность в реакциях, протекающих с разрывом этих связей.
14.4.1.Реакции винилгалогенидов
Характерной особенностью винилгалогенидов является их инертность в реакциях как SN1-, так и SN2-типа. Реакции винилгалогенидов с обычными нуклеофильными реагентами не идут. При повышении температуры в присутствии сильных оснований протекают реакции элиминирования, присоединения и полимеризации.
|
|
|
|
AgNO3 |
не реагируют даже при |
|
|
|
|
H2O, t |
длительном нагревании |
|
|
|
|
|
|
CH2 |
|
CH |
|
Cl |
|
|
|
||||
|
|
|
|||
|
|
винилхлорид |
NaNH2 |
HC |
|
CH |
(реакция |
|
|
|
|
|
элиминирования) |
||
|
|
|
|
|||
|
—HCl |
|||||
|
|
|||||
|
ацетилен |
|
||||
|
|
|
|
|||
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Иногда атом галогена в винилгалогенидах называют «мертвым», имея в виду низкую реакционную способность связи С–Hal в этих соединениях. Химия металлоорганических соединений вносит в это определение поправку. Винилгалогениды оказались способными замещать атом галогена в реакциях с некоторыми металлоорганическими соединениями. Кроме того, винилгалогениды реагируют с магнием в тетрагидрофуране с образованием магнийгалогенидов винильного типа (реакция Нормана, 1954 г.), которые, в свою очередь, имеют разнообразное применение в синтетической практике (подробнее об этом см. в разд. 15.1.4).
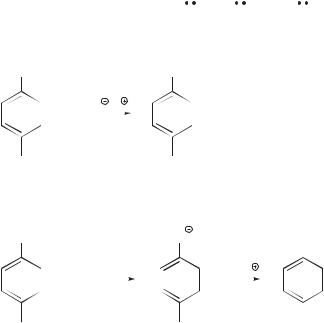
14.4.2.Нуклеофильное замещение галогена в галогенаренах
По сравнению с галогеналканами характерная особенность галогенбензолов состоит в том, что они подвергаются нуклеофильному замещению с большим трудом: под действием очень сильных оснований — нуклеофилов
|
|
|
•• |
|
•• |
(например NH |
, RNH) — или в очень жестких условиях (при температуре |
|
•• |
2 |
•• |
до 300–350 °С и под давлением до 100 атм).
14.4. Реакции |
267 |
При наличии двух или трех электроноакцепторных групп в орто- и пара-положениях реакционная способность галогенбензола еще более возрастает.
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
||||
|
|
NO2 |
|
|
|
|
|
|
|
|
|
NO2 |
|
|||||
|
|
|
|
|
5%-й NaOH |
|
|
H3O |
|
|
|
|||||||
|
|
|
|
H2O, 100—120 °C |
|
|
|
|
|
|
|
|
|
|
||||
NO2 |
|
|
|
|
|
|
NO2 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2,4-динитрохлорбензол |
|
|
|
|
|
|
2,4-динитрофенол |
|||||||||||
F |
|
|
|
|
|
|
|
|
|
NH |
|
CH3 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
NO2 |
|
|
|
|
|
|
|
|
NO2 |
|
||||||
|
|
|
|
|
CH3NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
(этанол), t |
|
|
|
|
|
|
|
|
|
|
|
|
||
NO2 |
|
|
|
|
|
|
NO2 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
2,4-динитрофторбензол |
N-метил-2,4-динитроанилин |
|
||||||||||||||||
|
|
Cl |
|
|
|
|
|
|
|
|
|
OH |
|
|||||
O2N |
|
NO2 |
|
|
|
|
|
|
O2N |
NO2 |
||||||||
|
|
|
|
|
5%-й NaOH H3O |
|
|
|||||||||||
|
|
|
|
|
|
H2O, 60 °C |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
NO2 |
|
|
|
|
|
|
|
|
|
NO2 |
|
|||||
2,4,6-тринитрохлорбензол |
|
|
|
|
|
|
2,4,6-тринитрофенол |
|||||||||||
Реакции протекают без перегруппировок и описываются кинетическим уравнением второго порядка:
w = k2[Ar–X][Nu:].
Это уравнение соответствует бимолекулярному характеру переходного состояния, отвечающего наиболее медленной стадии реакции.
Реакции нуклеофильного замещения галогена в активированных галогенаренах обозначают символом SNAr.
Задача 14.1. Завершите следующую реакцию:
Cl
 NO2 NH2NH2, C2H5OH
NO2 NH2NH2, C2H5OH
t
NO2
Назовите продукт реакции.
268 |
Глава 14. Галогеналкены и галогенарены |
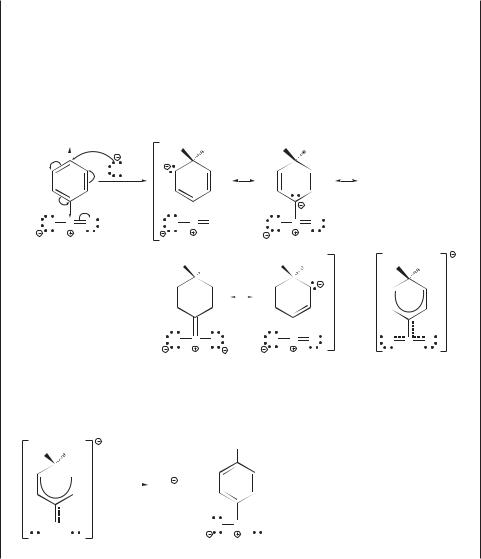
Механизм нуклеофильного замещения SNAr
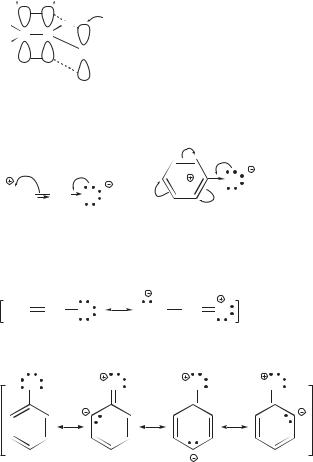
Стадия 1 — наиболее медленная стадия всей реакции — присоединение нуклеофильного реагента к атому углерода ароматического кольца, связанному с галогеном. Реакция идет через σ-комплекс, формально аналогичный тому, который образуется в реакциях электрофильного ароматического замещения. Однако в реакциях SNAr этот комплекс имеет отрицательный заряд.
Электроноакцепторные заместители, находящиеся в орто- или пара-положе- нии к атому галогена и способные к делокализации отрицательного заряда, увеличивают устойчивость промежуточного σ-комплекса и тем самым — скорость реакции замещения.
Cl |
Cl OH |
Cl OH |
|
||
|
OH |
|
|
медленно |
|
O N O |
O N O |
O N O |
4-нитрохлорбензол
Cl OH |
|
Cl OH |
|
Cl OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O N O |
O N O |
O N O |
наиболее стабильная резонансная структура σ-комплекса
Стадия 2 — быстрая стадия — отщепление галогенид-иона и реароматизация ароматического ядра с образованием продукта реакции:
OH
Cl OH
быстро
Cl +
 O
O N
N O
O
 O N
O N O
O
4-нитрофенол
Согласно указанной последовательности стадий, реакции нуклеофильного замещения SNAr протекают по механизму присоединения–отщепления:
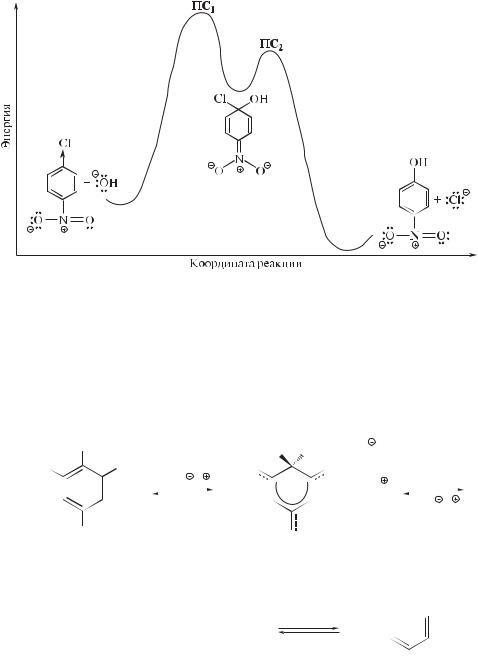
на первой стадии нуклеофил присоединяется к субстрату с образованием σ-комплекса, на второй стадии галогенид-ион отщепляется с образованием продукта замещения. Энергетическая диаграмма реакции представлена на рис. 14.1.

270 |
Глава 14. Галогеналкены и галогенарены |
Реакционная способность активированных галогенаренов
Активность галогенаренов в реакциях SNAr, как правило, снижается в ряду: Ar–F > Ar–Cl > Ar–Br > Ar–I.
Это объясняется способностью галогена за счет –I-эффекта стабилизировать промежуточный σ-комплекс и, следовательно, понижать энергию активации скоростьлимитирующей стадии.
Изучение реакций нуклеофильного ароматического замещения по механизму присоединения–отщепления иллюстрирует относительность определений «активирующий заместитель» и «дезактивирующий заместитель».
Нитрогруппа является сильным активирующим заместителем в нуклеофильном ароматическом замещении, поскольку стабилизирует отрицательно заряженный промежуточный σ-комплекс, находясь в орто- или пара- положении к атому галогена в молекуле субстрата.
В то же время нитрогруппа является сильным дезактивирующим мета- ориентантом в электрофильном ароматическом замещении, поскольку она в большей степени дестабилизирует промежуточные σ-комплексы, отвечающие атаке электрофильного реагента в орто- и пара-положения субстрата (подробнее об этом см. в разд. 9.3 и 9.4).
Задача 14.2. Завершите следующие реакции:
|
OCH3 |
|
|
|
|
|
O2N |
|
NO2 |
|
|
HCl |
|
|
|
+ C2H5O Na |
|
... |
... |
|
|
|
|
|
|||
|
NO2 |
|
|
|
|
|
Нуклеофильное замещение галогена в неактивированных галогенаренах
Галогенарены, не содержащие заместителей или содержащие электронодонорные заместители (неактивированные галогенарены), реагируют лишь с
очень сильными нуклеофилами-основаниями ( NH2 ) или в очень жестких условиях — с водными растворами щелочей при нагревании под давлением. Особенностью этих реакций является то, что соединения, содержащие электронодонорные заместители, реагируют с образованием двух или трех изомеров.
Ниже приведены примеры реакций нуклеофильного замещения галогена в неактивированных галогенаренах.

 2ClCH
2ClCH H
H 2
2
 OH, CH
OH, CH , C
, C , C
, C , NH
, NH

 NO
NO