
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf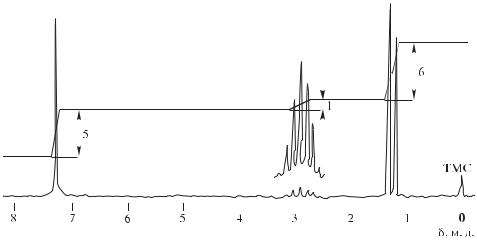
12.5. Спектроскопия ядерного магнитного резонанса |
191 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12.34. Спектр ПМР соединения С9Н12 (к задаче 4)
Следовательно, на рис. 12.34 приведен ПМР-спектр кумола (изопропилбензол):
СН3
С6Н5–СН–СН3
Несмотря на то, что пять ароматических протонов неэквивалентны, из-за близких значений химических сдвигов они дают одиночный сигнал 7,25 м. д. в области слабого поля по причине вторичного магнитного поля в бензольном кольце (см. рис. 12.25). Наличие в спектре дублета и септета относительной интенсивности 6 : 1 характерно для изопропильной группы.
12.5.3.Спектроскопия ядерного магнитного резонанса на ядрах 13С
Спектры ПМР дают информацию об углеродных атомах молекулы косвенным образом, а именно через значения химических сдвигов и характер расщепления сигналов протонов.
Вместе с тем, как уже выше было отмечено, для целей идентификации органических соединений в последние годы с успехом применяется спектроскопия ЯМР на ядрах 13С. Преимущество спектроскопии 13С ЯМР состоит в том, что она измеряет химические сдвиги атомов углерода и тем самым дает прямую информацию об углеродном скелете молекулы.
Спектры 13С ЯМР регистрируют на значительно более совершенных спектрометрах, поскольку содержание изотопа 13С, имеющего ненулевой ядерный магнитный момент и обеспечивающего сигнал в спектре, составляет лишь 1,1% от изотопа 12С, имеющего нулевой ядерный магнитный момент и неактивного в методе ЯМР. Такие более совершенные спектромет-

192 |
Глава 12. Введение в органический синтез |
ры ЯМР снабжены средствами для накопления слабых сигналов. В этом случае, однако, продолжительность получения стандартного спектра может составлять от нескольких часов до нескольких суток. При этом возрастает и масса образца, требуемого для получения стандартного спектра 13С ЯМР.
Наиболее совершенные ЯМР-спектрометры снабжены преобразователями Фурье, что существенно упрощает регистрацию спектров 13С ЯМР.
Информативность спектров 13С ЯМР для целей идентификации органических соединений иллюстрируют следующие примеры.
Рис. 12.35. Спектры 1Н (а) и 13С (б) ЯМР 1-хлорпентана

12.5. Спектроскопия ядерного магнитного резонанса |
193 |
На рис. 12.35 показаны спектры 1Н и 13С ЯМР 1-хлорпентана. По внешнему виду спектр 13С ЯМР заметно отличается от спектра ПМР. В отличие от спектра ПМР сигналы в спектре 13С ЯМР представляют собой одиночные линии. Отсутствие расщепления сигналов углерода на соседних протонах достигается применением достаточно сильного магнитного поля (не ниже 250 МГц). В таких условиях записи спектра ядра протонов постоянно возбуждены и не могут резонировать с энергетическими переходами углеродных ядер. Число линий в спектре соответствует числу неэквивалентных атомов углерода в молекуле. В спектре 1-хлорпентана число таких неэквивалентных атомов равно пяти, вследствие чего и в спектре 13С ЯМР имеется пять одиночных линий.
Следует обратить внимание на хорошее разрешение сигналов в спектре 13С ЯМР. Его сигналы перекрывают обычно 30 м. д., в то время как расщепленные сигналы спектра ПМР перекрывают область лишь 3 м. д.
Таким образом, подсчет числа неэквивалентных атомов углерода в молекуле прямо определяет число сигналов в спектре 13С ЯМР. Для примера ниже приведена оценка числа линий в спектре 13С ЯМР изопропилбензола.
м- о-
CH3
п-  CH
CH
м- о- CH3
Молекула этого углеводорода содержит шесть неэквивалентных углеродных атомов, вследствие чего в спектре 13С ЯМР следует ожидать появления шести линий, что и наблюдается в спектре.
Химические сдвиги в спектрах 13С ЯМР измеряют относительно положения сигнала атомов углерода в спектре тетраметилсилана. В табл. 12.7 приведены значения химических сдвигов некоторых углеродных атомов.
Таблица 12.7. Значения химических сдвигов некоторых углеродных атомов
Тип атома углерода |
Химический сдвиг δ, м. д. |
Тип атома углерода |
Химический сдвиг δ, м. д. |
|||
|
|
|
|
|
|
|
RCH3 |
0–35 |
|
|
|
100–150 |
|
R2CH2 |
15–40 |
C |
|
|
C |
|
|
|
|||||
|
|
|
|
|||
RCH2Br |
20–40 |
|
|
|
|
|
R3CH |
25–50 |
|
|
|
|
110–175 |
|
|
|
|
|||
RCH2Cl |
25–50 |
|
|
|
|
|
RCH2NH2 |
35–50 |
C |
|
O |
190–220 |
|
RCH OH |
50–65 |
|
||||
|
|
|
|
|||
2 |
|
|
|
|
|
|
–С≡С– |
65–90 |
|
|
|
|
|
|
|
|
|
|
|
|
194 |
Глава 12. Введение в органический синтез |
|
Рис. 12.36. Спектр 13С ЯМР |
|
1-цис,3-цис,5-триметилцикло- |
|
гексана |
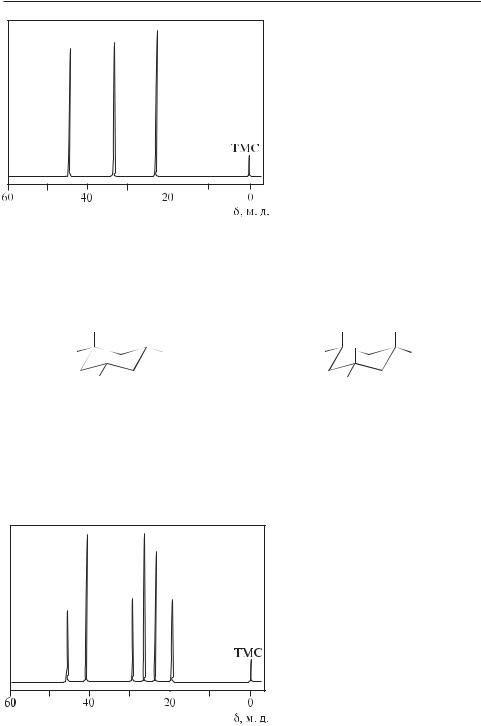
Высокая информативность спектров 13С ЯМР для идентификации сложных органических соединений иллюстрируется ниже сравнением спектров двух диастереомерных 1,3,5-триметилциклогексанов.
H |
H |
H |
CH3 |
1H |
3 |
H |
|
CH3 |
CH3 |
CH3 |
H |
5 |
|
|
|
CH3 |
|
CH3 |
|
1-цис,3-цис,5-триметилциклогексан |
1-цис,3-транс,5-триметилциклогексан |
||
На рис. 12.36 и 12.37 показаны их спектры 13С ЯМР. Только три одиночные линии наблюдаются в спектре 1-цис,3-цис,5-триметилциклогексана (рис. 12.36). В то же время спектр 1-цис,3-транс,5-триметилциклогексана, имеющего более низкую симметрию (рис. 12.37), содержит шесть линий.
Рис. 12.37. Спектр 13С ЯМР 1-цис,3-транс,5-триметилцикло- гексана

12.6. Масс-спектроскопия |
195 |
12.6.МАСС-СПЕКТРОМЕТРИЯ
Рассмотренные выше методы спектроскопии (ИК-, УФ-, ЯМР-спектро- скопия) основаны на избирательном поглощении веществом электромагнитного излучения. Молекула вещества при записи указанных спектров не разрушается. В отличие от этих спектральных методов масс-спектрометрия основана на разрушении молекулы под действием электронного удара и регистрации масс полученных осколков.
При бомбардировке молекулы органического соединения электронами с энергией, несколько большей, чем значение первого потенциала ионизации вещества (~10 эВ), происходит отрыв электрона от молекулы.
М |
+ e |
|
М |
|
|
|
+ |
2e |
|
|
|
|
|||||||
|
|
||||||||
молекула |
электрон |
|
молекулярный ион |
два |
|
||||
|
|
|
(катион-радикал) |
электрона |
|
||||
|
|
|
|
|
|
|
|
• |
— молекуляр- |
Этот процесс называют ионизацией, а образующийся ион М0 |
|||||||||
|
|
|
|
|
|
|
|
+ |
|
ным ионом. Молекулярный ион является катион-радикалом, положительно заряжен и имеет нечетное количество электронов. (Сравните с образованием молекулярных катион-радикалов в методе ФЭС, т. I, разд. 1.10.1.) Масса молекулярного иона практически равна массе молекулы, из которой он образуется.
Если бомбардировать молекулу электронами с энергией, значительно превышающей первый потенциал ионизации (обычно используют 70 эВ), то образующийся молекулярный ион получает энергию, достаточную для разрыва
в нем химических связей. Это приводит к распаду молекулярного иона на более мелкие фрагменты (осколочные ионы, радикалы). Такой процесс называют фрагментацией. Помимо разрыва связей могут протекать внутримолекулярные перегруппировки c образованием перегруппировочных ионов и радикалов. Ниже
суммированы процессы, протекающие при записи масс-спектра. Ионизация — образование молекулярного иона:
ABC + e |
|
|
|
|
ABC |
|
|
|
|
+ |
2e |
|||||
|
|
|
|
|||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
молекулярный |
|
||||||
|
|
|
|
|
|
|
|
|
|
ион |
|
|
||||
Фрагментация: |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
A |
+ |
BC |
||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
катион |
|
радикал |
||||
|
|
|
|
|
|
|
|
|
|
A |
+ |
BC |
||||
|
|
|
|
|
|
|
|
|
|
|||||||
ABC |
|
|
|
|
|
|
|
|
|
радикал |
|
катион |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулярный ион |
|
|
|
|
AB |
+ |
C |
|||||||||
|
|
|
|
|||||||||||||
катион-радикал |
|
|
|
|
катион |
|
радикал |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
AB + C
+ C
радикал катион
196 |
|
|
|
|
|
|
|
Глава 12. Введение в органический синтез |
Перегруппировки: |
|
|
|
|||||
ABC |
|
|
|
|
|
AC |
+ |
B |
|
|
|
|
|
||||
|
||||||||
катион-радикал |
катион |
|
радикал |
|||||
Таким образом, при бомбардировке молекулы электронами образуется большое количество частиц, как заряженных, так и нейтральных (в том числе радикалов).
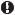 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Масс-спектрометрия позволяет регистрировать лишь заряженные частицы.
Для получения масс-спектра пары вещества в глубоком вакууме (~10–6 мм рт. ст.) бомбардируют потоком электронов с энергией 70 эВ. Образующиеся при распаде молекулы частицы ускоряются сильным электрическим полем и попадают в магнитное поле, в котором нейтральные частицы не изменяют направления движения, а ионы изменяют траекторию своего движения в зависимости от отношения массы к заряду m/z, что позволяет распределить ионы по их массам, определить массы ионов и их количество.
Масс-спектр представляет собой график зависимости интенсивности сигнала от отношения массы к заряду m/z для различных ионов, образующихся при разрушении молекулы. Для примера на рис. 12.38 показан массспектр бензола. Высота пика с максимальной интенсивностью (очевидно, это основной пик, соответствующий наиболее стабильному иону) прини-
Рис. 12.38. Масс-спектр бензола
12.6. Масс-спектроскопия |
197 |
мается равной 100%. Интенсивность остальных пиков выражается в процентах от интенсивности основного пика. Заряд образующихся ионов z обычно равен единице, поэтому отношение m/z совпадает с массой иона. Mасс-спектр может быть представлен не только графически, но и в виде таблицы, содержащей два столбца: значения m/z и относительные интенсивности ионов.
По масс-спектру можно определить молекулярную массу, молекулярную формулу (брутто-формула) и структуру органического соединения.
12.6.1.Определение молекулярной массы и молекулярной формулы
Для определения молекулярной массы соединения необходимо в его массспектре выявить пик молекулярного иона. Значение m/z молекулярного иона соответствует массе молекулярного иона и, следовательно, молекулярной массе исследуемого органического соединения. Так, в масс-спектре бензола (см. рис. 12.38) наиболее интенсивный пик m/z 78 соответствует молекулярному иону М+.
При низкой энергии электронов (~10 эВ) молекулярному иону обычно соответствует наиболее интенсивный пик в масс-спектре. При энергии электронов 70 эВ интенсивность пика молекулярного иона определяется стабильностью молекулярного иона. Как правило, она падает вследствие последующего распада молекулярного иона. В этом случае пик молекулярного иона необязательно наиболее интенсивный в спектре. Если при фрагментации молекулярного иона образуется более устойчивый карбокатион, стабилизированный электронными эффектами, то молекулярный пик имеет низкую интенсивность, а иногда может вообще отсутствовать в масс-спе- ктре. В полном соответствии с теорией строения органических соединений наиболее стабильными являются молекулярные ионы ароматических соединений, а наименее стабильными — молекулярные ионы аминов, карбоновых кислот и спиртов. Для выявления молекулярного пика в случае малой его интенсивности необходимо иметь в виду, что соединения,
содержащие элементы С, Н, О, S, галогены, имеют четное массовое число. В этом случае действует азотное правило.
Если в молекуле содержится нечетное число атомов азота, то массовое число молекулярного иона является нечетным. Если в молекуле содержится четное число атомов азота, то массовое число молекулярного иона оказывается четным.
В масс-спектре бензола (рис. 12.38) наблюдается пик малой интенсивно-
сти с массовым числом (М+1)0•, на единицу большим массового числа мо-
+
лекулярного иона. Это объясняется присутствием изотопов 13С и 2Н.
198 |
|
Глава 12. Введение в органический синтез |
|
|
Таблица 12.8. Изотопный состав некоторых элементов |
||
|
|
|
|
|
Элемент |
Соотношение изотопов |
|
|
|
|
|
|
Углерод |
12С : 13С = 100 : 1,08 |
|
|
Водород |
1Н : 2Н = 100 : 0,016 |
|
|
Азот |
14N : 15N = 100 : 0,38 |
|
|
Кислород |
16О : 17О : 18О = 100 : 0,04 : 0,20 |
|
|
Сера |
32S : 33S : 34S = 100 : 0,78 : 4,40 |
|
|
Хлор |
35Cl : 37Cl = 100 : 32,5 |
|
|
Бром |
79Вr : 81Br = 100 : 98,0 |
|
Как известно, большинство элементов неоднородно по изотопному составу. Об этом свидетельствуют и данные табл. 12.8.
Большая часть молекул бензола содержит только атомы 12С и 1Н, что соответствует молекулярной массе, равной 78. Изотопная разновидность бензола, которая вместо одного атома 12С содержит атом 13С, имеет молекулярную массу 79. Согласно данным табл. 12.8, на каждые 100 молекул бензола с массой 78 приходится 6,48 (1,08 6) молекул бензола, содержащих один атом 13С. Шесть атомов углерода в молекуле бензола увеличивают в 6 раз вероятность появления молекулы бензола, содержащей атом 13С.
Изотопная разновидность бензола, которая вместо одного атома 1Н содержит атом 2Н, также имеет молекулярную массу 79. Но таких молекул очень мало. На 100 молекул бензола с массой 78 приходится ~0,1 (0,016 6) «молекул» бензола с одним атомом 2Н.
12C |
1H |
6 |
13C12C |
1H |
6 |
12C |
2H1H |
5 |
6 |
|
5 |
|
6 |
|
|||
1 |
|
2 |
|
|
|
3 |
|
|
M = 78 |
М = 79 |
|
M = 79 |
|
||||
Таким образом, соотношение изотопных разновидностей бензола 1 : 2 : 3 = = 100 : 6,48 : 0,1.
Следовательно, в масс-спектре бензола (см. рис. 12.38) помимо пика мо-
лекулярного иона М+ (m/z 78) будет наблюдаться пик (М + 1)0• (m/z 79) c ин-
+
тенсивностью 6,58% (6,48 + 0,1) от интенсивности пика молекулярного иона. Естественно, что не только пик молекулярного иона, но и все пики в масс-спектре бензола сопровождаются малоинтенсивным пиком с массовым числом на единицу большим. В масс-спектре бензола наблюдается и
пик (М + 2)0•, но интенсивность его мала (0,18 %).
+
Молекулярная масса СН3Br равна 12 + 3 + 80 = 95, однако в масс-спек- тре бромметана нет пика m/z 95 (рис. 12.39), а вместо него наблюдаются два

12.6. Масс-спектроскопия |
199 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12.39. Масс-спектр бромметана
пика с m/z 94 и 96. Это объясняется тем, что бромметан существует в виде изотопных модификаций 1 (c изотопом 79Br) и 2 (c изотопом 81Br).
CH 79Br |
CH 81Br |
3 |
3 |
1 |
2 |
М = 94 |
М = 96 |
Соотношение изотопов 79Br : 81Br равно 100 : 98,0 (табл. 12.8), поэтому интенсивность пика m/z 94 несколько больше. Молекулярным ионом в этом случае считают ион, который образуется при отрыве электрона от молекулы, содержащей наиболее распространенный изотоп каждого элемента
(для бромметана — это изотопная модификация 1). Поэтому пик m/z 94 яв- |
|
• |
• |
ляется пиком молекулярного иона М0, а пик m/z 96 — пиком (M + 2)0. Его |
|
+ |
+ |
масса равна массе молекулярного иона плюс две единицы.
Атомная масса брома, равная 80 и используемая в стехиометрических расчетах, является средним значением массы атома брома, найденным с учетом распространенности изотопов брома в природе. Поскольку массспектрометр регистрирует реально существующие ионы, содержащие тот или иной изотоп, то обнаружить в масс-спектре пики, соответствующие ионам с усредненной массой изотопов, невозможно.
Хлор, так же как и бром, существует в виде двух стабильных изотопов 35Cl и 37Cl, отличающихся двумя единицами массы. В масс-спектре соеди-
нения с одним атомом хлора помимо пика молекулярного иона М0•, содер-
+
жащего только атом 35Cl, появляется пик иона (М + 2)0•, содержащего 37Cl.
+
200 |
|
|
|
|
|
|
|
|
Глава 12. Введение в органический синтез |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 12.40. Масс-спектр 2-хлорпропана
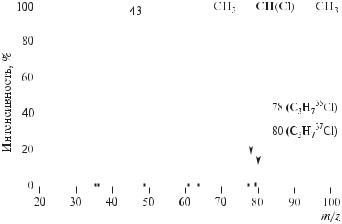
Поскольку соотношение изотопов 35Cl : 37Cl равно 100 : 32,5 (см. табл.12.8), |
||
• |
|
|
то интенсивность пика (М + 2)0составляет примерно одну треть интенсив- |
||
+ |
|
|
ности молекулярного пика (рис. 12.40). |
|
|
• |
• |
определяются элементным со- |
Интенсивности пиков (М + 1)0 |
и (М + 2)0 |
|
+ |
+ |
|
ставом соединения, естественным содержанием и массой изотопов, входящих
в состав молекулы. Поэтому, определив по масс-спектру массу молекулярно- |
||
• |
• |
• |
го иона М0 |
и относительную интенсивность пиков (М + 1)0, (М + 2)0, можно |
|
+ |
+ |
+ |
узнать молекулярную (брутто-) формулу соединения по таблицам Бейнона (Сильверстейн Р., Вебстер Ф., Кимл Д. Спектрометрическая идентификация органических соединений. М.: Бином. Лаборатория знаний, 2011. 557 с.).
Например, сравнив относительную интенсивность пиков (М + 1)0•,
+
• |
, можно различить (табл. 12.9) соединения CH2O2, CH6N2 и |
|||||||||
(М + 2)0 |
||||||||||
+ |
|
|
|
|
|
|
|
|
|
|
C2H6O, имеющие одинаковое значение массового числа. |
|
|
||||||||
Таблица 12.9. |
|
• |
46 |
|
|
|
|
|
|
|
Изотопные пики для М0 |
|
|
|
|
|
|
||||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Брутто-формула |
|
Соединение |
|
|
Интенсивность, % |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
• |
|
• |
|
• |
|
|
|
|
|
|
М0 |
|
(М + 1)0 |
|
(М + 2)0 |
|
|
|
|
|
|
+ |
|
+ |
|
+ |
|
СН2О2 |
|
|
Муравьиная кислота |
|
100 |
|
1,19 |
|
0,40 |
|
CH6N2 |
|
|
Метилгидразин |
|
100 |
|
1,94 |
|
0,01 |
|
С2Н6О |
|
|
Этанол, диметиловый эфир |
100 |
|
2,30 |
|
0,22 |
|
|
