
15.1. Металлоорганические соединения |
291 |
По тем же причинам диалкильные производные магния существуют как полимеры, содержащие трехцентровые двухэлектронные связи (о природе этих связей см. в т. I, гл. 2, разд. «Для углубленного изучения», стр. 158).
 R
R  R
R
 R
R
Mg Mg Mg Mg
 R
R
 R
R
 R
R
Электронная конфигурация инертного газа у атома металла может достигаться за счет взаимодействия с молекулами растворителя. Например, реактивы Гриньяра в разбавленном растворе диэтилового эфира существуют как мономеры, координированные с двумя молекулами растворителя (С2Н5)2О.
R O(C2H5)2
O(C2H5)2
Вболее концентрированных растворах реактивы Гриньяра находятся в виде димеров с двумя мостиковыми атомами брома.
(C2H5)2O
 Br
Br CH3
CH3
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
В металлоорганических соединениях мы видим еще один пример ковалентного связывания — трехцентровая двухэлектронная связь. Этот тип ковалентной связи предполагает, что связывание между тремя соседними центрами обеспечивают два электрона аналогично тому, как это имеет место в карбониевых ионах (см. т. I, стр. 158).
Соединения R—Li также сильно ассоциированы в растворе, причем степень их ассоциации зависит как от растворителя, так и от строения R. Например, в растворах углеводородов C4H9—Li присутствует в виде гексамера, а в диэтиловом эфире — в виде тетрамера. Бензиллитий в бензоле является димером, а в тетрагидрофуране — мономером. В димерах (R—Li)2 углерод пентакоординирован
R
Li Li
R
Связь между атомами лития и углеродом является трехцентровой двухэлектронной связью.

292 |
Глава 15. Элементоорганические соединения |
15.1.4.Реакции
Вследствие значительной полярности связи С–М металлоорганические соединения вступают преимущественно в реакции, сопровождающиеся наведением отрицательного заряда на атоме углерода и последующим гетеролитическим разрывом его связи с атомом металла. Ниже представлены два основных типа этих реакций.
1.Реакции, в которых металлоорганические соединения выступают как сильные основания.
2.Реакции, в которых металлоорганические соединения выступают как нуклеофильные реагенты.
Большая часть реакций рассмотрена на примере реактивов Гриньяра и литийорганических соединений как наиболее часто применяемых в органическом синтезе. Возможности применения других металлоорганических соединений в аналогичных реакциях обсуждаются в последующих разделах курса.
Магний- и литийорганические соединения
При проведении реакций с Mg- и Li-органическими соединениями важную роль играет выбор растворителя. Диэтиловый эфир и тетрагидрофуран, почти исключительно применяемые для реакций с участием магнийорганических соединений, увеличивают их реакционную способность за счет снижения степени ассоциации и повышения ионизации связи угле- род—магний. Такое же влияние простые эфиры оказывают и на литийорганические соединения, при этом, однако, медленно реагируют с ними. Оптимальными растворителями для получения и применения литийорганических соединений считаются бензол и петролейный эфир, иногда с добавлением незначительного количества простого эфира.
'
ОСНOВНЫЕ РЕАКЦИИ
Реактивы Гриньяра, как и другие металлоорганические соединения, являются сильными основаниями. Они способны отщеплять протон от любых соединений, кислотность которых выше кислотности углеводородов согласно следующей общей схеме:
δ δ
δ
R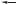 MgX + H B
MgX + H B  R H + B MgX
R H + B MgX

15.1. Металлоорганические соединения |
293 |
Далее даны примеры реакций метилмагнийиодида с различными OH-, NH-, SH- и CH-кислотами.
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
CH4 |
+ MgI(OH) |
|
|
|
|
R |
|
|
|
|
O |
|
|
H, спирт |
|
|
|
|
|
|
|
|
|
|
CH4 |
+ ROMgI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
R |
|
|
C |
OH |
, карбоновая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
CH4 |
+ R |
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3MgI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgI |
|
|
|
|
NH3, аммиак |
CH4 |
+ NH2MgI |
|
|
|
метилмагний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
иодид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R NH2, амин |
|
CH4 |
+ RNHMgI |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
SH, тиол |
|
|
|
|
|
|
|
|
|
CH4 |
+ |
R |
|
|
|
S |
|
MgI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
C |
|
|
C |
|
|
H, алкин |
|
|
|
|
|
|
|
|
|
|
|
|
CH4 |
+ |
R |
|
|
|
C |
|
|
|
C |
|
MgI |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Каждая из этих реакций протекает количественно и имеет аналитическое применение для качественного (по выделению газообразного мета-
на) и количественного определения подвижного водорода в органических соединениях (метод Чугаева–Церевитинова). Путем измерения объема
метана, выделившегося при взаимодействии метилмагнийиодида с определенным количеством анализируемого соединения, вычисляют число молей подвижного водорода в образце.
Реакции реактивов Гриньяра как сильных оснований имеют и синтетическое применение. Реакцию Гриньяра применяют, например, для восстановления галогеналканов и галогенаренов до углеводородов:
(CH ) C |
|
|
Br |
|
Mg |
(CH ) C |
|
MgBr |
H2O |
|
(CH ) CH + MgBr(OH) |
|
|
|
|
|
|
|
|
абс. эфир |
|
|
3 3 |
|
|
|
3 3 |
|
|
|
3 3 |
|
|
трет-бутил- |
|
|
|
|
трет-бутил- |
|
|
|
изобутан |
|
|
бромид |
|
|
|
|
магнийбромид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mg |
|
|
|
|
|
|
|
H2O |
|
C2H5 |
|
Br |
|
|
C2H5 |
|
|
|
MgBr |
|
|
абс. эфир |
|
|
|
|
|
|
п-этилбромбензол |
|
|
|
|
п-этилфенилмагний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бромид |
|
|
C2H5

 + MgBr(OH)
+ MgBr(OH)

294 Глава 15. Элементоорганические соединения
С использованием реактивов Гриньяра можно получать дейтерированные углеводороды
(CH ) CH |
|
Br |
|
Mg |
(CH ) CH |
|
MgBr |
D2O |
|
|
|
|
|
|
|
|
|
абс. эфир |
|
3 2 |
|
|
|
|
|
|
3 2 |
|
|
|
|
|
|
|
|
|
|
|
|
изопропил- |
|
|
|
|
изопропилмагний- |
бромид |
|
|
|
|
бромид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH3)2CHD + MgBr(OD) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-дейтеропропан |
и металлические производные алкинов |
CH3 |
|
C |
|
|
C |
|
H |
|
CH3MgBr |
CH4 + CH3 |
|
C |
|
|
|
C |
|
|
MgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропин |
|
|
|
|
|
|
пропинилмагний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бромид |
Аналогично проявляют оснóвные свойства и литийорганические соединения. Как и реактивы Гриньяра, они реагируют со всеми кислотами, более сильными, чем насыщенные углеводороды:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н-C4H9 |
|
Li + H2O |
|
|
н-C4H10 + LiOH |
|
|
бутиллитий |
|
|
|
|
|
|
|
|
бутан |
C2H5 |
|
Li + H |
|
C |
|
C |
|
CH3 |
|
C2H6 + Li |
|
C |
|
C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
этиллитий |
пропин |
|
этан пропиниллитий |
НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ
Реакции нуклеофильного замещения. В таких реакциях алкилмагнийгалогениды весьма инертны и реагируют с алкилгалогенидами по схеме реакций SN2 очень медленно. Вместе с тем аллил- и бензилгалогениды легко реагируют с алкил- и винилмагнийгалогенидами:
|
δ |
|
δ |
|
|
|
|
|
|
δ |
|
δ |
CH CH |
|
MgBr |
+ CH |
|
CH |
|
CH |
|
Br |
абс. эфир |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
этилмагнийбромид |
|
|
аллилбромид |
|
|
|
|
|
|
|
|
CH2 |
|
CH |
|
CH2 |
|
CH2 |
|
CH3 + MgBr2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-пентен |
CH2 CH MgBr + CH2
CH MgBr + CH2 CH CH2Br ТГФ
CH CH2Br ТГФ 
винилмагнийбромид аллилбромид
 CH2
CH2 CH CH2 CH
CH CH2 CH CH2 + MgBr2
CH2 + MgBr2

15.1. Металлоорганические соединения |
295 |
Аллилциклопентан. К реактиву Гриньяра, приготовленному из бромциклопентана (74,5 г; 0,5 моль) и магниевых стружек (12,5 г; 0,51 моль) в безводном эфире (300 мл), при кипении и по каплям прибавляют аллилбромид (60,5 г; 0,5 моль). Через 2 ч прибавляют к смеси холодную 6 н. HCl. Органический слой отделяют, промывают и сушат. Продукт выделяют перегонкой, т. кип. 121–125 °С. Выход 70%.
Собственно литийорганические соединения также малоактивны в реакциях с алкилгалогенидами, однако такие реакции активно протекают в присутствии солей меди (см. ниже). Напротив, ацетилениды лития весьма активно реагируют с первичными галогеналканами:
абс. эфир
н-C4H9 Br + Li C C CH3
C CH3  н-C4H9 C
н-C4H9 C C CH3 + LiBr
C CH3 + LiBr
бромбутан |
пропиниллитий |
2-гептин |
Реакции нуклеофильного присоединения. Вследствие значительной поляризации карбонильной группы карбонилсодержащие соединения, и прежде всего альдегиды и кетоны, активно реагируют с реактивами Гриньяра по схеме реакций AdN (подробнее см. в т. II, разд. 19.1.4, стр. 452):
C O + R
O + R MgX
MgX  R C OMgX
R C OMgX
В результате реакций образуются смешанные магниевые соли, из которых путем кислотного гидролиза выделяют различные спирты.
Ниже даны примеры синтеза первичных, вторичных и третичных спиртов с применением реактивов Гриньяра.
Реакции с формальдегидом дают первичные спирты:
H δ |
|
δ |
абс. эфир |
|
H2O |
C |
|
O + CH3CH2MgBr |
CH3CH2CH2OMgBr |
|
|
|
|
|
HCl |
H |
|
этилмагний- |
|
пропоксимагний- |
|
|
|
бромид |
|
бромид |
|
формальдегид |
|
|
|
 CH3CH2CH2OH + MgBrCl
CH3CH2CH2OH + MgBrCl
296 Глава 15. Элементоорганические соединения
В реакциях реактивов Гриньяра с другими альдегидами образуются вторичные спирты:
|
δ |
Oδ |
+ CH3CH2MgBr |
абс. эфир |
CH3 |
H2O |
CH3 |
|
C |
|
CH |
|
OMgBr |
|
|
|
|
HCl |
|
|
H |
этилмагний- |
|
CH3CH2 |
|
ацетальдегид |
бромид |
|
2-бутоксимагний- |
|
|
|
|
|
|
бромид |
|
CH3
CH OH + MgBrCl
CH3CH2
2-бутанол
Реакции реактивов Гриньяра с кетонами дают третичные спирты:
CH3 |
δ |
δ |
|
|
|
|
|
абс. эфир |
|
|
|
|
|
CH3 |
|
H2O |
+ CH3CH2MgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
O |
|
|
CH3CH2 |
|
C |
|
OMgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
NH4Cl |
|
|
|
|
этилмагний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
ацетон |
|
|
бромид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3CH2 |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-метил-2-бутанол |
CH3 |
δ |
δ |
|
|
|
|
|
|
абс. эфир CH |
|
|
|
|
|
|
CH3 |
|
|
|
H2O |
+ CH |
|
CH |
|
MgBr |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
O |
|
|
|
|
|
C |
|
OMgBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
NH4Cl |
|
|
|
|
винилмагний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
ацетон |
|
бромид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3
 CH2
CH2 CH C OH
CH C OH
CH3
15.1. Металлоорганические соединения |
297 |
Аналогично с реактивами Гриньяра реагирует диоксид углерода. Эта реакция лежит в основе одного из препаративных методов синтеза карбоновых кислот:
CH3CH2MgBr + O |
|
δ δ |
абс. эфир |
|
|
O |
|
C |
|
O |
|
CH3CH2 |
|
C |
|
|
|
|
|
|
|
этилмагний- |
|
|
|
OMgBr |
бромид |
|
|
|
|
C6H5MgBr + O |
|
δ δ |
абс. эфир |
|
|
O |
|
C |
|
O |
|
C6H5 |
|
C |
|
|
|
|
|
|
|
фенилмагний- |
|
|
|
OMgBr |
бромид |
|
|
|
|
O
OH
бензойная кислота
Реактивы Гриньяра могут быть применены и для создания альдегидной группы. Например, обработка реактива Гриньяра триалкилортоформиатом
ведет к получению ацеталя, гидролизом которого становится доступен соответствующий альдегид (метод Зелинского):
R MgX + HC(OR')3  R CH(OR')2 H3O
R CH(OR')2 H3O  R CHO
R CHO
Литийорганические соединения, как и реактивы Гриньяра, способны вступать во все перечисленные выше реакции типа АdN, в том числе с участием пространственно затрудненных кетонов:
[(CH3)3C]2C |
|
O + |
(CH3)3C |
|
Li |
|
[(CH3)3C]3C |
|
OH |
|
|
|
|
|
|
бис(трет-бутил)кетон |
трет-бутил- |
|
трис(трет-бутил)карбинол |
|
|
|
литий |
|
|
|
|
Аналогичную реакцию с участием реактива Гриньяра провести не удается. Легкость протекания и близкие к количественным выходы продуктов реакций присоединения металлоорганических реагентов к карбонильным соединениям приводят к предположению о том, что роль атома металла в этих реакциях более значительна, чем простое связывание с атомом кислорода в конечном аддукте. Полагая возможность реализации циклических переходных состояний в указанных превращениях, можно предполагать,

298 |
Глава 15. Элементоорганические соединения |
что атом металла как кислота Льюиса поляризует карбонильную группу, повышает электрофильность ее С-атома и активирует, тем самым, к взаимодейстию с нуклеофильным фрагментом металлоорганического соединения, например, в таком четырехчленном переходном состоянии:
 О
О MgX
MgX
R
Магний- и литийорганичсекие соединения заметно различаются и реакциями с α,β-ненасыщенными карбонильными соединениями (подробнее об этом см. в т. II, разд. 19.2.4).
Задача 15.2. Применив ретросинтетический анализ, предложите по две схемы получения каждого из следующих соединений с участием реактивов Гриньяра:
а) 2-гексанол; б) 2-фенил-2-пропанол.
ОКИСЛЕНИЕ
Бóльшая часть металлоорганических соединений окисляется под действием кислорода воздуха. Соединения натрия и калия реагируют столь активно, что самовоспламеняются на воздухе. Окисление соединений менее активных металлов также затрудняет их препаративное применение.
R MgX + O2  ROOMgX H2O, H
ROOMgX H2O, H  R OH + Mg(OH)X
R OH + Mg(OH)X
По этим причинам все работы с металлоорганическими соединениями рекомендуется проводить в инертной атмосфере (азот или аргон). Полезно иметь в виду, что при получении реактивов Гриньяра «защитную подушку» создают пары кипящего эфира.
Натрийорганические соединения
Одним из способов получения натрийорганических соединений является реакция натрия с ртутьорганическими соединениями:
|
|
|
|
|
|
δ |
|
δ |
CH3 |
|
Hg |
|
CH3 + 2Nа |
|
2H3C |
|
Na + Hg |
|
|
|
|
|
диметилртуть |
|
метилнатрий |
Поскольку связь натрия с углеродом является практически ионной, натрийорганические соединения могут быть изображены в виде ионных пар:

15.1. Металлоорганические соединения |
299 |
Натрийорганические соединения химически чрезвычайно активны: легко реагируют с влагой воздуха, на воздухе самовоспламеняются, а при низкой температуре разлагают даже простые эфиры. Вследствие чрезмерной реакционной способности натрийорганических соединений их применение ограничено соединениями натрия, полученными из углеводородов с повышенной СН-кислотностью, в частности из алкинов.
R |
|
C |
|
CH |
NaNH2 |
R |
|
C |
|
CNa |
|
|
|
|
|
|
|
|
NH (жидк.) |
|
|
|
|
|
алкин |
3 |
|
алкинид натрия |
|
|
|
Ацетилениды натрия широко применяют в органическом синтезе. Они активно вступают как в реакции нуклеофильного замещения по схеме реакций SN2:
δ |
|
δ |
CH3CH2CH2CH2 |
|
Br + NaC |
|
C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1-бромбутан |
|
пропинид натрия |
|
|
|
|
|
|
|
|
C4H9 |
|
C |
|
C |
|
CH3 + NaBr, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-гептин |
так и в реакции нуклеофильного присоединения:
|
|
|
δ |
|
|
|
|
|
|
|
|
ONa |
|
δ |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
C |
|
+ NaC |
|
C |
|
CH3 |
|
CH3 |
|
C |
|
C |
|
C |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
пропинид натрия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
ацетальдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH
CH3 CH C C CH3
C CH3
3-пентин-2-ол
Медьорганические соединения
Медьорганические соединения получают из литийорганических соединений и галогенидов меди(I):
δ |
|
δ |
абс. эфир |
|
|
|
R |
|
Li + CuX |
R |
|
Cu + LiX |
|
–15 ÷ 0 °C |
|
|
Известны только органические соединения одновалентной меди. Они представляют собой бесцветные (или желтоватые) малорастворимые твердые соединения.
300 |
Глава 15. Элементоорганические соединения |
Медьорганические соединения термически нестабильны, легко разлагаются (особенно алкилмедь) по свободнорадикальному механизму с образованием меди и смеси углеводородов:
3C2H5 |
|
Cu |
0 °C |
3Cu + 3[ C2H5] |
|
|
этилмедь |
|
|
3Cu + CH3CH2CH2CH3 + CH2 CH2 + 1/2H2
CH2 + 1/2H2
бутан
Фенилмедь более устойчива и разлагается лишь при нагревании:
2C6H5Cu |
80 °C |
2Cu + C6H5 |
|
C6H5 |
|
|
|
фенилмедь |
|
бифенил |
Медьорганические соединения чувствительны к действию кислорода воздуха, воды, спиртов и кислот. Они являются хорошими нуклеофилами, легко реагируют с галогеналканами и ацилгалогенидами:
|
|
|
|
C2H5Br |
CH3CH2CH3 + CuBr |
|
|
|
|
|
|
CH3 |
|
Cu |
|
|
|
пропан |
|
|
|
|
C6H5COCl |
|
|
|
|
|
|
|
|
метилмедь |
C6H5 |
|
C |
|
CH3 |
+ CuCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O
ацетофенон
Атом меди в медьорганических соединениях образует координационные связи с донорными частицами. Например, алкилмедь взаимодействует с литийорганическими соединениями с образованием литийдиалкилкупратов:
δ |
δ |
R Cu R Li |
R |
Li + R Cu |
Литийдиалкилкупраты проявляют себя как исключительно активные малополярные реагенты и в ряде реакций имеют преимущество перед реактивами Гриньяра и литийорганическими соединениями. В синтетических целях их получают взаимодействием галогенида меди(I) с 2 моль алкиллития в эфире или тетрагидрофуране при низкой температуре:
2н-C4H9 |
|
Li + Cu2I2 |
|
|
|
(н-C4H9)2Cu |
|
Li + LiI |
|
|
|
|
|
|
бутиллитий |
|
|
|
литийдибутилкупрат |
Литийдиалкилкупраты широко применяют для получения углеводородов. Ключевой стадией механизма является нуклеофильная атака молекулы алкилгалогенида отрицательно заряженным атомом углерода диалкилкупрата по схеме реакции SN2:
R2Cu + R' X 
 R2CuR'X
R2CuR'X

 R R' + RCu + X
R R' + RCu + X











 CH2 + 1/2H2
CH2 + 1/2H2
 R2CuR'X
R2CuR'X

 R R' + RCu + X
R R' + RCu + X

 R
R  R
R
 R
R
 R
R
 R
R
 R
R
 O(C
O(C
 Br
Br CH
CH ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ! δ
δ
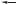 MgX + H B
MgX + H B  R H + B MgX
R H + B MgX

 + MgBr(OH)
+ MgBr(OH) CH MgBr + CH
CH MgBr + CH CH CH
CH CH
 CH
CH CH CH
CH CH CH
CH C CH
C CH
 C CH
C CH O + R
O + R MgX
MgX  R C OMgX
R C OMgX CH
CH CH
CH CH C OH
CH C OH R CH(OR')
R CH(OR') R CHO
R CHO О
О MgX
MgX ROOMgX
ROOMgX  R OH + Mg(OH)X
R OH + Mg(OH)X C CH
C CH