
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
15.1. Металлоорганические соединения |
301 |
По этой причине литийдиалкилкупраты особенно гладко реагируют с первичными галогеналканами:
(н-C H ) CuLi |
+ |
C |
H |
|
I |
эфир |
|
|
|
|||||
|
0 °C |
|
|
|
||||||||||
4 |
9 2 |
|
2 |
5 |
|
|
|
|
|
|
||||
литийдибутилкупрат |
|
иодэтан |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
н-C4H9 |
|
C2H5 |
+ н-C4H9 |
|
Cu + LiI |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
гексан |
бутилмедь |
||||
Реакции со вторичными и третичными галогеналканами осложняются процессами элиминирования (по механизму Е2). Особенно важно, что литийдиалкилкупраты реагируют с арил- и винилгалогенидами, которые, как выше было отмечено, весьма инертны по отношению к реактивам Гриньяра.
|
|
Br |
|
|
|
C4H9-н |
|
|
|
|
(н-C4H9)2CuLi + |
|
|
ТГФ |
|
+ н-C4H9 |
|
Cu |
+ LiBr |
||
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
0 °C |
|||||||
литийдибутил- |
|
|
|
|
бутилмедь |
|
||||
|
|
|
|
|
|
|
||||
купрат |
1-бром- |
|
|
1-бутил- |
|
|
|
|||
циклогексен |
циклогексен |
|
|
|
||||||
|
|
|
|
|
|
(80%) |
|
|
|
|
|
|
I |
|
|
|
C4H9-н |
|
|
|
|
(н-C4H9)2CuLi + |
|
|
эфир |
|
+ н-C4H9 |
|
Cu |
+ LiI |
||
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||
|
|
|
0 °C |
|
|
|||||
|
|
|
|
|
бутилмедь |
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
бутилбензол |
|
|
|
||
|
|
|
|
|
|
(75%) |
|
|
|
|
Задача 15.3. Какой продукт образуется при взаимодействии (R)-2-бромбутана с литийдифенилкупратом? Изобразите его трехмерную структуру. Предскажите стереохимический результат реакции.
Ртутьорганические соединения
Ртутьорганические соединения с одним углеводородным остатком представляют собой бесцветные кристаллические соединения. Соединения диалкилртути являются бесцветными жидкостями. Все ртутьорганические соединения чрезвычайно ядовиты. Вследствие того, что полярность связи C—Hg невелика, ртутьорганические соединения стабильны в присутствии воды, инертны к полярным реагентам, однако медленно разлагаются сильными кислотами. В отличие от соединений магния и лития они не образуют прочных ассоциатов.
R |
|
Hg |
|
R + HCl |
|
R |
|
HgCl |
HCl |
R |
|
H + HgCl2 |
|
|
–RH |
|
t |
|

302 |
Глава 15. Элементоорганические соединения |
Наиболее распространены следующие способы получения ртутьорганических соединений.
1. Из иодалканов и ртути при УФ-облучении:
R |
|
I + Hg |
|
hν |
R |
|
|
HgI, |
2R |
|
HgI |
|
R2Hg + HgI2 |
|||||||
|
|
|
|
|
|
|
||||||||||||||
иодалкан |
|
|
алкилртуть- |
|
|
|
диалкилртуть |
|||||||||||||
|
|
|
|
|
|
|
иодид |
|
|
|
|
|
||||||||
2. Из галогенпроизводных и амальгамы натрия: |
|
|
||||||||||||||||||
2R |
|
X + |
Na(Hg) |
|
|
R |
|
Hg |
|
R |
+ |
2NaX |
|
|
||||||
|
|
|
|
|
|
|
||||||||||||||
галогеналкан |
|
|
|
|
|
|
диалкилртуть |
|
|
|
|
|
||||||||
3. Из реактивов Гриньяра и хлорида ртути(II):
2RMgX + HgCl2  R Hg R + 2MgClX
R Hg R + 2MgClX
4. Взаимодействием ацетата ртути с алкенами (оксимеркурирование):
C C + Hg(OCOCH3)2 + H2O
C + Hg(OCOCH3)2 + H2O
HO C C HgOCOCH3 + CH3COOH
β-гидроксиалкилртуть(II)ацетат
Механизм оксимеркурирования алкенов основан на ионизации ацетата ртути с образованием катиона CH3COOHg . Этот катион реагирует с углеродуглеродной двойной связью как электрофил. В отличие от прямой гидратации алкенов (когда промежуточно образуются карбокатионы, склонные к перегруппировкам) в данной реакции образуется минимальное количество побочных продуктов. Полагают, что причиной этого является преобладание циклической формы промежуточного катиона — меркуриниевого иона.
Стадия 1 — ионизация ацетата ртути:
Hg(OCOCH3)2 
 HgOCOCH3 + CH3COO
HgOCOCH3 + CH3COO
Стадия 2 — образование промежуточного катиона:
CH3 CH CH2 + HgOCOCH3
CH2 + HgOCOCH3 

CH3 |
|
CH |
|
CH2 |
|
HgOCOCH3 |
|
|
|
CH3 |
|
CH |
|
CH2 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
HgOCOCH3
Стадия 3 — стабилизация промежуточного катиона присоединением молекулы воды:
CH3 |
|
CH |
|
CH2 |
+ H2O |
|
|
|
CH3 |
|
CH |
|
CH2 |
|
HgOCOCH3 + H |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
HgOCOCH3 |
|
|
|
|
|
|
OH |
|||||||
15.2. Комплексы переходных металлов |
303 |
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Образование трехчленного циклического интермедиата (меркуриниевого иона) в реакциях оксимеркурирования доказывается фактом анти-присоедине- ния фрагментов электрофила к алкену (см. т. I, разд. 5.4.1).
Демеркурирование проводят обработкой ртутьорганического соединения восстановителем. Чаще всего, для этой цели применяют натрийборгидрид:
HO C C HgOCOCH3 NaBH4, OH  HO C C H
HO C C H
В отличие от литий- и магнийорганических соединений ртутьорганические соединения реагируют с галогеналканами лишь в присутствии катализаторов (AlBr3 или комплексы переходных металлов):
AlBr3
(CH3)3CCH=CHHgCl + CH2=CH—CH2Cl
 (CH3)3CCH=CH—CH2—CH=CH2
(CH3)3CCH=CH—CH2—CH=CH2
В присутствии AlBr3 легко протекают реакции и с ацилгалогенидами: R2Hg + R'COCl  RCOR' + RHgCl
RCOR' + RHgCl
15.2.КОМПЛЕКСЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Среди других металлоорганических соединений комплексы переходных металлов отличаются рядом специфических свойств. Многие из этих комплексов являются катализаторами важных в практическом отношении реакций, протекающих с высокой регио- и стереоселективностью. Некоторые комплексы встречаются в живых организмах, выполняя роль катализаторов биохимических реакций.
15.2.1.Строение
Переходные металлы характеризуются тем, что, находясь в 4-м и более высоких периодах, они обладают не полностью занятыми орбиталями, имеющими главное квантовое число, меньшее, нежели номер периода. Например, металлы V, Cr, Mn, Fe, Co, Ni, принадлежащие к 4-му периоду, имеют частично занятые 3d-орбитали, которые заполняются последовательно внутри периода по мере роста атомного номера металла.

304 |
Глава 15. Элементоорганические соединения |
В соответствии с принципом заполнения электронных оболочек элементов максимальное возможное число электронов в занятых электронных оболочках переходных металлов равно:
в4-м периоде 36 (электронная оболочка криптона);
в5-м периоде 54 (электронная оболочка ксенона);
в6-м периоде 86 (электронная оболочка радона).
Стремясь к достижению электронной конфигурации инертного газа (аналогично тому, как элементы 2-го и 3-го периодов имеют тенденцию к достижению 8-электронной валентной оболочки), переходные металлы отличаются особой склонностью к комплексообразованию. Как правило, в комплексообразовании в качестве доноров элекронов участвуют молеку-
••:
лы, имеющие НЭП на гетероатомах — молекулы воды H2O , простых эфи-
••: •• •• : ••:
ров R2O , аминов R3N, фосфинов R3P, оксида углерода(II) C=O . Такие молекулы называют лигандами.
Способность переходных металлов к заполнению своих электронных оболочек до электронной оболочки соответствующего инертного газа и лежит в основе их каталитического эффекта в органических реакциях. Ниже приведены примеры комплексов переходных металлов и их названий, а также подсчета числа электронов в электронных оболочках этих соединений.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
При записи формул комплексов переходных металлов придерживаются следующей последовательности в расположении лигандов Э:
М Э Э0 Э ,
а в названиях комплексов лиганды перечисляют в обратной последовательности.
МОЛИБДЕНГЕКСАКАРБОНИЛ
Молибденгексакарбонил имеет пространственную конфигурацию октаэдра, а атом молибдена в нем — 54-электронную валентную оболочку (42 электрона атома молибдена и по 2 электрона от каждой из шести молекул оксида углерода), что соответствует электронной оболочке ксенона Xe, инертного газа 5-го периода.
При подсчете зарядов на атомах ни один из 12 «карбонильных» электронов, участвующих в образовании дативных связей (об их природе см. ниже), не считается принадлежащим атому молибдена, который в составе комплекса остается, таким образом, формально нейтральным.
|
CO |
42 |
электрона атома Мо (5-й период) |
|
OC |
|
CO |
+ 12 |
электронов шести СО-лигандов |
|
||||
|
||||
|
Mo |
|
|
|
|
|
|
||
OC |
|
CO |
Общее число электронов в электронной |
|
|
||||
|
CO |
оболочке молибдена равно 54 |
||
|
|
|
||
306 |
Глава 15. Элементоорганические соединения |
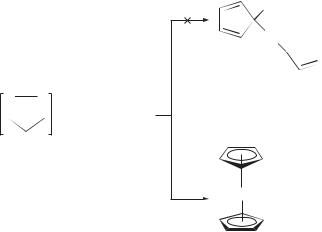
Предпочтительность π-связывания при образовании комплекса переходного металла видна из следующего примера. При попытке получить σ-связанное ди(циклопентадиенил)железо в приведенной ниже реакции в качестве продукта выделен лишь ферроцен.
H
Fe 
H
2 

 Na
Na + FeCl2
+ FeCl2
Fe ферроцен
Металлоорганические соединения, в которых в качестве лиганда выступают π-доноры, называют часто соединениями сэндвичевого типа. За изучение таких соединений Э. Фишер и Дж. Уилкинсон в 1973 г. были удостоены
Нобелевской премии.
Во всех рассмотренных выше комплексах атом переходного металла достигает при комплексообразовании электронной конфигурации инертного
газа и является координационно насыщенным. Полагают, что в комплексах переходных металлов между атомом металла и π-донором имеется дативная
связь. Одна из моделей дативной связи предложена М. Дьюаром в 1951 г. Согласно этой модели, связь металла с алкеном осуществляется одновременно за счет связывающей и разрыхляющей орбиталей. Например, в комплексе иона Ag(I) с этиленом предполагается наличие дативной связи. Она включает донорно-акцепторное связывание двух видов: σ-связь — за счет занятой π-орбитали этилена и вакантной 5s-орбитали иона серебра; π-связь — за счет вакантной π*-орбитали этилена и одной из заполненных
4d-орбиталей, например 4dxy, серебра.
σ-Cвязь в дативном связывании часто обозначают как прямое донирование, а π-связь — как обратное донирование.
При координации алкенов с металлами снижается их склонность к электрофильному присоединению вследствие того, что преобладает смещение электронной плотности с π-орбитали алкена на вакантную орбиталь металла. Атомы углерода двойной связи приобретают частичный положительный заряд, что повышает способность алкеновых лигандов взаимодействовать с нуклеофильными реагентами.






 H
H Co
Co 2HCo(CO)
2HCo(CO)