
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
Глава 13. ГАЛОГЕНПРОИЗВОДНЫЕ
АЛКАНОВ
Производные алканов, в молекулах которых один или несколько атомов во-
дорода замещены атомами галогенов — фтора, хлора, брома или иода, называют галогеналканами.
13.1. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА
Взависимости от типа атома углерода, связанного с галогеном, галогеналканы классифицируют как первичные, вторичные и третичные, по числу атомов галогена в молекуле различают моно-, ди- и полигалогенпроизводные.
Ниже даны примеры названий галогеналканов по номенклатуре ИЮПАК. Для низших галогенпроизводных указаны названия и по радика- ло-функциональной номенклатуре (эти названия даны в скобках).
CH3CH2Br |
CH3 |
|
CHCH3 |
CH3 |
|
CHCH2 |
|
CHCH3 |
||
|
|
|
||||||||
бромэтан |
Cl |
|
|
CH3 |
Br |
|||||
(этилбромид), |
2-хлорпропан |
2-бром-4-метилпентан, |
||||||||
первичный галогеналкан |
||||||||||
(изопропилхлорид) |
вторичный галогеналкан |
|||||||||
|
||||||||||
|
вторичный галогеналкан |
|
|
|
|
|
|
|||
|
|
|
Br |
|
|
|
Br |
|||
|
|
|
|
|
|
|
||||
Cl |
|
|
|
|
|
|
CH3 |
|||
хлорциклобутан |
|
|
|
|
|
|
||||
бромциклогексан |
1-бром-1-метилциклопентан, |
|||||||||
(циклобутилхлорид), |
||||||||||
первичный |
(циклогексилбромид), |
третичный |
||||||||
галогенциклоалкан |
вторичный галогенциклоалкан |
галогенциклоалкан |
||||||||
13.2.СПОСОБЫ ПОЛУЧЕНИЯ
C основными способами получения галогеналканов мы уже познакомились при изучении химии алканов (т. I, гл. 2), алкенов (т. I, гл. 5) и алкинов (т. I, гл. 6). В этом разделе приведены лишь краткие сведения о соответствующих реакциях.

13.3. Физические свойства и строение |
213 |
13.3.ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ
13.3.1.Физические свойства
Галогенметаны, за исключением иодметана, являются бесцветными газами. Их низшие гомологи представляют собой бесцветные высоколетучие жидкости со сладковатым запахом.
На примере температур кипения (табл. 13.1) интересно проследить, каким образом физические свойства галогеналканов зависят от типа и числа атомов галогенов в молекуле.
Рост атомного номера галогена ведет к росту температуры кипения галогеналкана.
Соединение |
н-C5H12 |
н-C5H11–Cl |
н-С5H11–Br |
н-C5H11–I |
|
пентан |
1-хлорпентан |
1-бромпентан 1-иодпентан |
|
Т. кип., °C |
36 |
108 |
129 |
157 |
Рост температуры кипения наблюдается и при увеличении числа атомов хлора, брома и иода в молекуле галогеналкана.
Cоединение |
СН3Сl |
CH2Cl2 |
CHCl3 |
CCl4 |
|
хлорметан |
дихлорметан |
хлороформ |
четыреххлористый |
|
|
|
|
углерод |
Т. кип., °C |
–24 |
40 |
61 |
77 |
Таблица 13.1. Температуры кипения галогеналканов
Соединение |
Формула |
Т. кип., °С |
|
||
|
|
|
|
|
|
|
|
X = F |
X = Cl |
X = Br |
X = I |
Галогенметан |
СН Х |
–78 |
–24 |
3 |
42 |
|
3 |
|
|
|
|
Галогенэтан |
СН3СН2Х |
–32 |
12 |
38 |
72 |
1-Галогенпропан |
СН3СН2СН2Х |
–3 |
47 |
71 |
103 |
2-Галогенпропан |
(СН3)2СНХ |
–11 |
35 |
59 |
90 |
1-Галогенбутан |
СН3СН2СН2СН2Х |
– |
78 |
102 |
130 |
2-Галогенбутан |
СН3СН(Х)СН2СН3 |
– |
68 |
91 |
120 |
1-Галогенпентан |
СН3(СН2)3СН2Х |
65 |
108 |
129 |
157 |
1-Галогенгексан |
СН3(СН2)4СН2Х |
92 |
134 |
155 |
180 |
1-Галогеноктан |
СН3(СН2)6СН2Х |
143 |
183 |
202 |
226 |
Галогенциклопентан |
X |
– |
114 |
138 |
166 |
Галогенциклогексан |
X |
– |
142 |
167 |
192 |
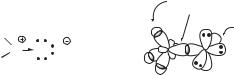
214 |
Глава 13. Галогенпроизводные алканов |
Важно отметить, что фторпроизводные не подчиняются указанным закономерностям, вероятнее всего, из-за весьма слабых межмолекулярных взаимодействий в этих соединениях.
Соединение |
н-C7H16 |
н-C7F16 |
CH2Cl2 |
CF2Cl2 |
|
гептан |
перфторгептан |
дихлорметан |
дифтордихлорметан |
Т. кип., °C |
98 |
84 |
40 |
–28 |
13.3.2.Электронное строение
Атомы галогенов более электроотрицательны, чем углерод, поэтому связи Csp3–Hal полярны. Характеристики связей C–Hal приведены ниже по данным для галогенметанов, и на примере метилхлорида CH3Cl показаны два способа изображения электронной структуры галогеналкана. Структурная формула иллюстрирует электроноакцепторный эффект хлора и появление дробных зарядов на атомах углерода и хлора, а атомно-орбитальная модель показывает, какие орбитали формируют ковалентные связи в молекуле галогеналкана.
|
|
1s(H) |
|
H |
2sp3(C) |
H δ |
3px(Cl) |
|
δ |
C ClH |
|
C |
Cl |
|
H |
H |
|
H |
H 3py 3pz |
|
|
||
атомно-орбитальная модель
Изменение полярности (мера полярности — дипольный момент) и поляризуемости связей Csp3–X (где Х — галоген) в зависимости от природы атома галогена, а также другие характеристики связей С–Hal в галогенметанах иллюстрируют данные табл. 13.2 (в качестве меры поляризуемости указана рефракция связи). Видно, что в ряду С–F, C–Cl, C–Br, C–I длина связи C–Hal увеличивается, повышается ее поляризуемость, а следовательно, снижается прочность.
Таблица 13.2. Некоторые свойства связей CH3–X
Х |
Энергия, |
Длина связи, |
Дипольный |
Рефракция, |
Потенциал |
|
ккал/моль |
нм |
момент, D |
см3 |
ионизации, эВ |
F |
107,0 |
0,141 |
1,81 |
1,44 |
– |
Cl |
66,5 |
0,176 |
1,83 |
6,51 |
11,29 |
Br |
54,0 |
0,191 |
1,79 |
9,38 |
10,53 |
I |
46,5 |
0,210 |
1,60 |
14,61 |
9,5 |
|
|
|
|
|
|


216 |
|
|
|
|
|
Глава 13. Галогенпроизводные алканов |
CH3CH2Br + N3 |
|
|
|
|
CH3CH2N3 |
|
|
|
|
||||
азид-ион |
|
этилазид |
||||
CH3CH2Br + NH3 |
|
|
|
CH3CH2NH3Br |
||
|
|
|
||||
аммиак |
|
|
этиламмоний- |
|||
|
|
|
|
|
|
бромид |
CH3CH2Br + N(C2H5)3 |
|
|
|
(C2H5)4NBr |
||
|
|
|
||||
триэтиламин |
|
|
тетраэтиламмоний- |
|||
|
|
|
|
|
|
бромид |
CH3CH2Br + P(CH3)3  CH3CH2P(CH3)3Br
CH3CH2P(CH3)3Br
триметилфосфин триметилэтилфосфонийбромид
CH3CH2Br + S(C2H5)2  (C2H5)3SBr
(C2H5)3SBr
диэтилсульфид триэтилсульфонийбромид
Все перечисленные реакции идут по типу нуклеофильного замещения у алифатического атома углерода. Кроме атомов галогена в галогеналканах, замещению в различных субстратах под действием нуклеофильных реагентов могут подвергаться и другие функциональные группы.
В самом общем виде реакции нуклеофильного замещения у sp3-гибриди- зованного атома углерода представляют следующей схемой:
δ

 δ
δ
Nu +
+ 
 C
C  X
X

 C Nu +
C Nu +  X
X
нуклеофил |
|
|
нуклеофуг |
|
(вступающая |
субстрат |
продукт |
(уходящая |
|
группа) |
группа) |
|||
|
|
Согласно этой схеме, нуклеофил Nu: со своей электронной парой замещает в субстрате группу Х, уходящую с электронной парой в виде аниона. К нуклеофильным реагентам относят все атомы или молекулы, которые являются донорами электронной пары при образовании связи с любым элементом, кроме водорода. Нуклеофильные реагенты различаются по признаку наличия или отсутствия у них отрицательного заряда (показаны лишь отдельные представители соответствующих нуклеофилов):
• нуклеофилы — отрицательно заряженные ионы
O
 OH,
OH,  I
I ,
,  C
C N, CH3 O
N, CH3 O , CH3C
, CH3C  ,
,  Br
Br ,
,  Cl
Cl , O
, O
 SH, NO3, SCN, N3 , NO2;
SH, NO3, SCN, N3 , NO2;

13.4. Реакции |
217 |
• нуклеофилы — нейтральные молекулы |
|
H2O , CH3OH, NH3, C6H5OH, C6H5NH2, |
P(CH3)3, S(C2H5)2. |
Реакции нуклеофильного замещения у алифатического атома углерода являются не только одними из самых распространенных в органической химии. Эти реакции также и наиболее изучены с точки зрения механизма. Чаще всего они протекают по одной из двух схем:
1)бимолекулярное нуклеофильное замещение (SN2);
2)мономолекулярное нуклеофильное замещение (SN1).
13.4.1.Бимолекулярное нуклеофильное замещение
Реакции SN2 протекают при действии на субстраты сильных нуклеофильных реагентов. Одним из характерных примеров реакции SN2 является щелочной гидролиз метилбромида:
CH3Br + |
OH |
H2O |
CH3OH + Br |
|
NaOH |
||||
метил- |
гидроксид- |
метанол |
бромид- |
|
бромид |
ион |
|
|
ион |
В этой реакции гидроксид-ион (вступающая группа, нуклеофил) замещает анион брома (уходящая группа, нуклеофуг) в молекуле метилбромида (субстрат).
Механизм реакции SN 2
Скорость реакции SN2 описывается кинетическим уравнением второго порядка:
w = k2[CH3Br][ OH],
т.е. пропорциональна концентрации субстрата и нуклеофила.
Впереходном состоянии скоростьлимитирующей стадии гидролиза метилбромида участвуют две частицы: гидроксид-ион и метилбромид.
|
|
|
H |
≠ |
|
H δ |
δ |
|
|
|
δ |
|
||
HO + |
C Brδ |
HO |
C Br |
|
|
H |
|
H H |
|
|
H |
|
|
H
HO C +
+  Br
Br 
H
H

218 |
Глава 13. Галогенпроизводные алканов |
δ |
H |
δ |
HO




 C
C





 Br
Br
H H
Исходные |
Продукты |
|
реагенты |
||
реакции |
||
|
||
СH3Br + OH |
СH3ОН + Br |
Рис. 13.1. Энергетическая диаграмма реакции SN2
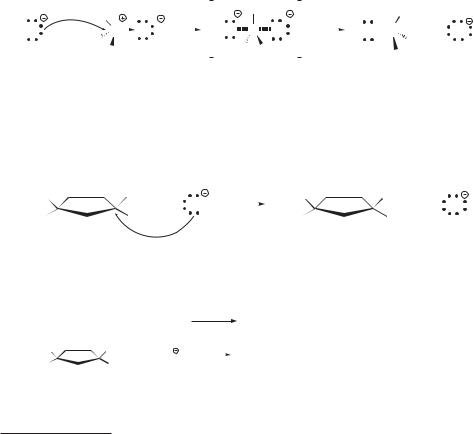
Гидроксид-ион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома, т. е. «с тыла». Образование связи C–O и разрыв связи C–Br в переходном состоянии происходят одновременно.
Переходное состояние можно представить как активированный комплекс, в котором атом углерода частично связан со вступающей группой, а связь С–Br с уходящей группой еще не вполне разорвалась. Отрицательный заряд распределен между вступающей и уходящей группами. При этом
атом углерода остается незаряженным. Таким образом, реакция протекает как одностадийный синхронный процесс. Этот механизм объективно отража-
ется энергетической диаграммой, представленной на рис. 13.1.
Молекулярно-орбитальная модель реакции SN 2
Нуклеофил своей несвязывающей электронной парой атакует меньшую долю связывающей молекулярной орбитали, локализованной на связи С–Br.
≠
|
H |
|
|
H |
δ |
|
Br |
HOδ |
|
||
HO |
C |
C |
Br |
||
|
H H |
|
|
H H |
|
|
|
|
|
|
H |
|
|
|
HO |
C |
+ Br |
|
|
|
|
HH |
|
13.4. Реакции |
219 |
В активированном комплексе атом углерода переходит в состояние sp2- гибридизации, причем его негибридизованная р-орбиталь перекрывается как с ВЗМО нуклеофила, так и с ВЗМО уходящей группы — бромид-иона. После полного отрыва бромид-иона и образования связи с нуклеофилом атом углерода снова переходит в sp3-гибридное состояние.
Стереохимия реакций SN 2
Cтереохимический результат реакции SN2 иллюстрируется применением оптически активных субстратов, в которых галоген связан с хиральным атомом углерода. Как правило, реакции SN2 таких соединений протекают стереоспецифично со 100%-м обращением конфигурации (инверсия)*. Например, (R)-2-хлорбутан в ходе щелочного гидролиза дает (S)-2-бутанол:
CH3 δ |
δ |
|
|
δ |
CH3 δ |
|
≠ |
|
|
|
CH3 |
||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||
HO + |
H C |
|
|
Cl |
|
|
HO |
C Cl |
|
|
|
HO |
|
C |
H + Cl |
|
|
|
|
|
|
|
|
||||||||
|
C2H5 |
|
|
|
|
H C2H5 |
|
|
|
|
|
C H |
|||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
|||
(R)-2-хлорбутан |
|
|
|
|
|
|
|
|
(S)-2-бутанол |
||||||
Взаимодействие цис-3-метил-1-хлорциклопентана с гидроксид-ионом в условиях реакции SN2 дает еще один аргумент в пользу подхода нуклеофила с «тыла» по отношению к разрывающейся связи С–Cl. Это взаимодействие также сопровождается обращением конфигурации у атома C1 субстрата.
CH3 |
Cl |
|
CH3 |
H |
|
+ OH |
|
|
+ Cl |
|
|
|
||
H |
H |
|
H |
OH |
(1R, 3S)-цис-3-метил- |
|
(1S, 3S)-транс-3-метил- |
||
1-хлорциклопентан |
|
циклопентанол |
||
Задача 13.1. Завершите следующие реакции и укажите стереохимию продуктов.
ацетон
а) (R)-2-бромбутан + Р(CH3)3
б) |
CH3 |
Br |
+ CN |
ДМСО |
|
|
|
HH
* Такой стереохимический результат называют вальденовским обращением. Это явление впервые обнаружил П. Вальден в 1895 г., однако только в 1930-е годы Э. Хьюз и К. Ингольд объяснили его.

220 |
Глава 13. Галогенпроизводные алканов |
Влияние природы растворителя на реакции SN 2
Общие сведения о влиянии растворителей на органические реакции приведены в разд. 1.11.4 (т. I). Для реакций SN2 наиболее важными свойствами являются полярность растворителя и его способность к образованию водо-
родных связей с реагирующими субстратами.
Неполярные растворители не растворяют основания и соли, которые часто выступают в роли нуклеофильных реагентов. Эти растворители (см. ниже) в реакциях нуклеофильного замещения применяют редко.
Растворитель |
|
ε |
|
||
|
|
|
Алканы, петролейный эфир |
|
<2 |
CCl4 |
|
2,23 |
C6H6 |
|
2,28 |
CHCl3 |
|
4,7 |
|
Солеобразные нуклеофильные реагенты лучше всего растворяются в воде, которая является полярным протонным растворителем. Однако в воде
плохо растворяется большинство органических соединений, в том числе галогенпроизводные. Поэтому часто применяют смеси растворителей (водный этанол, водный диоксан, водный ацетон).
Растворитель |
|
ε |
|
|
|
Растворитель |
|
ε |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
CH COOH |
|
6,2 |
|
|
|
HO(CH ) OH |
|
37,7 |
3 |
|
|
|
|
|
2 2 |
|
|
NH3 (жидк.) |
|
17 |
|
|
|
HCOOH |
|
59 |
C2H5OH |
|
24 |
|
|
|
H2O |
|
80 |
CH OH |
|
32,6 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
Эффективными являются также полярные апротонные растворители, как правило, имеющие умеренную диэлектрическую проницаемость, но не способные к образованию водородных связей.
Растворитель |
ε |
|
Растворитель |
ε |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
O |
O |
2,2 |
|
CH3 |
|
|
|
|
C |
|
|
CH3 |
25 |
||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||
диоксан |
|
|
|
|
ацетон |
|
|||||||||||||||
C2H5 |
|
O |
|
C2H5 |
4,34 |
|
H |
|
|
C |
|
|
|
N(CH3)2 |
38 |
||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
диэтиловый эфир |
|
|
|
|
O |
|
|||||||||||||||
|
|
диметилформамид (ДМФА) |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
O |
|
|
|
|
7,4 |
|
CH3 |
|
S |
|
|
CH3 |
46 |
||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|||||||||
тетрагидрофуран |
|
|
диметилсульфоксид (ДМСО) |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
