
Травень В.Ф. - Органическая химия. В 3 т. Т. 2
..pdf
12.6. Масс-спектроскопия |
201 |
Молекулярную формулу соединения можно также определить по массспектрам высокого разрешения (позволяющим определить m/z с точностью до четырех знаков после запятой). Так, оксид углерода СО и этилен С2H4 имеют одинаковое массовое число 28, но точное значение молекулярной массы, которое можно определить по масс-спектрам высокого разрешения, равно для оксида углерода 27,9949, а для этилена — 28,0312.
Вследствие столь высокой точности определения массовых чисел массспектрометрия высокого разрешения в настоящее время часто заменяет классические методы (и в первую очередь метод сжигания) определения элементного состава органических соединений.
12.6.2.Основные типы фрагментации органических соединений
Анализ масс-спектра с целью установления структуры органического соединения сводится к изучению осколочных и перегруппировочных ионов и установлению схем их образования при распаде молекулярного иона.
Направление фрагментации ионов (как молекулярного, так и осколочных) определяется следующими факторами:
—энергиями связей в анализируемой молекуле. При распаде ионов легче протекает разрыв связей с меньшей энергией. Энергия С–С-связи меньше энергии С–Н-связи, поэтому при фрагментации алканов происходит разрыв С–С-связи. Одинарные С–С-связи легче разрываются, чем кратные. Связи С–Hal, С–О, C–N расщепляются легче, чем связи С–С;
—стабильностью образующихся при фрагментации осколочных ионов и
радикалов.
Можно выделить следующие закономерности фрагментации:
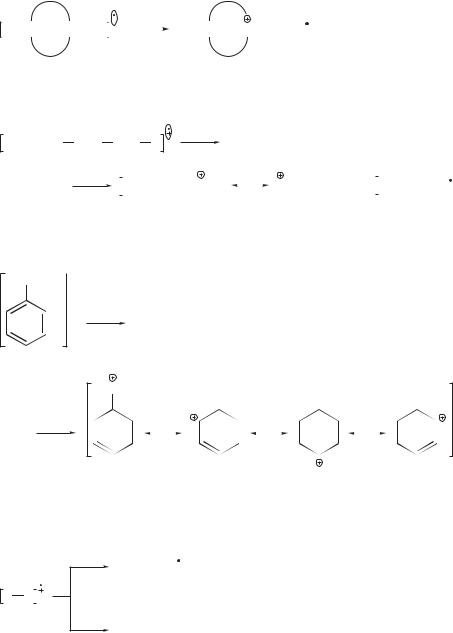
1. В алканах происходит разрыв С–С-связи у наиболее разветвленного атома углерода молекулярного иона с образованием наиболее стабильных третичных и вторичных карбокатионов:
R CH R

 R CH + R
R CH + R
R |
R |
Относительная интенсивность пиков образующихся осколочных ионов определяется стабильностью этих ионов. Например, если одновременно могут образоваться первичный и вторичный карбокатионы, то более интенсивный пик соответствует более стабильному вторичному карбокатиону.
202 |
Глава 12. Введение в органический синтез |
2.Для замещенных циклоалканов характерен α-распад (разрыв связи
вα-положении к циклу) молекулярного иона с отщеплением заместителя и образованием вторичного циклического карбокатиона:
(H2C)n CH |
|
R |
|
|
|
|
|
(H2C)n CH + R |
|
|
|
|
|
|
3. В алкенах преимущественно наблюдается β-распад молекулярного иона с образованием резонансно-стабилизированного аллильного катиона m/z 41:
CH2  CH CH2 CH2 R
CH CH2 CH2 R
CH2 |
|
CH |
|
CH2 |
|
|
CH2 |
|
CH |
|
CH2 |
+ RCH2 |
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|||||||||||
|
|
|
|
|
m/z 41 |
|
||||||
4. Для алкилбензолов С6Н5СН2R наиболее характерным является β-рас- пад молекулярного иона с образованием стабильного бензильного катиона m/z 91:
CH2R 

–R
CH2 |
|
|
CH2 |
|
|
CH2 |
|
|
CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m/z 91
5. В соединениях со связями С–О, C–S, C–N, C–Hal наблюдается α-распад, т. е. разрыв связи углерод–гетероатом молекулярного иона причем интенсивный пик, соответствующий R , наблюдается только для галогенпроизводных:
R + X
+ X
R X 

R + X
+ X

12.6. Масс-спектроскопия |
203 |
В соединениях, содержащих гетероатом (Х), вероятен β-распад, т. е. β-разрыв С–С-связи молекулярного иона с образованием катионов, стабилизированных сопряжением с НЭП гетероатома:
R |
|
CH2 |
|
|
|
|
CH2 |
|
X |
|
R |
|
|
|
|
R |
|
CH2 + |
CH2 |
|
|
X |
|
R |
|
|
|
|
|
CH2 |
|
X |
|
R |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
R |
|
CH |
|
|
|
|
C |
|
R |
|
|
R |
|
CH + |
|
C |
|
R |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
R |
|
|||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
X |
X |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
(X = O, N, S)
6. Перегруппировки молекулярных ионов наблюдаются при небольших затратах энергии, так как при этом часто отщепляются нейтральные молекулы — H2O, CO, NH3, H2S, HCN, HHal, ROH, CH2=C=O, R–CH=CH2 — и образуются стабилизированные перегруппировочные ионы, которые можно отличить от осколочных ионов по массовому числу.
Если массовое число молекулярного иона четное, то перегруппировочный ион имеет четное массовое число, а осколочный ион — нечетное массовое число.
Перегруппировки заключаются в миграции атомов водорода, двойных связей, алкильных групп и т. д. Примером часто встречающейся перегруп-
пировки, протекающей через шестицентровое переходное состояние, является перегруппировка Мак-Лафферти:
C |
H |
|
|
|
|
|
|
|
|
C |
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
X |
|
|
|
|
|
|
|
|
+ |
|
|
X |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
C |
Y |
|
|
|
|
|
|
C |
|
|
|
C |
|||||||
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
C Y |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(X = CH2, O, S, NR; Y = H, Alk, Ar, OR, SR, NR2)
12.6.3.Применение метода масс-спектрометрии для целей идентификации
Вэтом разделе подробно рассмотрены особенности фрагментации только углеводородов. Пути фрагментации соединений, содержащих различные функциональные группы, систематически излагаются далее в соответствующих главах.
204 |
Глава 12. Введение в органический синтез |
Алканы
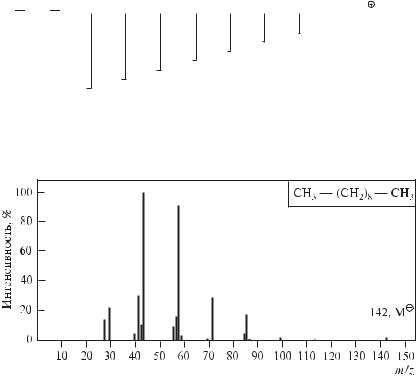
В масс-спектрах алканов с неразветвленной цепью отчетливо виден пик молекулярного иона, но его интенсивность систематически уменьшается в гомологическом ряду по мере увеличения молекулярной массы алкана. В масс-спектрах углеводородов с числом атомов углерода больше 12 пик молекулярного иона не наблюдается вовсе. Молекулярный ион алкана не стабилизирован в достаточной мере. Поэтому легко протекает его фрагментация, характеризующаяся потерей группы СН3 (пик М–15) и далее последовательным отщеплением групп СН2 (набор пиков осколочных ионов М–29, М–43, М–57 и т. д. с разностью m/z, равной 14).
Отмеченные закономерности иллюстрирует масс-спектр н-декана
(рис. 12.41). Как и следовало ожидать, пик молекулярного иона М0• —
+
пик m/z 142 — в масс-спектре н-декана имеет малую интенсивность. Пик с m/z 127 (M–15), соответствующий потере СН3, настолько мал, что вообще не наблюдается в масс-спектре. Группы осколочных ионов разделены интервалами в 14 единиц массы, что указывает на последовательное отщепление метиленовых групп. Распад молекулы декана показан на следующей диаграмме:
CH3 CH2 CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH2
CH2 CH3 M 142
CH3 M 142
127
113
99
85
71
57
43
Наиболее интенсивными пиками в спектре декана (и в спектрах других средних алканов) являются пики осколочных ионов с m/z 43 (C3H7 ), 57 (C4H9 ).
Рис. 12.41. Масс-спектр н-декана
12.6. Масс-спектроскопия |
205 |
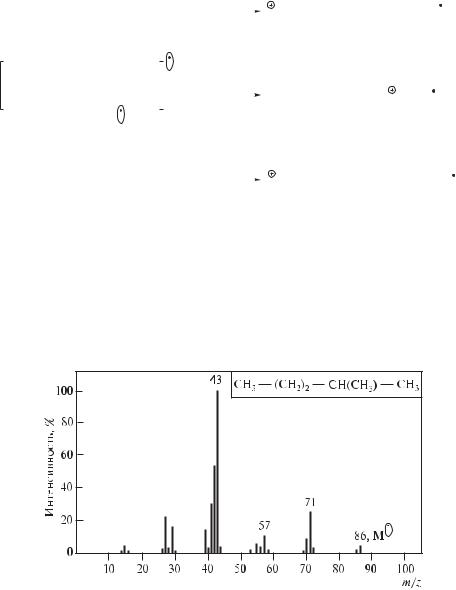
Интенсивность пика молекулярного иона разветвленного углеводорода невысока, поскольку С–С-связи молекулярного иона легко разрываются по месту разветвления с образованием осколочных ионов — более стабильных вторичных и третичных карбокатионов:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
легко |
|
|
CH3 |
CH3 + CH3CH2CH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m/z 43 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
CH3 |
|
|
|
|
|
легко |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
CH3CH2CH2 |
|
CH |
|
|
|
|
CH3 |
|
|
|
|
|
CH3CH2CH2 |
|
CH |
+ CH3 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m/z 71 |
|
|
|
|
||
m/z 86 (M |
|
) |
труднее |
|
|
|
|
|
|
CH3 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 + CH3CH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
CH |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
m/z 57
Так, в 2-метилпентане наиболее вероятное направление фрагментации молекулярного иона — отщепление радикалов С3Н7• или СН•3 с образованием вторичных карбокатионов, а не отщепление С2Н5•, приводящее к образованию первичного карбокатиона. Это подтверждается масс-спектром 2-метилпентана, приведенным на рис. 12.42.
Под действием электронного удара в алканах возможна миграция алкильных групп, поэтому точно определить структуру изомерных алканов нельзя.
Рис. 12.42. Масс-спектр 2-метилпентана
206 |
Глава 12. Введение в органический синтез |
Алкены
Пики молекулярных ионов алкенов интенсивнее, чем пики молекулярных ионов алканов вследствие стабилизирующего эффекта двойной связи. В спектрах алкенов наиболее интенсивными пиками являются пики осколочных ионов общей формулы [CnH2n–1] , образующихся при β-распаде молекулярного иона, с m/z 41, 55, 69, 83 и т. д.:
Осколочный ион |
|
|
m/z |
|
СН =СН–СН |
|
|
41 |
|
2 |
2 |
|
|
|
СН |
=СН–СН –CH |
3 |
|
55 |
2 |
|
|
|
|
СН |
=СН–СН –C H |
5 |
69 |
|
2 |
2 |
|
|
|
Последующий распад осколочных ионов происходит как у алканов и регистрируется набором пиков с разностью m/z 14, отвечающей отрыву метиленовой группы. Однако, в отличие от алканов, в масс-спектрах алкенов наблюдается большое количество перегруппировочных ионов общей формулы [СnH2n] , затрудняющих интерпретацию спектров. Поскольку под действием электронного удара может происходить миграция двойной связи, однозначно определить ее положение в молекуле по масс-спектру невозможно.
Ароматические углеводороды
Как уже было отмечено выше, ароматические углеводороды имеют в спектре отчетливый пик молекулярного иона.
Первоначальный разрыв связи С–Н в молекулярном ионе бензола (см. рис. 12.38) приводит к фенил-катиону (m/z 77), при распаде которого отщепляется молекула ацетилена и образуется осколочный ион C4H3 (m/z 51):
C6H6 |
|
C6H5 |
|
C4H3 + C2H2 |
|
|
|||
|
–H |
|
|
|
m/z: 78 |
77 |
51 |
||
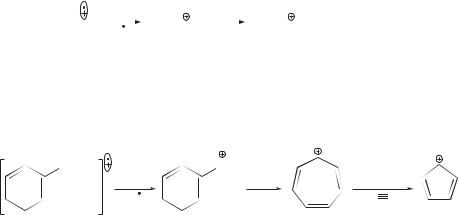
В масс-спектрах монозамещенных алкилбензолов наиболее характерным пиком является пик с m/z 91 бензильного катиона С6Н5СН2 , который перегруппировывается в тропилий-ион С7Н7 (m/z 91). Последний при элиминировании молекулы ацетилена образует циклопентадиенил-катион С5Н5 (m/z 65):
CH2R |
CH2 |
–R |
–HC CH |
m/z 91 |
тропилий- |
m/z 65 |
|
ион |
|

12.6. Масс-спектроскопия |
207 |
Соединения R–X (X = OH, NH2, Hаl)
Интенсивность пика молекулярного иона [R–X]0• зависит от электроотри-
+
цательности гетероатомов и уменьшается в следующем ряду:
R I > R Br > R Cl > R N2H > R OH > R F
Фрагментация молекулярного иона может протекать по следующим направлениям:
1) α-распад, т. е. разрыв связи С–Х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
CH2 |
|
+ X |
|
|
|
|
|
|
|
|
|
|
(1а) |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
R |
|
|
CH2 |
|
|
X |
|
|
|
|
|
|
|
|
|
CH2 |
|
|
+ X |
|
|
|
|
|
|
|
|
|
|
(1б) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2) β-распад, т. е. разрыв связей С–С или С–Н |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
+ |
|
CH2 |
|
X |
|
|
|
CH2 |
|
|
X |
|
|
|
(2а) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
R |
|
|
|
CH2 |
|
|
X |
|
|
|
|
|
|
|
|
H |
+ |
|
R |
|
CH |
|
X |
|
|
R |
|
|
CH |
|
|
X |
|
(2б) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
3) разрыв связи С–Х и одновременная перегруппировка (М-молекуляр- ный ион)
R |
|
CH2 |
|
X |
|
|
|
|
|
|
|
|
M—НХ |
|
|
|
|
|
|
|
|
|
|
|
|
|
(3а) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
–HX |
|
|
M—НХ, —CH |
|
CH |
|
|
|
|
+ CH |
|
CH |
(3б) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
2 |
2 |
2 |
2 |
||||||||||||||||||
Направление фрагментации определяется устойчивостью образующихся фрагментов и прочностью связей С–Х.
Соединения R–CO–X (X = H, R, OH, OR, NH2, NR2)
Интенсивность пиков молекулярных ионов карбоновых кислот (Х = OH), амидов кислот (Х = NH2, NR2), сложных эфиров (Х = OR), альдегидов (Х = Н) незначительна. Несколько большая интенсивность молекулярных пиков наблюдается в масс-спектрах кетонов (Х = R). Преобладающие пути фрагментации в спектрах соединений R–CO–X определяются природой Х и подробно обсуждаются в последующих главах.

210 |
Дополнения |
Рис. 12.44. Формирование мономолекулярного слоя ПАВ на поверхности воды: 1 – молекулы ПАВ, 2 – поверхность воды
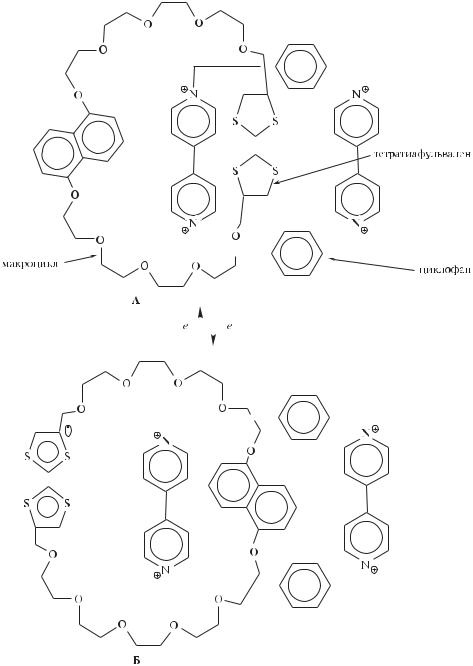
Другое направление усилий химиков, работающих в области молекулярной электроники, скорее напоминает фрагмент фантастического романа, а не изложение научной задачи. Речь идет о создании «роботов», имеющих наноразмеры. Такие наноустройства размером не более 100 нм могли бы циркулировать в кровеносной системе человека, обнаруживая и уничтожая, например, раковые клетки.
Естественно, возникает вопрос о том, каким образом молекулы, способные выполнять те или иные функции электронных элементов, могут быть организованы в соответствующие молекулярные ансамбли. В перспективе ученые надеются заимствовать для этих целей технологию сборки белков и ферментов, которая «работает» в биологических системах (см. об этом
вт. III, гл. 28).
Внастоящее время успешно применяется и более доступная технология изготовления молекулярных ансамблей — тонкопленочная технология Ленг- мюра–Блоджетт, основанная на принципах разных наук: органической, физической и коллоидной химии, а также физики и биологии.
Фундаментальные особенности технологии Ленгмюра–Блоджетт определяются свойствами органических соединений. В основе тонкопленочной технологии лежит способность поверхностно-активных веществ (ПАВ) образовывать мономолекулярные слои на поверхности воды. Молекулы ПАВ выстраиваются в упорядоченные структуры, будучи закреплены своими гидрофильными концами на поверхности воды, как это показано на рис. 12.44.
Монослои, образуемые на поверхности воды, могут быть многократно перенесены на твердую (например, стеклянную) подложку с получением упорядоченной мультислойной пленки. Естественно, что гидрофобная часть молекулы ПАВ может быть представлена фрагментом любой молекулы, потенциально способной выступать в качестве элемента, чувствительного к УФ-излучению, электрическому напряжению, окислительно-вос- становительному потенциалу, а также способной к полимеризации и к участию в биохимических процессах.
Работы по синтезу органических структур, пригодных для изготовления материалов молекулярной электроники, приведены в списке литературы.



 S
S