
- •Глава 28
- •Влияние гормонов на работу сердца
- •Введение
- •Изоферменты миозина миокардиальной клетки
- •Уровень в организме гормонов щитовидной железы и распределение изоферментов миозина
- •Корреляция между изменениями изоферментного состава миозина и механической эффективностью
- •Изоферменты миозина в других условиях
- •Регуляция изоферментного состава миозина с помощью аналогов тиреоидных гормонов и других факторов
- •Мембранное действие
- •Другие (нетиреоидные) гормоны и работа сердца
- •Гормоны передней доли гипофиза
- •Гормоны коры надпочечников
- •Сахарный диабет
Глава 28
Влияние гормонов на работу сердца
Е. МОРКИН (Е. MORKIN)
Введение
Известно, что некоторые нарушения эндокринной системы в эксперименте и клинике вызывают изменение функции сердца. Однако в большинстве случаев механизмы их неясны. Новый подход к этой проблеме позволил выяснить, что гормоны щитовидной железы регулируют изоферментный состав миозина в кардиомиоцитах желудочков [1, 2]. На основании этого можно объяснить увеличение мощности сердца как насоса и повышение активности АТФазы миозина при избытке в организме тиреоидных гормонов частично за счет усиления синтеза изофермента миозина, обладающего высокой АТФазной активностью. В норме этот изофермент составляет лишь малую часть всего миозина в кардиомиоцитах желудочков. Аналогичные изменения изоферментного состава миозина обнаружены при введении крысам с дефицитом этих гормонов трийодтиронина Т3. [3, 4]. Кроме того, на основании наличия разных изоферментов в кардиомиоцитах желудочков и регуляции их экспрессии с помощью гормонов щитовидной железы и при воздействии других факторов можно объяснить результаты ряда исследований по» изменению активности АТФазы миозина при эндокринной патологии у экспериментальных животных; без учета перечисленных фактов результаты этих работ непонятны.
ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ И ИЗОФЕРМЕНТЫ МИОЗИНА
Структура и функции миозина
Толстые нити образованы идущими параллельно молекулами? миозина, а тонкие нити состоят из глобулярных молекул актина,. соединенных вместе и образующих структуру, похожую на двойную нитку бус, перекрученных вдоль длинной оси. Миокардиальный миозин представляет собой гексамер, состоящий из двух тяжелых полипептидных цепей, относительная молекулярная масса каждой из которых составляет 210000. Толстые цепи закручены одна вокруг другой с образованием хвоста, закругленного альфа-спиралью и обеспечивающего жесткость и большую длину молекулы, на конце они разветвляются, образуя две глобулярные головки. Каждая из них имеет место связывания и гидролиза АТФ и отдельное, но расположенное рядом, место связывания актина. Кроме двух тяжелых цепей, молекула миозина содержит две легкие цепи: точное положение их неизвестно, по-видимому, они находятся где-то вблизи к месту связывания АТФ и актина на тяжелой цепи. В регуляции сокращения принимают участие также тропонин, состоящий из трех субъединиц, и тропомиозин, лежащие в канавке, проходящей вдоль тонкой нити между двумя цепочками глобул актина.
В настоящее время общепризнано, что как в сердечной, так и в скелетной мышце сокращение происходит при скольжении толстой (миозиновой) нити саркомера вдоль тонкой (актиновой) нити за счет энергии, освобождающейся при гидролизе АТФ. Этот процесс регулируется изменением в миоплазме концентрации ионов кальция, которые связываются с тропониновым комплексом, находящимся на тонкой нити. В результате этого связывания изменяется конформационное состояние тропомиозина, что создает условия для взаимодействия головок миозина с актином. Считают, что взаимное скольжение нитей обусловлено циклическим взаимодействием между поперечными мостиками, образованными глобулярными головками молекул миозина -и специфическими местами связывания на актиновой нити.
Результаты первых исследований гибридных молекул миозина, легкие цепи которых выделены из быстрой скелетной мышцы, а тяжелые — из медленной или наоборот, позволили определить, что, по-видимому, АТФазная активность миозина, а значит и скорость укорочения мышцы, может определяться типом легких цепей миозина. Однако впоследствии результаты экспериментов с такой гибридизацией не подтвердили влияния легких цепей миозина на скорость Са2+-АТФазной или Мg2+-АТФазной .активности, стимулируемой актином. Более того, было показано, что АТФазная активность миозина скелетных мышц полностью сохраняется при удалении обеих легких цепей из его молекулы.
Для того чтобы объяснить связь между взаимодействием актина и миозина и механическими явлениями, наблюдаемыми при сокращении мышцы, Lymn и Taylor [5] предложили гипотетический механизм реакции, состоящей из 4 стадий: 1) связывания АТФ и быстрой диссоциации актомиозина, 2) гидролиза АТФ свободной головкой миозина, 3) связывания актина с миозином, с которым все еще связаны продукты АТФазной реакции, и 4) отщепления продуктов реакции от миозина. Этот механизм выглядит довольно привлекательным, потому что его легко увязать со стадиями цикла образования головками миозина поперечных мостиков: 1) диссоциацией его головки или поперечного мостика от актиновой нити, 2) поворотом поперечного мостика миозина, 3) соединением поперечного мостика с актином и 4) поворотом последнего в противоположном направлении и созданием тянущего усилия.
Результаты дальнейших исследований [6, 7] показали, что для того, чтобы схема соответствовала действительности, ее необходимо значительно усложнить. Некоторые из новых концепций отражены на рис. 28.1. При измерении флюоресценции миозина было выявлено еще несколько стадий гидролиза АТФ его свободными головками в дополнение к одной стадии, предложенной исходно в модели Lymn и Taylor. На основании других данных считают, что продукты реакции гидролиза АТФ аденозинфосфат (АДФ) и неорганический ортофосфат (Фн) высвобождаются из миозина не за одну стадию, а последовательно. Более того, кинетические исследования позволили выявить, что реакция связывания — диссоциации между актином и комплексом миозин — продукты гидролиза протекает с очень большой скоростью; согласно оценкам, она в 1000 раз выше скорости гидролиза АТФ. В терминах модели скользящих нитей это должно означать, что поперечные мостики (головки миозина) многократно связываются с тонкой нитью и отделяются от нее за один цикл гидролиза АТФ. По-видимому, комплекс, образованный актином и миозином, только тогда создает тянущее усилие и вносит свой вклад в развитие силы сокращения, когда происходит поворот головки миозина при изменении его конформационного состояния после завершения гидролиза АТФ. В случае такого механохимического механизма в одной сократительной единице (саркомер) могут сосуществовать и работать одновременно несколько изоферментов миозина без каких-либо различий в АТФазной активности, ограничивающей скорость сокращения.
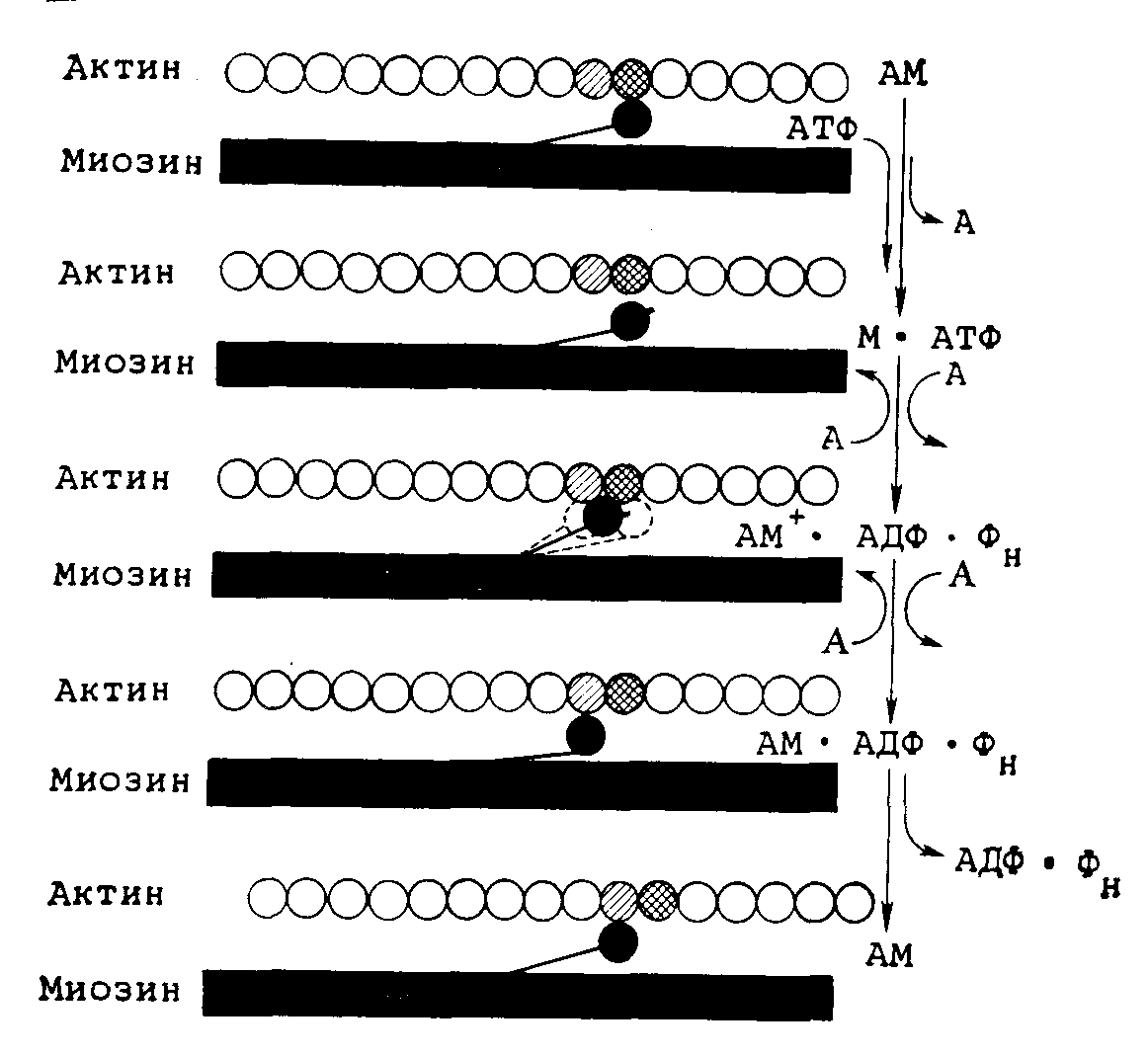
Рис. 28.1. Современная модель связи между сокращением мышцы и гидролизом АТФ, катализируемым актомиозином (AM).
При связывании АТФ с миозином (М) происходит диссоциация актина (А) и миозина и изменяется конформация головок последнего (М), которые быстро связываются с мономерами актина и диссоциируют. Головки миозина, или поперечные мостики, играют роль в развиваемой мышцей силе сокращения лишь в том случае, если конформационные изменения сопровождаются расщеплением АТФ.
