
спектроскопические методы анализа
.pdfМетод стал фармакопейным еще в 1968 году, когда он впервые рекомендовался для контроля качества трех лекарственных веществ: фторотана, оксациллина и метициллина натриевых солей. За прошедшие с этого времени 50 лет значимость ИК-спектроскопии для фармацевтической промышленности значительно возросла и на данный момент Международная фармакопея рекомендует ее использование в анализе примерно половины зарегистрированных препаратов.
Получать ИК-спектры можно как для субстанций, так и в ряде случаев для готовых препаратов. Для этого необходимо, чтобы вспомогательные вещества, входящие в состав готовой формы препарата (например, таблеток), не подавляли спектр действующего вещества. Это условие обычно выполняется, если процентное содержание вспомогательных веществ не слишком велико – обычно менее 60 – 70%. Наличие примесей проявляется в возникновении «лишних» (примесных) полос, а также изменении формы, интенсивности и резкости отдельных исходных полос спектра исследуемого вещества.
При определении подлинности ИК-спектр лекарственного вещества является такой же константой, как температура плавления, кипения и другие физические параметры вещества. Однако, инфракрасные спектры, являясь уникальным средством идентификации вещества, в то же время, подвержены влиянию многих факторов. Спектры могут быть разными у двух различных спектроскопистов: качество растворителей, условия приготовления образца для анализа, кристаллические формы вещества и многие другие факторы могут исказить спектр.
В связи с этим для идентификации лекарственного вещества возможны следующие способы:
Использование образцов сравнения. В соответствии с этим подходом, регистрируют спектр анализируемого вещества и стандартного образца этого же соединения в одинаковых условиях (агрегатное состояние, растворитель, толщина слоя и другие). При этом картина спектров должна совпадать (число полос, их частота, форма контура, рис. 3.38). Такой способ рекомендован, например, для идентификации гормонов стероидной структуры (тестостерона пропионат) и антибиотиков (ампициллина, метациклина).
71
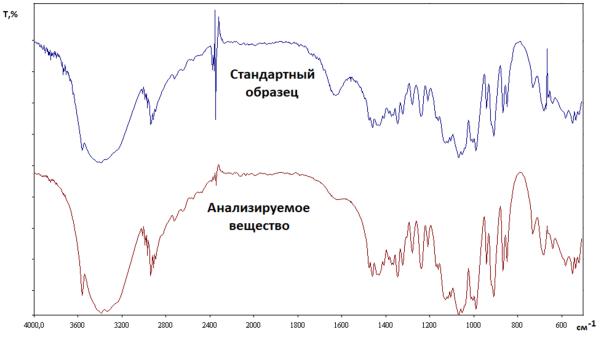
Рис. 3.38. Пример сравнения ИК-спектров в фармакопейном анализе
Использование эталонного спектра. Если стандартный образец отсутствует, допустимо сравнивать полученный спектр анализируемого вещества со спектром, приведенным в фармакопейной статье: в этом случае в статье четко указаны условия получения спектра анализируемого вещества. Этот подход используется, например, для рибоксина, фепромарона, рифампицина и эстрадиола-дипропионата.
Кроме того, в фармакопейных статьях (ФС) некоторых препаратов к записи или анализу ИК-спектров могут быть дополнительно предъявлены особые условия, такие как:
Регистрация наиболее характеристичной области спектра. В некоторых случаях в ФС рекомендуется записывать спектр не во всем диапазоне частот, а наиболее характерные его фрагменты, охватывающие, например, в большей степени область «отпечатков пальцев» (1900 – 700 см-1).
Идентификация по отсутствию определенных пиков. Для некоторых препаратов метод используется в фармакопейном анализе для доказательства отличия лекарственных веществ близкого химического строения (одного ряда) по отсутствию определенных характеристических пиков. Например, в ФС на эстоцин требуется, чтобы в ИК-спектре, снятом в вазелиновом масле, отсутствовала характеристическая полоса
72
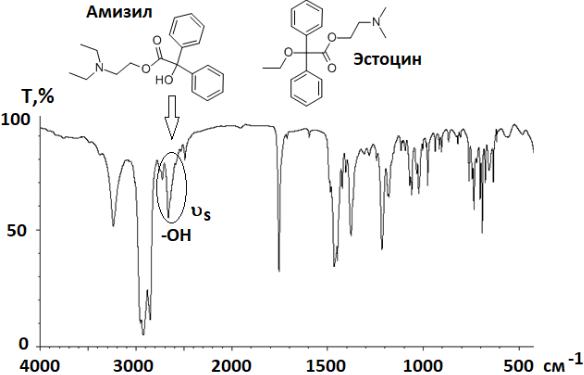
поглощения свободной гидроксильной группы в области 3300 – 3500 см-1 (отличие от амизила, рис. 3.39).
Рис. 3.39. ИК-спектр Амизила с характерной полосой гидроксильной группы
В фармацевтическом анализе для целей количественного определения метод ИК-спектроскопии не нашел широкого применения изза трудностей, не позволяющих добиться сопоставимой точности. К ним относятся: необходимость измерения в очень узкой кювете, длину которой трудно воспроизвести; высокая вероятность перекрывания полос поглощения; небольшая ширина полосы поглощения в максимуме, что приводит к отклонениям от основного закона светопоглощения.
Единственной фармакопеей, рекомендующей количественное определение по поглощению в инфракрасной области, остается Фармакопея США XVII. Принципы количественного анализа в инфракрасной области те же, что и в ультрафиолетовой или в видимой области. Любое поглощение, не связанное с поглощением основного компонента, носит название постороннего поглощения, или поглощения фона. При инфракрасных измерениях такое поглощение может быть
73
значительным, и поэтому установлению нулевой линии и линии 100% пропускаемости придается особое значение.
Возможность получения информации о присутствии в образце тех или иных функциональных групп позволила использовать инфракрасную спектроскопию в медицинских целях. ИК-спектроскопия, в частности, чувствительна к структуре и концентрации макромолекул (нуклеиновых кислот и белков) и гораздо менее применима для обнаружения небольших молекул, которые находятся в клетках в низкой концентрации.
Изменения в ИК-спектрах биологических материалов могут свидетельствовать о патологиях, связанных с нарушением биохимического состава образца. Например, онкогенные изменения часто связаны с присутствием нескольких ядер в клетке. Соответственно, в данном случае инфракрасная спектроскопия покажет диагностические изменения, связанные с усилением поглощения нуклеиновых кислот.
Поскольку колебания в нуклеиновых кислотах возникают в разных частях макромолекулы, их полосы поглощения можно обнаружить в нескольких спектральных диапазонах. Основные колебания наблюдаются между 1800 и 700 см 1. В этом диапазоне различают четыре группы полос: полосы поглощения как следствие валентных колебаний двойных связей в плоскости оснований лежат между 1800 и 1500 см 1; между 1500 и 1250 см-1 находятся полосы, которые сильно зависят от торсионного угла гликозидов в основании; мощные полосы поглощения сахара и фосфата занимают диапазон 1250 – 1000 см 1; ниже 1000 см 1 располагаются полосы, возникающие в результате сопряжения колебаний основной фосфодиэфирной цепи и колебаний групп сахара (рис. 3.40).
Профиль ИК-спектра волос напрямую зависит от аминокислотного состава белков, формирующих их структуру. Различия в аминокислотном составе и соответственно данные ИК-спектра различных образцов обусловлены в первую очередь отличиями в морфологическом характере разных типов волос, кроме того это также может быть связано с условиями окружающей среды, образом жизни и состоянием здоровья человека (рис.
3.41).
74
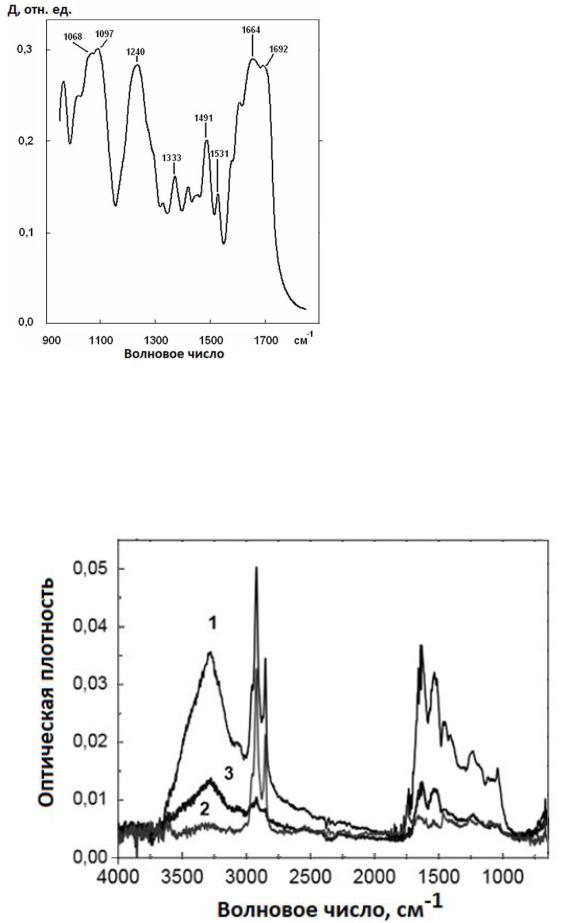
Рис. 3.40. Фрагмент ИК-спектра образца с изолированной ДНК
За последние десятилетия значимость ИК-спектроскопии в биохимических исследованиях стремительно возрастала и в настоящее время этот метод находит применение при решении довольно широкого спектра научных задач.
Рис. 3.41. ИК-спектры различных образцов волос
75
Среди примеров использования этого метода для исследования биологических объектов и процессов можно отметить следующие:
определение относительного содержания α-спирали, β- структур и беспорядочных клубков в белках по интенсивности «амидных» полос (по поглощению NH2-группы и C=O группы);
установление количества водородных связей и функциональных групп, участвующих в образовании водородных связей в макромолекулах;
изучение процессов денатурации и ренатурации молекул белков и нуклеиновых кислот по изменению числа водородных связей;
определение относительного содержания комплементарных пар азотистых оснований А-Т (У) и Г-Ц в молекулах нуклеиновых кислот;
изучение взаимодействия между небольшими молекулами и биополимерами, например, белка с лигандом, фермента с ингибитором, ДНК с катионами металлов и т.д.;
при исследовании тонкостей процесса фотосинтеза ИКспектроскопия активно используется для исследования: структуры и превращений активных центров ферментов, взаимодействий кофакторов переноса электрона с белковым окружением в фотосинтетических реакционных центрах, молекулярного механизма функционирования кислород-выделяющего комплекса фотосистемы II, переноса протона, связанного с переносом электрона, свойств лигандов ионов металлов, свойств и роли молекул воды в структуре фотосинтетических комплексов.
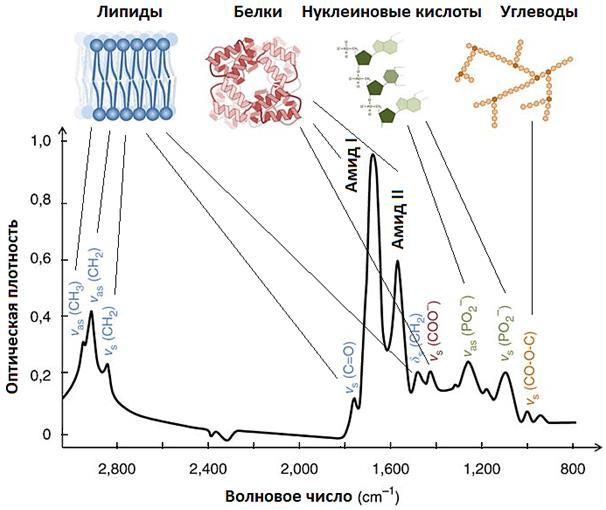
Биологические жидкости чаще всего изучаются в объеме 5 – 10 мкл методом пропускания через стекла из CaF2 или BaF2. При необходимости из получаемых спектров математически вычитается спектр воды. Также воду можно предварительно удалить высушиванием образца и изучать остаток в виде тонкой пленки, однако в этом случае теряется информация
олетучих компонентах образца и о его гидратации. Спектры тканей также получают подобным образом, вырезая и изучая образцы объемом около 1
мм³ (рис. 3.42).
Основные задачи ИК-спектроскопии в судебной экспертизе: анализ волокон с места преступления, анализ пищевых и физиологических образцов, установление принадлежности образцов химических веществ к
76
списку наркотических веществ и контролируемых сильнодействующих препаратов, установление происхождения и марки автомобильных красок, исследование и сравнение типа чернил или тонеров на документах.
Рис. 3.42. Области основных характеристических групп биологических объектов
Из-за специфики анализируемых материалов эксперты применяют ряд необычных модификаций инфракрасной спектроскопии. Например, часто используется ячейка с алмазными наковальнями, позволяющая под действием высокого давления расплющить даже очень небольшой образец (порядка 5 мкм) до приемлемой площади, позволяющей запись инфракрасного спектра пропускания. Если образец невозможно переместить, либо если он имеет отражающую поверхность, ИК-спектр записывают в отражении через микроскоп или обычную ячейку. Иногда используется запись спектра из диффузного отражения.
77
Многие газообразные вещества имеют характерное поглощение в ИК-области спектра, что позволяет регистрировать большинство газов, в том числе оксиды углерода, азота, серы, метан, аммиак, пары органических растворителей и многие другие вещества. Жидкие вещества можно также исследовать, переводя их в газовую фазу. Основные области применения ИК-спектрофотометрии газообразных объектов:
анализ газов в химической и нефтехимической промышленности;
анализ природного газа и продукции газовой промышленности;
контроль токсичных газов в полупроводниковом производстве;
контроль следов примесей в газах медицинского назначения;
контроль атмосферного воздуха, воздуха рабочей зоны и выбросов промышленных предприятий.
Благодаря своим преимуществам и высокой степени автоматизации процесса измерений ИК-спектроскопия может использоваться как эффективное средство контроля при проведении экологических мониторингов, например, для контроля следов углеводородов и определения массовой концентрации углеводородов в воде и почве по интенсивности поглощения метиленовых групп в ИК-спектре.
Таким образом, основываясь на вышеизложенном материале, можно заключить, что, хотя ИК-спектроскопия и не является исключительным методом для определения структуры органических соединений, тем не менее, она находит широкое применение в самых разных отраслях и особенно в химии и технологии биологически активных веществ.
3.2.3. Молекулярная эмиссионная спектроскопия
Люминесценция – это испускание УФ, видимых или ИК фотонов электронно-возбужденной молекулой. Слово «люминесценция», которое пришло из латинского языка (от лат. lumen, род. падеж luminis – свет и escens – суффикс, означающий процесс или состояние), было впервые введено физиком и историком науки Эйльхардтом Вейдеманном как luminescenz в 1888 году для того, чтобы описать «все эти световые
78
явления, которые не обуславливаются только повышением температуры», в противоположность накалу. Люминесценция – холодный свет, в то время как накаливание – горячий свет. Различные типы люминесценции классифицируются согласно виду возбуждения (табл. 3.6).
|
Таблица 3.6 |
Различные типы люминесценции |
|
|
|
Явления |
Вид возбуждения |
Фотолюминесценция (флуоресценция, |
Поглощение света (фотонов) |
фосфоресценция, замедленная |
|
флуоресценция) |
|
Радиолюминесценция |
Ионизирующее излучение |
|
(рентгеновские лучи, α, β, γ-лучи) |
Катодолюминесценция |
Катодные лучи (пучок электронов) |
Электролюминесценция |
Электрическое поле |
Термолюминесценция |
Нагрев после предварительного |
|
накопления энергии (например |
|
радиоактивное излучение) |
Хемилюминесценция |
Химический процесс (напр. окисление) |
Биолюминесценция |
Биохимический процесс |
Триболюминесценция |
Силы трения и электростатические |
|
силы |
Сонолюминесценция |
Ультразвук |
Люминесцентные вещества могут иметь самое разнообразное строение:
•органические соединения: ароматические углеводороды (нафталин, антрацен, фенантрен, пирен, перилен и др.), флюоресцеин, родамины, кумарины, оксазины, полиены, дифенилполиены, аминокислоты (триптофан, тирозин, фенилаланин) и др. Чем больше органическое соединение поглощает электромагнитное излучение УФдиапазона, тем сильнее его возможная флуоресценция.
Способностью к флуоресценции обладают органические соединения различных классов: алифатические, насыщенные циклические, ароматические и прочие, содержащие систему сопряженных связей, ароматические с гетероатомами. Следует отметить, что флуоресценция отсутствует, если возможно вращение одной части молекулы относительно другой. Примером может служить реакция комплексообразования
79
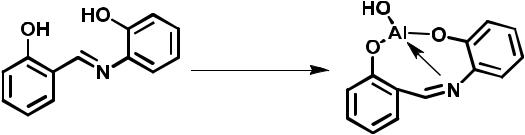
салицилаль-о-аминофенола с ионом алюминия, которая используется в качественном анализе (рис. 3.43).
Рис. 3.43. Салицилаль-о-аминофенол и его комплекс с катионом алюминия
Молекула салицилаль-о-аминофенола не проявляет флуоресценции из-за того, что энергия, которая могла бы излучаться, расходуется на вращение ароматических фрагментов вокруг двойной связи. Однако ее комплекс с алюминием, образование которого исключает возможность свободного вращения ароматических фрагментов вокруг простых связей, обладает ярко-зеленой флуоресценцией.
•неорганические соединения: катион уранила (UO2+), ионы лантаноидов (Eu3+, Tb3+), легированные стекла (напр. c Nd, Mn, Ce, Sn, Cu, Ag), кристаллы (ZnS, CdS, ZnSe, CdSe, GaS, GaP, Al2O3/Cr3+ (рубин)), и др.
•металлорганические соединения: комплексы рутения, комплексы с ионами лантаноидов, комплексы с флуорогенными хелатными добавками (например, 8-гидроксихинолин, также называемый оксином) и др.
Флуоресценция и фосфоресценция – частные случаи люминесценции.
Видом возбуждения является поглощение фотонов, которое переводит поглощающую молекулу в электронно-возбужденное состояние.
Флуоресценция – это испускание, происходящее при возвращении спаренного электрона на более низкую орбиталь. Такие переходы квантово-механически «разрешены», а типичные величины скоростей испускания для них ~108 с-1. Высокие значения скоростей испускания приводят к временам затухания флуоресценции ~10 8 с (10 нс). Время жизни – это средний период времени, в течение которого флуорофор находится в возбужденном состоянии.
Фосфоресценция – это испускание, происходящее при переходе между состояниями различной мультиплетности, как правило, из
80
