
Салициловая_Потенциометрия
.docxРабота. Определение слабой органической кислоты методом потенциометрического титрования
В качестве задачи студенту предлагается одна из слабых органических кислот: сульфосалициловая, салициловая, ацетилсалициловая, аскорбиновая.
ЗАДАНИЕ: Определить массовую концентрацию раствора кислоты методом потенциометрического титрования. Результат [мг/мл] представить в виде среднего значения (минимум 3 титрования) и показать область неопределенности (доверительный интервал или среднеквадратичное стандартное отклонение).
Ниже приведен пример для салициловой кислоты.
Формула салициловой кислоты (2-гидроксибензойная кислота), C7H6O3, показана на рис.1:

Салициловая кислота является слабой двухосновной кислотой. Константы кислотной диссоциации салициловой кислоты (рКа) по первой и второй ступеням соответственно равны 2,97 и 13,59 [1]. Концентрацию салициловой кислоты можно определить прямым титрованием ее щелочным титрантом, используя потенциометрическую индикацию конечной точки титрования. На кривой потенциометрического титрования салициловой кислоты возможно зарегистрировать только один скачек, соответствующий титрованию карбоксильной группы (титрование по первой ступени).
Если в качестве титранта использовать NaOH, то реакция титрования выглядит следующим образом:

HC7H5O3 + NaOH = NaC7H5O3 + H2O
fэкв (HC7H5O3) = fэкв (NaOH) = 1/1.
Схема расчета результатов титрования:

Следует помнить, что необходимо предварительно стандартизовать раствор NaOH, используемый в качестве титранта.
Для установления конечной точки титрования (КТТ) в работе используют потенциометрическую индикацию (теория потенциометрического титрования описана в [2]). Для этого необходимо проводить титрование в потенциометрической ячейке со стеклянным электродом в качестве индикаторного. В ходе титрования регистрируют показания рН-метра (единицы рН или мВ) в ходе титрования и строят кривую титрования в координатах: рН = f(Vтитранта).
КТТ определяют по скачку электродного потенциала (рН) на кривой титрования. Вид кривой титрования слабой одноосновной кислоты и графические способы определения КТТ представлен на рис.1.
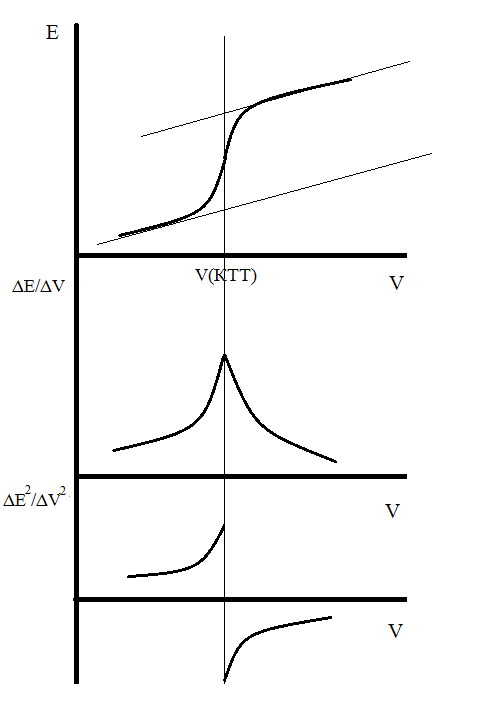
Рис.1 Кривые потенциометрического титрования и способы установления КТТ
РАСТВОР И РЕАГЕНТЫ
Гидроксид натрия (NaOH), 0,0100М, стандартный раствор (титрант).
Янтарная кислота (СOOHCH2CH2COOH), M = 118,09 г/моль, хч, установочное вещество.
Вода дистиллированная.
Растворы для калибровки рН-метра( рН=7,0 и 4,01).
Задача: Титруемый раствор слабой кислоты выдает лаборант. По выбору преподавателя: салициловая, сульфосалициловая, ацетилсалициловая или аскорбиновая кислоты.
ОБОРУДОВАНИЕ
рН-метр (PCE-228), с цифровой индикацией и универсальным стеклянным электродом.
Магнитный перемешиватель (IKA lab disk)
Посуда: Бюретка объемом 25 мл; пипетки объемом 5 мл и 10 мл; колбы мерные объемом 100мл, стаканы для титрования объемом 50 мл.
ВЫПОЛНЕНИЕ ОПРЕДЕЛЕНИЯ
Готовят бюретку для титрования. Для этого ее промывают дистиллированной водой, а затем небольшой порцией титранта. Уровень титранта в бюретке подводят к отметке «0» на шкале бюретки.
Проводят калибровку рН-метра по стандартным буферным растворам. Используют стандартную методику, описанную в технической документации прибора.
В чистый стакан для титрования вносят пипеткой 5 мл титруемого раствора слабой кислоты, погружают туда магнитный перемешиватель и устанавливают стакан с пробой на магнитную мешалку. В приготовленный раствор погружают универсальный электрод и доливают порцию дистиллированной воды так, чтобы шарик электрода был полностью погружен в раствор. После перемешивания раствора начинают титрование, добавляя небольшие порции титранта (первое титрование по 0,5 мл). Дождавшись установления равновесия после каждой добавленной порции титранта, записывают показания рН-метра в таблицу:
Результаты ориентировочного титрования
|
Объем раствора титранта, мл |
рН (Е, мВ) |
ΔрН (ΔЕ, мВ) |
|
0 |
|
|
|
0,5 |
|
|
|
1,0 |
|
|
|
1,5 |
|
|
|
2,0 |
|
|
Титрование заканчивают тогда, когда значения рН (Е) перестают изменяться после прохождения скачка титрования. После проведения ориентировочного титрования проводят точное титрование, ориентируясь на уже известные из ориентировочного титрования объемы титранта. В ходе точного титрования в области скачка титрования титрант из бюретки добавляют равными порциями по 2 капли. Результаты титрования заносят в таблицу и строят кривую титрования. Точное титрование проводят не менее трех раз.
Для каждой кривой титрования находят объем титранта, соответствующий КТТ и рассчитывают содержание салициловой кислоты в анализируемом растворе (мг). Результат титрования (мг анализируемого раствора в объеме колбы) представляют в выводе, указав область неопределенности результата.
Список литературы для подготовки
-
Справочник по аналитической химии. Лурье Ю.Ю. – М.: Химия, 1989 г.
-
Практикум по физико-химическим методам анализа. Учебное пособие\под редакцией Петрухина О.М., 2006.
Дополнительная:
-
Петрухин О.М.(ред.), Аналитическая химия. Физические и физико-химические методы анализа. Учебник для вузов - М.: Химия, 2001. – 497 с.
-
Отто М. Современные методы аналитичской химии (в 2-х томах). Учебник. – М.: Техносфера, 2008. – 544 с.
-
Кристиан Г. Аналитическая химия (в 2-х томах). Учебник. – М: Лаборатория знаний, 2013, том 1 - 623 c., том 2 - 504 с.
