
спектроскопические методы анализа
.pdf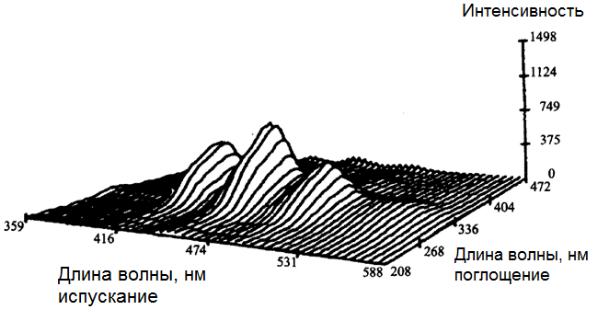
флуоресценции, |
образуя |
трехмерный |
спектр |
возбуждения |
и |
флуоресценции. Пример такого спектра представлен на рис. 3.50.
Рис. 3.50. Трехмерный спектр поглощения антрацена
Использование спектрофлуориметрии
Прямая (на основе градуировочного графика) спектрофлуориметрия возможна в тех случаях, когда определяемое соединение способно к собственной флуоресценции. Это возможно для ароматических углеводородов (например, в сырых нефтях), белков (например, в сыворотке крови, в коровьем молоке), некоторых лекарств (например, морфина), хлорофилла и т.п.
Описаны многочисленные области применения: анализ загрязнителей воздуха и воды, анализ нефти, пищи, лекарств; мониторинг промышленных процессов; контроль веществ медицинского назначения; криминология и т.п.
Однако большинство ионов и молекул нефлуоресцентны, и основные косвенные методы, которые используются в этом случае, следующие:
Преобразование (дериватизация), т. е. реакция анализируемого вещества с реагентом, ведущая к образованию флуоресцентного
91
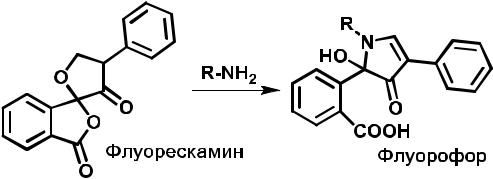
соединения. Наиболее часто дериватизацию используют в жидкостной хроматографии вместе с флуоресцентным определением. В настоящее время этот метод применяют в биохимии и клинической химии. На рис. 3.51 приведена схема дериватизации, которую часто применяют для регистрации первичных аминов, не обладающих собственной флуоресценцией.
Рис. 3.51. Пример флуоресцентной дериватизации первичных аминов
В качестве дериватизирующего агента используют реагент флуорескамин. Продукт, получающийся в результате реакции, обладает яркой флуоресценцией и позволяет определять любые первичные амины. Эту реакцию можно применить и для регистрации белков, имеющих первичные аминогруппы.
Образование флуоресцентного продукта реакции – основа большинства методов определения ионов и молекул.
Затухание флуоресценции, протекающее в результате столкновения анализируемого вещества с флуоресцентным соединением. Этот метод особенно хорошо подходит для обнаружения газов, таких как кислород (растворенный в воде или крови), SO2, H2S, аммиак, HCl, Cl2, хлоруглеродов и т.д.
Флуоресцентный метод измерения парциального давления кислорода
Кислород, будучи триплетной молекулой, способен эффективно тушить флуоресценцию и фосфоресценцию некоторых люминофоров.
92
Этот эффект (впервые описанный австрийским химиком Хансом Каутским в 1939 г.) называется «динамическим тушением флуоресценции». Столкновение молекулы кислорода с флуорофором в возбужденном состоянии приводит к безызлучательной передаче энергии. Степень тушения зависит от частоты столкновений, а следовательно, от концентрации, давления и температуры кислородсодержащей среды.
Излучение, как правило, синего (~ 475 нм) светодиода передается в зонд по оптическому волокну и возбуждает флуоресценцию специально подобранного химического комплекса, внедренного в тонкослойное зольгелевое покрытие на конце зонда. Гидрофобная золь-гелевая матрица эффективно удерживает флуоресцирующий комплекс и защищает его от воды. Возбужденный комплекс флуоресцирует в видимой области спектра с максимумом вблизи 600 нм. При столкновении с молекулой кислорода происходит безызлучательная передача избыточной энергии, что приводит к уменьшению, или тушению, сигнала флуоресценции. Степень тушения зависит от концентрации кислорода в золь-гелевом покрытии, которая находится в динамическом равновесии с концентрацией кислорода в образце. Излучение флуоресценции собирается зондом и по оптическому волокну передается в спектрометр. Полученный спектр и данные его обработки отображаются на дисплее или на компьютере.
В качестве красителей (флуорофоров), обладающих флуоресценцией, могут быть применены полимерные композиции на основе полиароматических красителей, например, пирена или декациклена, а также на основе флуоресцирующих комплексов рутения Ru(bpy)3, Ru(phen)3, [Ru(dpp)2Phen]2+, где dpp = 4,7-дифенил-1,10-фенантролин, Phen = 1,10-фенантролин, или допированного в пленку оксида алюминия комплекса тербия (III) с ацетилацетоном и 1,10-фенантролином (Tb(acac)3phen), рис 3.52. Аналогично можно применять фосфоресцирующие красители порфириновой природы, Pt- и Pdкомплексы порфиринов.
Время отклика зонда ограничено скоростью диффузии кислорода в покрытие. В вязких образцах отклик определяется диффузией через образец. Зонд будет откликаться достаточно быстро в воде и заметно медленнее в маслах, эмульсиях.
93
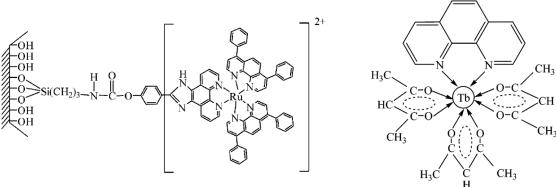
[Ru(dpp)2Phen]2+ |
Tb(acac)3phen |
Рис. 3.52. Примеры флуоресцентных комплексов для измерения парциального давления кислорода
В воде диапазон измерений составляет 0 – 40,7 ppm (парциальное давление 0 – 760 мм рт. ст.). В отличие от электродов, оптический зонд не расходует кислород. Это означает, что перемешивание образца уменьшает время отклика, но не влияет на конечные равновесные показания. При нанесении на зонд дополнительных покрытий, предохраняющих от засветки и увеличивающих химическую стойкость, время отклика увеличивается до 30 – 50 с в жидкостях.
Затухание флуоресценции также используют для изучения комплексообразования флуоресцентных молекул с соединениями, не обладающими флуоресценцией в том случае, когда продукт комплексообразования приводит к уменьшению или исчезновению люминесценции. Примером может служить альбумин, который обладает собственной флуоресценцией за счет входящего в состав его молекулы триптофана. Константы связывания альбумина с антибиотиками можно рассчитать, используя явление затухания его флуоресценции при образовании комплекса с молекулой антибиотика.
Наконец, иммунофлуоресцентный анализ – метод, имеющий большую важность для биохимического, диагностического, лабораторного и биомедицинского применения. Иммунофлуоресцентный анализ (ИФА, или МФА – метод флуоресцирующих антител, иммунофлуоресценция) – набор иммунологических методов для качественного и количественного определения поверхностных и внутриклеточных антигенов в образцах
94
клеточных суспензий. Метод позволяет детально анализировать биологические образцы на присутствие определенных антигенных детерминант, характерных для определенных возбудителей или заболеваний, проводить количественную оценку как поверхностных, так и внутриклеточных белков и рецепторов.
Общее микробное число. Метод АТФ
Определение общего микробного числа основано на принципе биолюминисценции и относится к скрининговым методам, что позволяет быстро и безопасно выявлять потенциально опасные биологические риски. Тест обязательно применяют для оценки качества технических и сточных вод, реже питьевой воды. В основе лежит люциферин-люциферазная реакция – аналитический методом определения аденозинтрифосфата (АТФ). Когда в 1947 году МакЭлрой показал, что в реакции биолюминесценции светляка одним из обязательных компонентов является АТФ, в биохимическом анализе была открыта новая глава.
Молекула АТФ – универсальный энергетический носитель в клетке. Основная масса АТФ синтезируется на мембранах митохондрий. Множество ферментов используют АТФ в катализируемых ими превращениях. Концентрация АТФ внутри клетки всегда поддерживается примерно на одном и том же уровне, поэтому изучение ее варьирования позволяет оценить метаболический потенциал клеток. До тех пор пока клетка здорова и функционирует, она стремится сохранить нормальный уровень АТФ, однако когда клетка умирает, уровень АТФ стремительно падает. Изучение уровня АТФ в клетках позволяет оценить действие различных агентов на их пролиферацию или измерить цитотоксичность.
Для осуществления данного метода анализа необходима биохимическая реакция фермента люциферин/люцифераза (специальный реактив) с молекулами АТФ микроорганизмов, находящихся в анализируемой воде. Когда молекулы АТФ вступают в контакт с жидким люциферин/люциферазным реагентом, происходит генерирование холодного света (рис. 3.53).
95
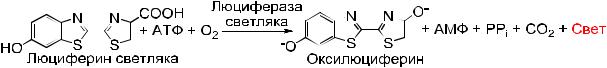
Рис. 3.53. Люциферин-люциферазная реакция
Люминометр подсчитывает объем образовавшегося света и всего через 15 с выводит на дисплей информацию об уровне загрязнения. Вывод прост – чем выше показания измерительного прибора, тем выше уровень загрязнения.
Поскольку реакции биолюминесценции не требуют внешнего источника света (в отличие от процессов флуоресценции), то измерения можно проводить на темном фоне. В ходе эксперимента не наблюдается осложнений, связанных с разогревом и дрейфом источника света, помехами от рассеяния света и от возможных флуоресцентных компонентов. И именно поэтому биолюминесцентные методы сверхчувствительны, обеспечивают хорошее пространственное разрешение, широкий динамический диапазон и простую количественную оценку сигнала.
Так как АТФ можно найти во всех живых организмах, то по его наличию или отсутствию можно делать вывод о загрязненности пробы различными микроорганизмами: бактериями, спорами грибов и т.д. На сегодняшний день светлячковую люциферин-люциферазную систему и ее модификации используют для определения концентрации АТФ в широком ряду различных исследований.
Возможность использовать низкие концентрации реагентов породила набор методов высокопроизводительного скрининга для разработки лекарственных средств. Биолюминесцентный анализ по репортерным генам позволил совершить значительный прогресс в фундамендальных и прикладных областях науки: от изучения молекулярных взаимодействий до экологического мониторинга.
И, наконец, неинвазивный биолюминесцентный имиджинг in vivo вырос в мощную альтернативу другим имиджинговым технологиям, трансгенные биолюминесцентные животные становятся удобными
96
моделями для проведения доклинических испытаний и патофизиологических исследований.
Также по изменению уровня АТФ можно оценить воcприимчивость бактерий к антибиотикам. Замечательным свойством данного метода, помимо его исключительной скорости, является то, что молекула АТФ может быть обнаружена в концентрации до 1·10 18 моль, что в реальности соответствует пяти бактериальным клеткам.
Ранее использовавшиеся микробиологические тесты на загрязнение на сегодняшний день устарели, поскольку результаты надо ждать от 2 до 6 дней, в то время как стандартный АТФ тест занимает лишь 15 – 20 с и при этом гораздо более чувствителен.
Влияние молекулярной структуры на флуоресценцию
Большинство флуоресцентных соединений – ароматические или гетероароматические. Некоторые алифатические соединения с высокой степенью ненасыщенности также флуоресцентны. Увеличение в протяженности π-электронной системы (т.е. степени сопряжения) приводит к сдвигу спектров поглощения и флуоресценции в область больших длин волн и к увеличению квантового выхода флуоресценции. Это простое правило проиллюстрировано гомологическим рядом линейных ароматических углеводородов: нафталином, антраценом, нафтаценом и пентаценом, которые испускают флуоресценцию в ультрафиолетовой, синей, зеленой и красной областях, соответственно.
Низколежащие переходы в ароматических углеводородах относятся к π→π* типу, который характеризуется большими молярными коэффициентами поглощения и относительно высокими квантовыми выходами флуоресценции. Когда гетероатом вовлечен в π-систему, переход n→π* может быть низколежащим переходом.
По химическому строению флуоресцентные красители, использующиеся в настоящее время – это ароматические и гетероциклические соединения с электронодонорными и (или) электроноакцепторными заместителями. Наиболее интенсивной
97
флуоресценцией обладают, как правило, 5- и 6-членные гетероциклические фрагменты, включенные в развитую систему сопряженных связей. Существенную роль играет жесткость молекулы, исключающая возможность безызлучательных процессов релаксации через колебания и вращение отдельных фрагментов системы. Электронодонорные заместители в большинстве случаев повышают, а электроноакцепторные – понижают интенсивность люминесценции.
Флуоресцентные красители применяются либо в разбавленных растворах (при этом увеличение концентрации флуоресцентных красителей может снижать интенсивность флуоресценции, за счет эффекта концентрационного тушения), либо в кристаллическом состоянии.
К флуоресцентным красителям относятся широко применяемые в быту и технике оптические отбеливатели, а также соединения ряда флуоресцеина и родамина (группа ксантеновых красителей). Последние используются при изготовлении флуоресцентных пигментов. Эти пигменты придают краскам повышенную яркость (в 1,5 – 2 раза выше, чем у обычных красок) благодаря тому, что к отраженной части видимого спектра прибавляется флуоресценция.
Среди природных соединений веществ с высокой способностью к флуоресценции довольно мало. Большинство флуорофоров, нашедших широкое практическое применение в различных областях научных исследований и промышленности, создано синтетически.
В настоящее время существует большое разнообразие искусственных флуорофоров с различными фотофизическими свойствами. Основные классы:
малые органические красители,
координационные соединения лантаноидов,
флуоресцентные белки,
полупроводниковые нанокристаллы.
Каждый класс имеет свои специфические особенности, преимущества и недостатки.
Малые органические флуорофоры. Малые органические флуорофоры – крупнейший класс флуоресцентных соединений. В большинстве случаев это относительно небольшие органические вещества,
98
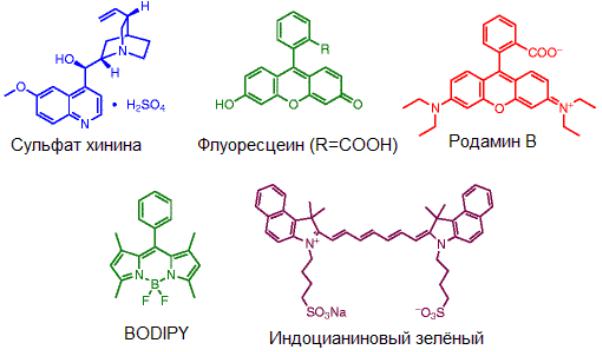
содержащие несколько сопряженных ароматических фрагментов (рис.
3.54).
Рис. 3.54. Структурные формулы органических флуорофоров
Флуоресцентными свойствами обладает чрезвычайно большое количество органических соединений, но практическое значение имеет только ограниченное их количество – производные нескольких базовых структур. Это производные кумарина, флуоресцеина, родамина, борфторидных комплексов дипирролилметена BODIPY, цианиновые и сквариновые красители (рис. 3.54).
Цвет флуоресценции малых органических красителей может варьироваться в очень широких пределах. Так, например, производные кумарина и флуоресцеина имеют синюю и зеленую флуоресценцию соответственно. Производные родамина и BODIPY могут иметь желтокрасную флуоресценцию, тогда как на базе цианинов и скваринов созданы красители, которые флуоресцируют в красном и ближнем инфракрасном цвете. Флуоресценцией красителя можно управлять, изменяя природу функциональных групп, присоединенных к флуорофору.
Другой особенностью малых органических флуорофоров является то, что их флуоресценцию можно «включать» с помощью минимальных
99
изменений в химической структуре. Это широко используется в создании флуоресцентных зондов на основе таких молекул. Примером служит флуоресцеин, который может существовать в форме двух таутомеров: в нефлуоресцентной лактонной форме и флуоресцентной открытой форме.
Значительное преимущество органических флуорофоров – возможность менять их фотофизические свойства с помощью варьирования функциональных групп. Другими преимуществами считаются малый размер и возможность селективного ковалентного мечения биомолекул. К недостаткам относят умеренные квантовые выходы флуоресценции, низкая яркость, низкая химическая стабильность и быстрое фотообесцвечивание под действием лазерного излучения.
Координационные соединения. Флуоресцентные свойства присущи некоторым катионам металлов из группы лантаноидов (Ln3+). За поглощение и излучение света этими атомами отвечают переходы электронов f-подуровня, которые в большинстве случаев квантовомеханически запрещены. Поэтому флуоресценция лантаноидов имеет определенные особенности, в частности очень длинные времена жизни возбужденного состояния, которые на 3 – 4 порядка выше, чем времена жизни органических флуорофоров. Из-за наличия нескольких возможных электронных переходов с разными энергиями, в спектрах флуоресценции лантаноидов наблюдается набор отдельных полос, характерных для каждого элемента. Цвет эмиссии может варьироваться от голубого (Tm) до инфракрасного (Er). Обычно лантаноиды используют в форме комплексов с органическими лигандами, которые повышают эффективность возбуждения атомов металла (сенсибилизация).
Флуоресцентные белки. Важной группой флуорофоров являются флуоресцентные белки. Первый представитель этого класса – зеленый флуоресцентный белок (ЗФБ) – был выделен из медузы Aequorea victoria в 1962 году. Это относительно небольшой белок с молекулярной массой 27 кДа, который поглощает синий свет и флуоресцирует зеленый.
В 1996-м году трехмерное строение дикого ЗФБ и его мутантов было исследовано методом дифракции рентгеновских лучей. Было выяснено, что белок имеет структуру, подобную цилиндру, который образован несколькими бета-листами. В центре цилиндра расположен флуорофор,
100
