
спектроскопические методы анализа
.pdf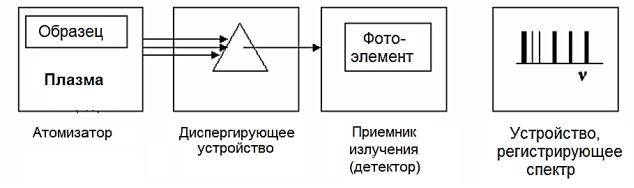
Рис. 3.8. Принципиальная схема метода АЭС анализа
В ходе выполнения метода вещество атомизируется в высокотемпературном атомизаторе (плазме), атомы образца возбуждаются и испускают характеристические линейчатые спектры излучения. Диспергирующее устройство (монохроматор) выделяет требуемый для анализа диапазон излучения, как правило, наиболее интенсивную линию атомного спектра, интенсивность которой регистрируется.
Излучение, пройдя монохроматор, поступает на фотоэлемент, в котором возникает пропорциональный полученному сигналу фототок. Последним в схеме служит регистрирующее устройство.
Соотношение возбужденных (N ) и невозбужденных атомов (N0) в высокотемпературной плазме зависит от температуры и регулируется соотношением Больцмана:
N |
= |
g |
∙ e−E⁄kT, |
(5) |
N0 |
|
|||
|
g0 |
|
||
где N0, N – число невозбужденных и возбужденных атомов; g0, g – статистические веса невозбужденных и возбужденных атомов; E – потенциал ионизации атома.
Соответственно, величина регистрируемого сигнала будет зависеть и от температуры источника. Современная приборная база метода имеет различные по типу, возможностям и цене атомизаторы, монохроматоры и регистрирующие устройства. Выбор их при комплектации прибора зависит, прежде всего, от решаемой задачи (агрегатное состояние пробы, задачи количественного анализа или идентификации, температура возбуждения анализируемого вида атомов и т.д.).
21
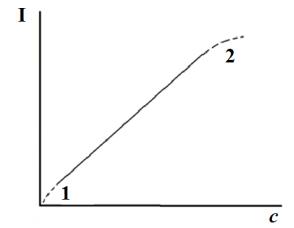
Количественный анализ в методе АЭС основан на использовании зависимости интенсивности излучения регистрируемой спектральной линии атома (I) от его концентрации (c):
I = a·c, (6)
где a – эмпирический коэффициент (рис. 3.9).
1 – область влияния ионизации
2 – область влияния самопоглощения
Рис. 3.9. Количественный анализ в АЭС
В реальных условиях возможна и нелинейная зависимость АС от концентрации, тогда выполняется эмпирическая формула Ломакина – Шайбе:
I = a·cb |
(7) |
При выполнении метода важно иметь в виду, что линейная зависимость АС от концентрации может нарушаться как при малых концентрациях атомов в источнике излучения, так и при больших его концентрациях. В области низких концентраций на вид концентрационной зависимости сигнала сильно может влиять ионизация атомов, в то время как основной вклад в отклонение от линейности сигнала в области высоких концентраций вносит явление самопоглощения атомами излучения. Самопоглощение связано с тем, что более «холодные» атомы, присутствующие в периферических областях источника (например, пламени), способны сами поглощать характеристическое излучение более «горячих» атомов пробы. Это явление может приводить даже к раздвоению спектральной линии (рис. 3.10).
22
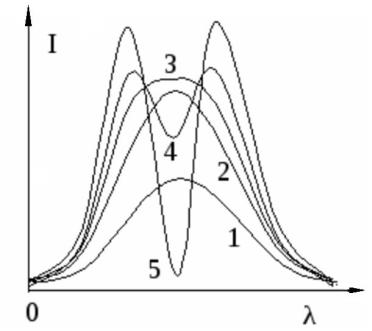
Рис. 3.10. Профиль спектральной линии. Явление самопоглощения:
1, 2 – самопоглощение малό; 3, 4 – великό; 5 – раздвоение линии
При малых концентрациях анализируемого вещества в источнике излучения ионизация может оказывать существенное влияние на концентрационную зависимость сигнала. Это связано с тем, что спектры поглощения ионов отличаются от спектра поглощения атомов, что влияет на интенсивность излучения спектральной линии атома, на которую настроен монохроматор прибора. И в том случае, если доля ионов велика,
то влияние ионизации пробы становится более ощутимо. Поэтому,
температура источника излучения (атомизатора) в этом методе важна.
Особенно для атомов, имеющих низкий потенциал ионизации.
Возможности метода очень сильно зависят от используемого типа атомизатора. В табл. 3.2 приведены характеристики используемых атомизаторов в методе АЭС.
Следует отметить, что наибольшую чувствительность обеспечивает атомизатор на основе индуктивно-связанной плазмы (ISP, ИСП).
23
|
|
|
|
|
|
Таблица 3.2 |
|
|
Атомизаторы, используемые в методе АЭС |
||||
|
|
|
|
|
|
|
Тип |
|
|
Агрегатное |
Сmin, |
Относительная |
|
|
t, C |
состояние |
||||
источника |
|
мас. % |
ошибка, Sr |
|||
|
|
пробы |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1500 – 3000 |
Раствор |
10-7 – 10-2 |
0,01 – 0,05 |
пламя |
|
|
|
|
|
|
|
Эл. |
|
|
|
|
|
|
дуга |
|
3000 – 7000 |
Твердое |
10-4 – 10-2 |
0,1 – 0,2 |
|
|
|
||||
|
|
|
|
|
|
|
|
Эл. |
|
|
|
|
|
|
искра |
10000 – 12000 |
Твердое |
10-3 – 10-1 |
0,05 – 0,1 |
|
|
|
|
|
|
|
|
|
|
|
6000 – 10000 |
Раствор |
10-8 – 10-2 |
0,01 – 0,05 |
|
ИСП |
|
|
|
|
|
3.1.2. Метод атомно-адсорбционной спектроскопии (ААС)
Метод ААС основан на поглощении характеристического монохроматического излучения оптического диапазона невозбужденными свободными атомами. В отличие от предыдущего метода, в ААС ЭМИ воздействует на атомы, находящиеся в невозбужденном состоянии и они поглощают излучение. Метод характеризуется более высокой по сравнению с методом АЭС чувствительностью. Это объясняется бóльшей заполненностью невозбужденных энергетических состояний атома по
24
сравнению с возбужденными, и соответственно, более интенсивным АС
(рис. 3.11).
Рис. 3.11. Принципиальная схема метода ААС:
1 – источник излучения; 2 – атомизатор пробы; 3 – монохроматор; 4 – фотоэлемент; 5 – регистрирующее устройство
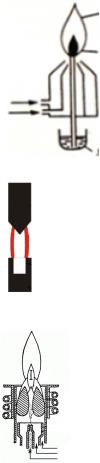
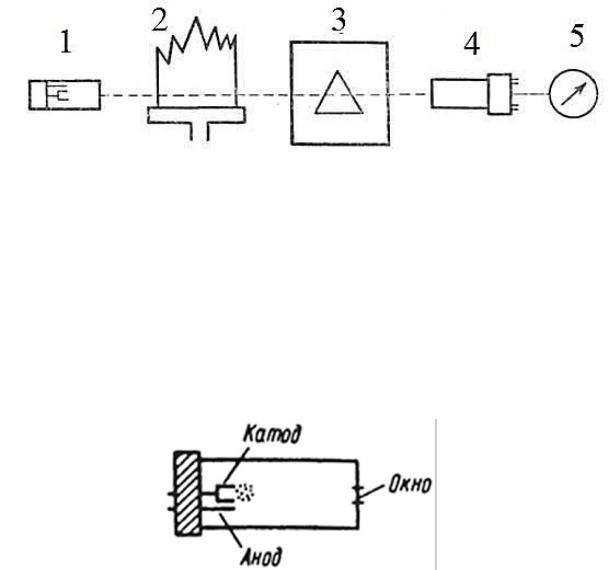
Особенностью метода является источник излучения, который должен обеспечивать очень узкое характеристическое излучение, т.е. излучение конкретного вида атомов. Наиболее часто это лампа с полым катодом (рис. 3.12) – источник линейчатых спектров. Спектр лампы с полым катодом – атомный спектр материала чаши катода.
Рис. 3.12. Лампа с полым катодом в ААС
Лампа состоит из чаши, выполненной из определяемого элемента или его сплава и анода, изготовленного из тугоплавкого металла, например, вольфрама. Катод и анод помещены в баллон с кварцевым окошком. Трубка заполнена инертным газом (чаще аргоном) при пониженном давлении. Высокое напряжение, приложенное к электродам, вызывает ионизацию газа, положительные ионы которого бомбардируют катод, выбивая из него атомы. Атомы возбуждаются в плазме и испускают характеристические линейчатые спектры. Таким образом, для анализа каждого вида атомов необходима своя лампа с полым катодом. В
25

лаборатории, эксплуатирующей такой прибор, как правило, есть определенный набор таких ламп, в зависимости от выполняемых лабораторией задач. Изготовляют также и многоэлементные лампы с полым катодом, состоящие из нескольких элементов. В этом случае одна лампа служит для определения нескольких видов атомов, как правило, не более трех. Из описанного становится ясным, что многоэлементный и качественный анализ в этом методе невозможен, соответственно, метод ААС служит только для количественного анализа.
Возможности метода ААС обеспечиваются и различными вариантами атомизаторов (рис. 3.13), которые переводят пробу в состояние атомного пара. Атомизаторы служат «кюветой» в этом методе.
Щелевая горелка |
Электротермический атомизатор |
1 – источник излучения
1 – щель горелки
2 – ввод пробы
2 – крыльчатка
3 – электрические контакты
Рис. 3.13. Виды атомизаторов с ААС
В случае использования горелки в качестве атомизатора, температура, создаваемая в атомизаторе, зависит от типа используемой для пламени газовой смеси. С точки зрения полноты превращения пробы в атомный пар преимущества имеет электротермическая атомизация пробы. Этот вид атомизатора обеспечивает большую чувствительность определения.
Количественный анализ в методе ААС основан на законе, аналогичном закону Бугера – Ламберта – Бера. Данным методом можно определить около 70 элементов таблицы Менделеева. Следует также отметить, что метод ААС отличается лучшей селективностью, по
26
сравнению с методом АЭС. Это связано с тем, что вероятность перекрывания линий поглощения различных элементов очень мала.
Как уже было сказано ранее, методы атомного анализа отличаются очень высокой чувствительностью. В табл. 3.3 проведено сравнение метрологических характеристик двух методов.
Таблица 3.3
Метрологические характеристики методов атомной спектроскопии
Метрологические |
АЭС |
ААС |
|
характеристики |
|||
|
|
||
Чувствительность, сmin |
до 10 8 |
Пламя – 10 6 – 10 4 |
|
(мас. %) |
ИСП |
|
|
Электротермическая ионизация – |
|||
|
|
||
|
|
10 9 – 10 7 |
|
Воспроизводимость, Sr |
0,01 – 0,05 |
Пламя – 0,005 – 0,05 |
|
|
ИСП |
|
|
|
Электротермическая ионизация – |
||
|
|
||
|
|
0,02 – 0,1 |
Методы атомной спектроскопии используются при анализе органических проб. Эти методы доминируют при элементном анализе в фармацевтике. Они широко представлены во всех мировых фармакопеях. Чаще всего с их помощью определяют примеси металлов в биологических и клинических пробах, в лекарственных формах, субстанциях и в лекарственном сырье. Наиболее простыми вариантами оборудования являются приборы с пламенными источниками возбуждения. Так, метод пламенной фотометрии (АЭА) применяют для определения щелочных и щелочно-земельных атомов (Na, K, Ca, Li и Ba) в лекарственных средствах. ААС с пламенной атомизацией используется для определения
Mg, Zn, Pb, Ni, Cu, Fe, Ba, Ca, Ag, Na, а также Pt, Pd, Sn. Большими аналитическими возможностями обладают приборы АЭС и индуктивносвязанной плазмой (АЭА-ИСП). Эти приборы обеспечивают возможность многоэлементного анализа и высокую чувствительность определений.
27
3.2.Методы молекулярной спектроскопии видимого
иУФ-диапазона
Методы молекулярного спектрального анализа основаны на эффектах, вызванных разнообразными энергетическими переходами в результате взаимодействия молекул с излучением. Спектры молекул содержат более детальную информацию о веществе, в которой заложены данные не только об элементном составе вещества, но и характере соединения атомов между собой в молекуле. Преимущество молекулярной спектроскопии перед атомной в том, что в процессе получения спектров вещество не разрушается.
В зависимости от природы переходов различают следующие традиционные методы молекулярной спектроскопии:
молекулярная абсорбционная спектроскопия в видимой и УФобластях;
люминесцентный анализ;
инфракрасная спектроскопия;
спектроскопия комбинационного рассеяния (рамановская спектроскопия);
радиоспектроскопические методы анализа.
3.2.1. Взаимодействие электромагнитного излучения с веществом
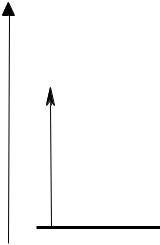
Квантованность внутренней энергии атомов и молекул является фундаментальным свойством материи. Молекулы поглощают энергию светового потока дискретно, извлекая каждый раз целую порцию или квант энергии (рис. 3.14).
При этом поглощается только такой квант энергии, который может скачкообразно перевести молекулу из основного энергетического
состояния в возбужденное состояние, например: |
|
E1* – Eo = E = h ν |
(8) |
28 |
|
E |
|
E2* |
|
||
|
|
|
|
|
E1* |
|
|
|
|
E = h |
|
Eo
Рис. 3.14. Поглощение энергии молекулами
Возбужденным состояниям молекул соответствуют уровни большей энергии E1*, E2*, ... En*. В отличие от основного состояния, в возбужденном состоянии молекула может находиться ограниченное время
–10-11 – 10-6 с, после чего происходит дезактивация системы.
Влюбом энергетическом состоянии полная энергия молекулы складывается из вращательной энергии Евр, колебательной энергии Екол и электронной энергии Еэл, причем их вклады различаются очень значительно:
Е = Евр + Екол + Еэл ν |
(9) |
Спектроскопический эксперимент позволяет количественно оценить величины энергетических интервалов E между соответствующими основным и возбужденными состояниями. Это дает возможность расположить вращательные, колебательные и электронные уровни на энергетической шкале вполне определенным образом.
Вращательная энергия связана с вращением отдельных атомов и групп вокруг простых связей. Изменение вращательных состояний ( Евр) требует 2 – 4 кДж/моль, что соответствует энергии электромагнитного излучения с длинами волн 60000 – 30000 нм.
Колебательная энергия связана с колебательными движениями атомов вдоль межъядерных осей и деформацией валентных связей относительно их нормального положения. Изменение колебательных состояний ( Eкол) требует 6 – 40 кДж/моль, что соответствует энергии
29
электромагнитного излучения с длинами волн 20000 – 3000 нм. Соответствующее излучение относится к ИК-области спектра.
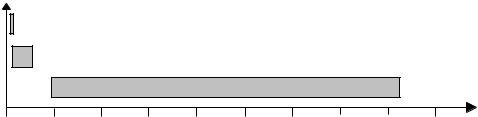
Электронная энергия – результирующая энергия ковалентных и ионных связей между атомами, а также энергия несвязывающих электронов этих атомов. Изменение электронной энергии ( Eэл) молекул связано с переносом электронов на уровни большей энергии, вплоть до их отрыва, ионизации. Для изменения электронной конфигурации молекул требуется гораздо большая энергия, которая варьирует в интервале 100 – 800 кДж/моль, что соответствует поглощению электромагнитных излучений с длинами волн 1200 – 100 нм (рис. 3.15).
Вращательная энергия
Колебательная энергия
Электронная энергия
E кДж/моль
0 |
100 |
200 |
300 |
400 |
500 |
600 |
700 |
800 |
900 |
Рис. 3.15. Диапазоны изменения вращательной, колебательной и электронной энергии молекул
Столь значительное отличие в разностях энергии ( Eэл) между электронными уровнями молекул вызвано тем, что электроны могут
-занимать в атомах слои с различными квантовыми числами;
-принадлежать атомам с различной электроотрицательностью;
-осуществлять различные виды химических связей. Экспериментально найденные диапазоны изменения вращательной,
колебательной и электронной энергии позволяют сделать важные для дальнейших обсуждений выводы:
1.Вклады колебательной и особенно вращательной энергии в общую энергию молекул невелики. Поэтому при рассмотрении энергетики электронных состояний во многих случаях ими можно пренебречь.
2.Колебательные уровни, соответствующие данному электронному состоянию, располагаются друг относительно друга гораздо ближе, чем следующий электронный уровень, т. е. каждому электронному
30
