
спектроскопические методы анализа
.pdf
Рис. 2.1. Шкала ЭМИ, используемого в анализе
В зависимости от энергии, ЭМИ вызывает различные физические процессы в веществе. В табл. 2.1 приведена классификация спектральных методов анализа и информация об энергии ЭМИ и типах вызываемых им энергетических переходов.
|
|
Таблица 2.1 |
|
Классификация спектральных методов анализа |
|||
|
|
|
|
Область ЭМИ/название |
Длина волны, λ, м |
Процесс |
|
метода |
|||
|
|
||
Радиочастотная |
101 – 10 1 |
Изменение спинов ядер |
|
(ЯМР, ЭПР) |
|
и электронов |
|
Микроволновая |
10 1 – 10 3 |
Изменение |
|
|
|
вращательных |
|
|
|
состояний электронов |
|
Оптическая |
10 6 – 10 8 |
Изменение состояний |
|
УФ |
|
валентных электронов |
|
Видимая |
|
|
|
Рентгеновская |
10 8 – 10 10 |
Изменение состояний |
|
|
|
внутренних электронов |
|
Гамма-излучение |
10 10 – 10 13 |
Ядерные реакции |
|
(ядерно-физические |
|
|
|
методы) |
|
|
|
11
Далее в учебном пособии рассмотрены спектральные методы, наиболее востребованные при анализе органических веществ.
3. СПЕКТРОСКОПИЯ ВИДИМОГО И УЛЬТРАФИОЛЕТОВОГО ДИАПАЗОНОВ (ОПТИЧЕСКАЯ)
Спектральная область ЭМИ, называемая оптической (ультрафиолетовое и видимое излучение 190 – 900 нм), является одной из часто используемых, особенно, для анализа органических веществ. Атомы и молекулы вещества, подвергаемые воздействию ЭМИ, энергия которого соответствует этой области, претерпевают изменения, вызванные переходами валентных электронов внешних валентных оболочек.
Свет – в физической оптике электромагнитное излучение, воспринимаемое человеческим глазом. В качестве коротковолновой границы спектрального диапазона, занимаемого светом, принят участок с длинами волн в вакууме 380 – 400 нм (750 – 790 ТГц), а в качестве длинноволновой границы – участок 760 – 780 нм (385 – 395 ТГц). Также данный диапазон называется видимым светом – это узкая область в спектре электромагнитных излучений, которую различает человеческий глаз.
В широком смысле, светом часто называют любое оптическое излучение, т. е. такое электромагнитное излучение, длины волн которого лежат в диапазоне с приблизительными границами от единиц нанометров до десятых долей миллиметра. В этом случае в понятие «свет» помимо видимого излучения включаются как инфракрасное, так и ультрафиолетовое излучения. Электромагнитное излучение характеризуется:
–длиной волны λ, имеющей размерность нм, 10–9 м;
–частотой ν, имеющей размерность с–1 , Гц;
–волновым числом ν̅, имеющим размерность с 1, которое показывает, сколько длин волн длиной λ укладывается в 1 см вектора пространства.
12

Эти величины связаны между собой и со скоростью распространения света в вакууме со (3 108 м/с) следующим образом:
̅
Для того чтобы перевести длину волны, например 760 нм, в волновое число, необходимо совершить следующие операции:
̅
Свет может рассматриваться либо как электромагнитная волна, скорость распространения которой в вакууме постоянна, либо как поток фотонов – частиц, обладающих определенной энергией, импульсом, собственным моментом импульса и нулевой массой (или, как говорили ранее, нулевой массой покоя). Представление о двойственной природе электромагнитного излучения и элементарных частиц (корпускулярноволновой дуализм) стало одним из основополагающих положений квантовой механики. И с начала ХХ-го века электромагнитное излучение принято рассматривать как поток элементарных частиц – фотонов, которые не имеют массы покоя, но обладают импульсом энергии. Иными словами, световые лучи представляют собой поток фотонов, несущих отдельные порции (кванты) электромагнитной энергии.
Величина энергии фотонов Е (кДж) выражается уравнением Планка –
Эйнштейна |
|
E = h ν, |
(3) |
где h – постоянная Планка, равная 6,62∙10–37 кДж с. |
|
Человеческий глаз воспринимает световые лучи с |
энергией |
2,5–5 10–22 кДж и длинами волн в интервале 400–760 нм (рис. 3.1). |
|
|
УФ-лучи |
|
Видимый свет |
|
ИК-лучи |
|
нм |
|
|
|
|
|
|
|
|
|
|
200 |
400 |
760 |
1100 |
|||||
|
|
|
Рис. 3.1. Шкала ЭМИ УФ-, видимой и ИК-области |
|
|
|||
13

Специфические свойства лучей этой области спектра обусловлены их способностью, действуя на сетчатку глаза, передавать возбуждение по зрительному нерву в головной мозг, вызывая ощущения цвета, окраски.
УФ-лучи имеют длины волн менее 400 нм и при попадании на сетчатку глаза вызывают болевую реакцию и ожог. ИК-лучи имеют длину волны более 760 нм и воспринимаются глазом как тепло. Чем больше длина волны, тем меньше энергия излучения. Энергия излучения падает в ряду: УФ > Видимая > ИК область.
Одновременное действие всех лучей с длинами волн 400 – 760 нм вызывает у человека ощущение белого, неокрашенного света.
Излучение с определенной длиной волны или частотой электромагнитных колебаний называется монохроматическим излучением или монохроматическим светом.
Раздельное действие монохроматических излучений или потока лучей с довольно узким диапазоном длин волн (2 – 5 нм) производит ощущение окрашенного света. При этом воспринимаемый цвет зависит от длины волны монохроматического излучения и называется спектральным цветом. В табл. 3.1 представлены интервалы длин волн и вызываемые ими цветовые ощущения, спектральные и дополнительные цвета.
|
|
|
Таблица 3.1 |
|
Диапазоны длин волн и цвета видимого излучения |
||
|
|
|
|
|
Спектральный цвет |
Интервал |
Дополнительный цвет |
|
(цвет монохроматического |
излучения в |
(цвет окрашенного тела) |
|
луча) |
нм |
|
1 |
Фиолетовый |
400–435 |
Зеленовато-желтый |
2 |
Синий |
435–480 |
Желтый |
3 |
Голубой |
480–490 |
Оранжевый |
4 |
Зеленовато-голубой |
490–500 |
Красный |
5 |
Зеленый |
500–560 |
Пурпурный |
6 |
Желтовато-зеленый |
560–580 |
Фиолетовый |
7 |
Желтый |
580–595 |
Синий |
8 |
Оранжевый |
595–605 |
Голубой |
9 |
Красный |
605–730 |
Зеленовато-голубой |
10 |
Пурпурный |
730–760 |
Зеленый |
14

Спектрофотометрический эксперимент основан на законе Бугера – Ламберта – Бера (рис. 3.2), который гласит: ослабление интенсивности монохроматического света прямо пропорционально молярной концентрации поглощающего вещества и толщине поглощающего слоя.
Рис. 3.2. Схема выполнения спектрофотометрического эксперимента
В аналитической форме закон выражается:
log |
I0 |
= εcl = A, |
(4) |
|
I |
||||
|
|
|
где I0 и I – интенсивность светового луча до и после прохождения поглощающего слоя (интенсивность связана с амплитудой аналитической волны);
ε – молярный коэффициент поглощения или экстинкция, л/моль см; c – молярная концентрация вещества, моль/л;
l – толщина поглощающего слоя, см;
A (D) – поглощение (оптическая плотность) при данной длине волны. Молярный коэффициент поглощения – физическая константа
вещества, которая характеризует его взаимодействие с ЭМИ.
Степень ослабления светового потока измеряется с помощью спектрофотометров. Используя кварцевую призму или дифракционную решетку, световой поток разворачивают в спектр. Из него вырезают монохроматические лучи, поочередно пропускают через раствор исследуемого вещества и растворитель и регистрируют ослабление их интенсивности на каждой выбранной длине волны в выбранном диапазоне.
Результаты измерений представляются в графическом виде, отмечая
на оси абсцисс (x) значения фактора длины волны λ или волновое число  , на оси ординат (y) – значения фактора интенсивности поглощения: коэффициент поглощения ε, его логарифм lоgε или оптическую плотность А.
, на оси ординат (y) – значения фактора интенсивности поглощения: коэффициент поглощения ε, его логарифм lоgε или оптическую плотность А.
15

В простом спектре, содержащем одну полосу поглощения, положение максимума на оси x характеризует цвет вещества (рис. 3.3).
Рис. 3.3. Положение полос поглощения и цвет вещества
Например, если λмакс лежит в пределах 500–560 нм, то вещество поглощает спектральные зеленые лучи и, следовательно, имеет пурпурный дополнительный цвет.
Под влиянием химического и физического воздействия на вещество в его спектре могут происходить определенные изменения.
Смещение максимума поглощения λмакс в длинноволновую область (рис. 3.3, вправо) называют батохромным сдвигом. Сопровождающее этот сдвиг изменение окраски называют углублением цвета.
Смещение максимума поглощения λмакс в коротковолновую область (рис. 3.3, влево) называют гипсохромным сдвигом. Сопровождающее этот сдвиг изменение окраски называют повышением цвета.
Положение максимума поглощения на оси y, εмакс (рис. 3.3) характеризует интенсивность окраски вещества. Так, в спектрах практически ценных красителей εмакс, как правило, больше 10000.
Увеличение интенсивности полосы поглощения под влиянием внешних факторов называют гиперхромным эффектом, а уменьшение интенсивности – гипохромным эффектом.
Если параметры точки максимума характеризуют хроматический цвет вещества и его интенсивность, то оттенки цвета зависят от формы кривой поглощения.
16
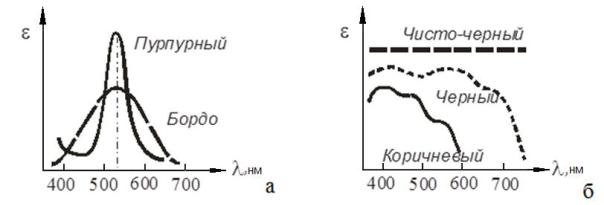
Чистый и яркий цвет имеют красители, в спектре которых присутствует узкая полоса поглощения с четким максимумом и круто падающими склонами (рис. 3.4, а).
Рис. 3.4. Полоса поглощения и цвет красителя
Чем более пологи склоны спектральной кривой, тем больше поглощенный свет отличается от монохроматического. Красители с широким максимумом поглощения приобретают менее чистый цвет из-за примеси серого цвета.
Если спектр поглощения содержит несколько перекрывающихся полос, кривая имеет перегибы, то интервал поглощения светового потока резко уширяется. Цвета таких красителей содержат примеси других цветов и становятся смешанными, нечистыми, приближаясь к ахроматическим цветам (рис. 3.4, а).
Смесь красного, оранжевого и желтого дает коричневый цвет.
Смесь красного, синего и голубого дает оттенки черного цвета (рис. 3.4, б). Заметим, идеальный черный цвет – ахроматичен и его спектральный состав характеризуется прямой, параллельной оси абсцисс
(x). Индивидуальные красители не могут иметь такой спектральной кривой, поэтому черный цвет воспроизводят с помощью, по крайней мере, двух красителей, чтобы добиться более равномерного поглощения света во всем видимом диапазоне. Поэтому черная окраска обычно воспринимается наблюдателем с определенным цветовым оттенком.
Особый интерес представляет случай, когда в спектре поглощения присутствуют две неперекрытые полосы поглощения, например, с
17
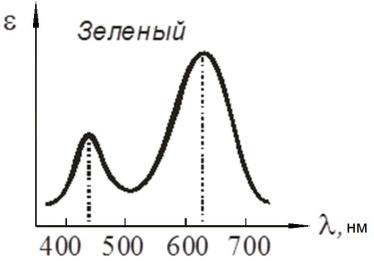
максимумами при 440 нм и 620 нм, такой краситель оказывается зеленым
(рис 3.5).
Рис. 3.5. Спектр поглощения красителя с двумя неперекрывающимися полосами поглощения
Это результат внутримолекулярного смешения желтого и голубого дополнительных цветов. Данный пример свидетельствует о неидентичности понятий «батохромный сдвиг» и «углубление цвета». Появление зеленой окраски не связано с длинноволновым смещением максимума поглощения, а является следствием присутствия полосы поглощения в коротковолновой области.
Вид регистрируемого спектра поглощения или излучения зависит от состояния вещества (атомное/молекулярное). На рис. 3.6 представлена элементарная схема, объясняющая различия в видах спектров (поглощения (А) или излучения (I)) атома и молекулы.
Линии в спектре атома обусловлены переходом валентных электронов (если энергия соотвествует УФ- и видимому диапазону) с одного внешнего уровня электронной оболочки атома на другой. Соответственно, спектр поглощения/излучения атома представляет собой набор линий и называется линейчатым.
18

Схема элементарного энергетичского перехода
Принципиальный вид спектра
Рис. 3.6. Схема энергетических переходов в атоме/молекуле и соответствующих спектров
Молекулы в отличие от атомов могут совершать колебательные и вращательные движения, энергетические уровни их расщеплены. Энергетические переходы между этими расщепленными подуровнями сливаются в полосы. Поэтому, спектры молекулы называются полосатыми (полосы поглощения/излучения). И атомные, и молекулярные спектры используют в анализе. Безусловно, аналитические возможности атомной и молекулярной оптической спектроскопии различны.
3.1. Методы оптической атомной спектроскопии
Название данной группы методов говорит о том, что вещество в этих методах присутствует в атомарном состоянии. Методы атомной спектроскопии используют результат взаимодействия ЭМИ оптического диапазона с атомами вещества. При этом регистрируются либо спектры поглощения атома (атомно-адсорбционная спектроскопия, ААС), либо спектры излучения атома (атомно-эмиссионная спектроскопия, АЭС).
19

Схема процессов, происходящих в элементарной энергетической ячейке атома, представлена на рис. 3.7.
Рис. 3.7. Схема элементарной энергетической диаграммы атома (внешняя электронная оболочка атома)
Следует отметить, что методы атомной спектроскопии относятся к наиболее чувствительным среди современных методов анализа. В анализе органических проб методы атомной спектроскопии применяются наиболее часто для анализа следовых количеств металлов, в том числе тяжелых металлов и в элементном анализе.
3.1.1. Метод атомной эмиссионной спектроскопии (АЭС)
Метод АЭС основан на термическом возбуждении свободных атомов и регистрации их оптического спектра испускания. Метод используется в качественном и количественном анализе. Качественный анализ проводят, идентифицируя линии в спектре атома элемента. Для анализа проб органической природы наибольшее применение получило использование метода АЭС для количественного анализа. В этом случае измеряют интенсивность наиболее яркой спектральной линии атома, которая зависит от концентрации этих атомов в образце (рис. 3.8).
20
