
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
1.5. Контрольные задачи
1. Найдите количество вещества азотной кислоты, если её масса составляет 100 г.
Ответ: 1,59 моль.
2. Найдите количество вещества азота, если его объем при нормальных условиях составляет 15 дм3.
Ответ: 0,67 моль.
3. Найдите число формульных единиц гидрокарбоната кальция, число атомов кальция, водорода, углерода и кислорода, содержащихся в 300 г Ca(HCO3)2.
Ответ:
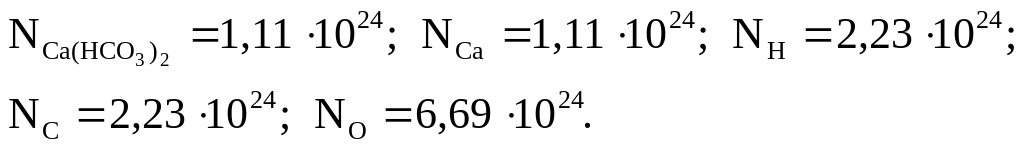
4. Найдите процентное содержание магния, азота и кислорода в нитрате магния Mg(NO3)2.
Ответ: ωMg=16,2; ωN=18,9;ωО=64,9 %.
5.Найдите массу одной молекулы хлора.
Ответ:1,18.10-22г.
6. Найдите массу гидроксида кальция, необходимую для реакции с 10 г хлороводорода, и массы хлорида кальция и воды, образующиеся в результате реакции
2HCl + Ca(OH)2 = CaCl2 + 2H2O.
Ответ:
![]()
7. Найдите массы оксида кальция, воды и объем углекислого газа, образующиеся при термическом разложении 200 г гидрокарбоната кальция по реакции
Сa(HCO3)2=CaO+H2O+2 CO2.
Ответ:![]()
8. Найдите массы карбоната натрия и хлорида кальция, необходимые для получения 10 г карбоната кальция по реакции
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Ответ:![]()
9. Найдите объём газообразного аммиака (н.у.) и массу серной кислоты, необходимые для получения 50 г сульфата аммония по реакции 2NH3 + H2SO4 =( NH4 )2SO4.
Ответ:![]()
1.6. Строение атома
Атом состоит из ядра и электронной оболочки. Ядро состоит из заряженных протонов и незаряженных нейтронов. Число протонов равно порядковому номеру элемента в ПСЭМ. Например, порядковый номер кальция в ПСЭМ равен 20, следовательно, ядро кальция содержит 20 протонов. Число нейтронов определяется как разность между атомной массой изотопа элемента и его порядковым номером. Например, порядковый номер углерода в ПСЭМ равен 6, следовательно, ядро изотопа углерода 12С содержит 12 – 6 = 6 нейтронов, а изотоп углерода 14С содержит 14 – 6 = 8 нейтронов. Атомные массы элементов, приведенные в ПСЭМ, представляют собой средние атомные массы природной смеси различных изотопов элементов, поэтому эти величины не всегда могут быть использованы для нахождения числа нейтронов в ядре атома.
Заряд протона принято считать положительным. Он численно равен заряду электрона, который принято считать отрицательным. Атомы элементов электронейтральны, следовательно, число электронов в атоме равно числу протонов в ядре и равно порядковому номеру элемента в ПСЭМ.
Электроны в атоме образуют электронные уровни и подуровни. Число электронных уровней атома равно номеру периода в ПСЭМ, в котором располагается элемент. Например, элемент калий находится в четвертом периоде, следовательно, его электроны располагаются на 4 электронных уровнях. Электронные уровни могут быть обозначены целыми положительными числами от 1 до 7, что соответствует числу периодов в ПСЭМ. Эти числа носят название главного квантового числа, которое обозначается буквой n. В пределах электронного уровня электроны располагаются на электронных подуровнях. Максимально возможное число электронных подуровней на данном электронном уровне равно номеру уровня, однако в действительности число электронных уровней не превышает четырёх. Например, на 3-м электронном уровне может быть 3 электронных подуровня, а на 5-м и 6-м уровнях имеется только по 4 подуровня. Электронные подуровни обозначаются буквами латинского алфавита s, p, d, f и носят название орбитального или побочного квантового числа. На 1-м электронном уровне имеется только один электронный подуровень – s. Это записывается как 1s. На втором электронном уровне находятся 2 электронных подуровня s и p. Эти подуровни обозначаются как 2s и 2p. Соответственно на 3-м электронном уровне электроны располагаются на трёх подуровнях – 3s, 3p и 3d, а на 4-м – на четырёх подуровнях – 4s, 4p, 4d и 4f. Максимальное количество электронов на s-подуровне составляет 2, на p-подуровне – 6, на d-подуровне – 10, а на f-подуровне – 14. Количество электронов, находящихся на электронном подуровне, обозначается правым верхним индексом. Например, если на р-подуровне 2-го электронного уровня находятся 3 электрона, то это записывается как 2p3, а 7 электронов на d-подуровне 3-го электронного уровня обозначаются как 3d7.
Если на электронном уровне находятся несколько подуровней, то электроны в первую очередь заполняют s-подуровень, затем – p-подуровень, далее – d-подуровень и в последнюю очередь – f-подуровень. Распределение электронов по энергетическим уровням и подуровням называется электронной формулой элемента.
Пример 1.10. Записать электронную формулу атома элемента хлор.
Решение. Порядковый номер хлора в ПСЭМ равен 17, следовательно, ядро атома хлора содержит 17 протонов и нейтральный атом имеет 17 электронов. Хлор находится в 3-м периоде ПСЭМ, следовательно, электроны расположены на трех электронных уровнях. На 1-м уровне имеется только один электронный подуровень s, на котором могут находиться максимально 2 электрона (1s2). На 2-м уровне имеются 2 подуровня – s и p, на которых могут располагаться максимально 2 и 6 электронов, (соответственно (2s2 и 2p6)). На 3-м уровне могут быть 3 подуровня – s, p и d. Но на этом уровне у атома хлора находятся только 17-(2+2+6)=7 электронов. Два из них находятся на s- подуровне(3s2) и 5 – на p-подуровне (3p5). Таким образом, электронная формула хлора будет иметь вид 1s22s22p63s23p5.
Электронные формулы первых 20 элементов ПСЭМ приведены в табл. 1.3.
Отметим, что изложенное применимо в полной мере только к элементам первых трёх периодов ПСЭМ.
