
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
1.4. Химические уравнения
Химические уравнения показывают вещества, вступающие в химическую реакцию, и образующиеся в результате продукты, а также количественные отношения между всеми участниками реакции. Например, уравнение
2HCl + Ca(OH)2 = CaCl2 + 2H2O
означает, что в реакцию вступают 2 моль соляной кислоты и 1 моль гидроксида кальция; образуются 1 моль хлорида кальция и 2 моль воды, а массы исходных веществ и продуктов реакции удовлетворяют соотношению
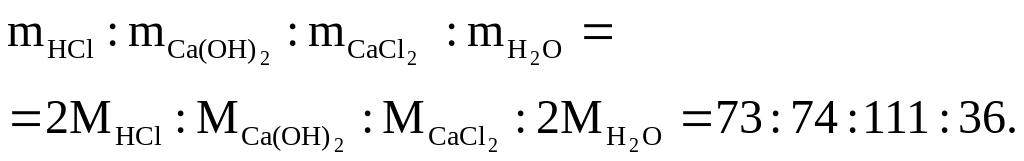
Пример 1.8. Серная кислота (H2SO4) реагирует с гидроксидом калия по уравнению
H2SO4 + 2KOH = K2SO4 + 2H2O.
Найти массу гидроксида калия, необходимую для реакции с 20 г серной кислоты, и массы сульфата калия и воды, образующиеся в результате реакции.
Решение. Молярные массы участников реакции составляют соответственно 98 (H2SO4); 56 (KOH); 176 (K2SO4) и 8 (H2O) г/моль. Из уравнения реакции следует, что 1 моль серной кислоты реагирует с 2 моль гидроксида калия или 98 г H2SO4 взаимодействуют с 2•56=112 г KOH. Составим пропорцию:
98 Г h2so4 реагируют со 112 г кон,
20 г - “ - - “ - х г - “ - ,
![]()
Аналогично в соответствии с уравнением реакции запишем:
из 98 г H2SO4 образуется 176 г K2SO4 ,
из 20 г - “ - - “ - х г - “ - ,
![]() ;
;
из 98 г H2SO4 образуется 36 г Н2O,
из 20 г - “ - - “ - х г - “ – ,
![]()
Пример 1.9. При взаимодействии серной кислоты и карбоната натрия выделилось 5,0 л углекислого газа (н.у.). Найти массы серной кислоты и карбоната натрия, взятые для реакции, а также массу сульфата натрия и воды, образовавшихся в результате реакции.
Решение. Запишем уравнение реакции:
H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O.
Из уравнения реакции следует, что в реакцию вступают 1 моль серной кислоты и 1 моль карбоната натрия и образуются по 1 моль сульфата натрия, углекислого газа и воды. Иначе говоря, в реакцию вступают 98 г H2SO4 и 106 г Na2CO3, а образуются 142 г Na2SO4, 44 г CO2 и 18 г H2O. 1 моль углекислого газа, или 44 г, занимает при нормальных условиях объем, равный 22, 4 дм3 (л).
Молярные массы участников реакции составят:
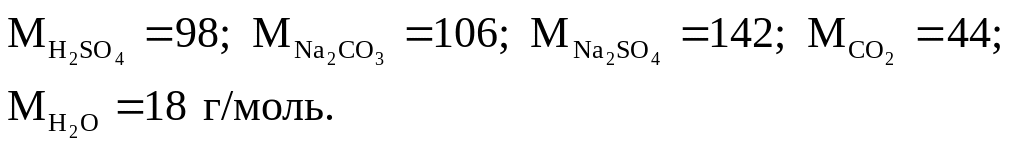
Из уравнения реакции следует:
для получения 22,4 л CO2 необходимо взять 98 г H2SO4,
- “ - - “ - 5 л - “ - - “ - х г - “ - ,
![]()
Количество углекислого газа можно выразить в граммах:
масса 22,4 л CO2 составляет 44 г,
- “ - 5 л - “ - - “ - х г,
![]() ,
,
и при последующих вычислениях использовать массу газа, а не объём.
Основываясь на уравнении реакции, найдём массы Na2CO3, Na2SO4 и H2O.
Для получения 44 г CO2 необходимо взять 106 г Na2CO3,
- “ - - “ - 9,82 г - “ - - “ - х г - “ – ,
![]() ;
;
при получении 44 г CO2 образуется 142 г Na2SO4,
- “ - - “ - 9,82 г - “ - - “ - х г - “ – ,
![]() ;
;
при получении 44 г CO2 образуется 18 г H2O,
- “ - - “ - 9,82 г - “ - - “ - х г - “ –,
![]() .
.
