
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
4.4. Лабораторная работа №2
Кинетика химических реакций
Цель работы: изучение скорости химической реакции и её зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
Теоретическое введение
Привести понятия средней и истинной скоростей химической реакции; факторы, определяющие скорость химической реакции; закон действующих масс, закон Вант-Гоффа.
Экспериментальная часть
Опыт 1. Изучение влияния концентрации соли на скорость реакции тиосульфата натрия с серной кислотой.
Сильная серная кислота вытесняет слабую тиосерную кислоту из тиосульфата натрия:
Na2S2O3 +H2SO4= H2S2O3 + Na2SO4.
Тиосерная кислота в свободном состоянии неустойчива и распадается:
Н2S2O3 =SO2 + H2O + S.
Образование свободной серы наблюдается визуально по помутнению прозрачного раствора.
Суммарное уравнение реакции имеет следующий вид:
Na2S2O3 +H2SO4= Na2SO4+SO2 +H2O +S.
Промежуток времени от момента сливания растворов реагентов до момента начала помутнения раствора пропорционален скорости реакции.
Внесите 0,5М раствор тиосульфата натрия и дистиллированную воду в три пробирки и перемешайте:
в 1-ю пробирку внесите 4 капли раствора Na2S2O3 и 8 капель Н2О;
во 2-ю пробирку – 8 капель раствора Na2S2O3 и 4 капли Н2О;
в 3-ю пробирку – 12 капель раствора Na2S2O3.
Таким образом, в каждой пробирке должно находиться по 12 капель раствора тиосульфата натрия. Если относительную концентрацию соли (сотн) в 1-й пробирке принять равной 1 (4 капли раствора соли), то во 2-й пробирке концентрация составит 2 (8 капель) и в 3-й – 3 (12 капель).
В первую пробирку добавьте 1 каплю 1н раствора серной кислоты с концентрацией и встряхните содержимое. С помощью секундомера измерьте время от попадания капли кислоты в раствор соли до появления помутнения (τ,с). Проделайте поочерёдно то же самое со 2-й и 3-й пробирками.
Экспериментальные данные занесите в табл. 4.1. Рассчитайте относительную скорость реакции:
![]() .
.
Таблица 4.1. Экспериментальные данные
Номер пробирки |
Число капель реагентов |
сотн Na2S2O3 |
τ,с |
Относительная скорость реакции, v=1/,с-1 |
||
Na2S2O3 |
H2O |
H2SO4 |
||||
1 |
4 |
8 |
1 |
1 |
|
|
2 |
8 |
4 |
1 |
2 |
|
|
3 |
12 |
0 |
1 |
3 |
|
|
Постройте на
миллиметровой бумаге график зависимости![]() ,
отложив по оси абсцисс значение
относительных концентраций тиосульфата
натрия, а по оси ординат – значения
соответствующих относительных скоростей
реакции.
,
отложив по оси абсцисс значение
относительных концентраций тиосульфата
натрия, а по оси ординат – значения
соответствующих относительных скоростей
реакции.
Концентрация серной кислоты в опыте постоянна, следовательно, кинетическое уравнение будет иметь вид
![]() ,
,
а график будет прямой линией, выходящей из начала координат под углом к оси абсцисс (рис. 4.5.)
Рассчитайте относительную константу скорости реакции из полученного графика по формуле
![]() .
.

Рис. 4.5. Зависимость относительной скорости реакции от относительной концентрации тиосульфата натрия
Выводы. Отметьте зависимость скорости реакции от концентрации. Укажите возможные источники погрешности опыта.
Опыт 2. Изучение влияния температуры на скорость реакции тиосульфата натрия с серной кислотой.
В опыте 2 исследуется влияние температуры на скорость реакции, описанной в опыте 1.
Поместите в термостат 2 пробирки: одну – с 4 каплями 0,5М раствора Na2S2O3 и 8 каплями дистиллированной воды (перед погружением в термостат пробирку встряхните, чтобы перемешать раствор), другую – с 8 каплями 1М раствора H2SO4. Измерьте температуру (t1). Выдержите растворы при данной температуре, после чего, не вынимая пробирки из термостата, добавьте к раствору тиосульфата натрия 1 каплю раствора Н2SO4. Измерьте время от момента добавления кислоты до начала помутнения раствора.
Повторите опыт при температурах (t1+10 0С) и (t1 +20 0С), нагревая термостат с реактивами на электрической плитке. Результаты опытов занесите в табл. 4.2.
Таблица 4.2. Экспериментальные данные
Номер опыта |
t, oC |
Время реакции, τ, с |
Относительная скорость v=1/τ, c-1
|
Термичский коэффицент скорости γ |
1 |
t1 |
|
|
|
2 |
t1+100С |
|
|
|
3 |
t1+200С |
|
|
|
Рассчитайте температурные коэффициенты скорости реакции:
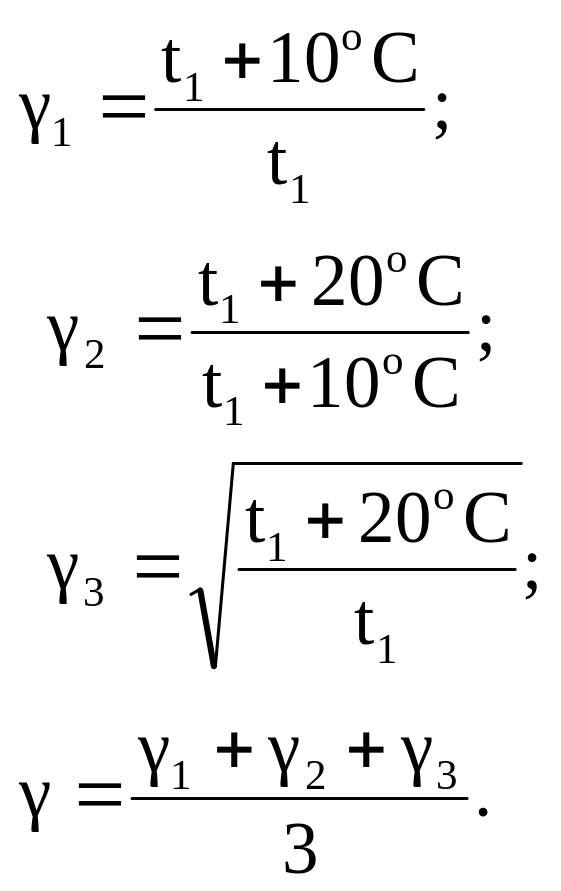
Постройте на миллиметровой бумаге график зависимости v=f(t), отложив по оси абсцисс температуру, а по оси ординат – относительную скорость реакции, имея в виду, что зависимость является степенной (рис. 4.6).

Рис. 4.6. Зависимость относительной скорости реакции от температуры
Выводы. Отметьте зависимость скорости реакции от температуры. Укажите возможные источники погрешности опыта.
Контрольные вопросы
1. Напишите математическое выражение закона действия масс для реакций:
α) N2O4(г)=2NO(г);
б) 2NO(г)+Br2(г)=2NOBr(г);
в) С(т)+О2(г)=СО2(г).
2. Что называется энергией активации реакции?
