
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
3.4. Задания для текущих и промежуточных контролей
Раздел I
1. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
I. 2C(гр)+О2(г) = 2СО(г); 2CO(г) + О2 = 2СО2(г), rН° = -566 кДж.
II. C(гр) + О2(г) = СО2(г), rН° = -393 кДж.
Найдите fH°(CO).
Ответ: -110 кДж/моль.
2. Рассчитайте энтальпию образования и энтальпию сгорания монооксида углерода (СО), исходя из приведенных ниже реакций:
2С(гр) + О2(г) = 2СО(г), rН° = -220 кДж.
II. 2СО(г) + О2(г) = 2СО2(г), rН° = -566 кДж.
Ответ: -110 кДж/моль; -283 кДж/моль.
3. Найдите стандартную энтальпию образования сульфита натрия из термохимического уравнения
4Na2SO3(кр)= 3Na2SO3(кр)+ Na2S(кр) – 181,1 кДж,
если
![]() кДж/моль
и
кДж/моль
и
![]() кДж/моль.
кДж/моль.
Ответ: -1090 кДж/моль.
4. Найдите стандартную энтальпию сгорания метана, исходя из реакции СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г), rН°= -802 кДж.
Ответ: -802 кДж/моль.
Предскажите, положительным или отрицательным будет
изменение энтропии системы в реакциях:
а) Н2О(ж) Н2О(г) (при температуре 25 С);
б) СаСО3(т) СаО(т) + СО2(г);
в) N2(г) + 3Н2(г) = 2NH3(г);
г) N2(г) + О2(г) = 2NO(г);
д) Ag+(р-р) + Cl-(р-р) = AgCl(т).
Дайте объяснения, не производя расчетов.
Ответ: а) +; б) +; в) -; г) ~0; д) -.
6. Предскажите знак S системы в каждом из следующих
процессов:
а) испарение 1 моль CCl4(ж);
б) Br2(г) → Br2(ж);
в) осаждение AgCl(т) при смешении NaCl(водн.) и AgNO3(водн.).
Дайте объяснения.
Ответ: а) +; б) -; в)-.
7. Пользуясь табличными значениями абсолютных значений энтропий веществ при стандартных условиях (S°), сравните значения абсолютных энтропий веществ при температуре 298 К в каждой из перечисленных ниже пар:
а) О2(г) и О3(г);
б) С(алмаз) и С(графит);
в) NaCl(т) и MgCl2(т).
Объясните причину различия S° в каждом случае.
Вычислите rS° для реакций
а) N2(г) + 3Н2(г) = 2NH3(г); б) 2SO2(г) + О2(г) = 2SO3(г),
используя табличные значения абсолютных энтропий веществ при стандартных условиях.
Ответ: а) -197,74 Дж/К; б) -188,06 Дж/К.
Пользуясь табличными значениями абсолютных эн-
тропий (S°), вычислите rS° для следующих процессов:
а) СО(г) + 2Н2(г) = СН3ОН(г);
б) 2НСl(г) + Br2(ж) = 2HBr(г) + Cl2(г);
в) 2NO2(г) = N2O4(г).
Согласуется ли в каждом случае знак величины rS° с тем, который следует ожидать на основе качественных представлений? Ответы объясните.
Ответ: а) -218,83 Дж/К; б) 94,15 Дж/К; в) -175,77 Дж/К.
10.
Стандартная энтальпия образования
СО(г)
составляет -110,5 кДж/моль. При
сгорании 2 моль СО(г)
выделилось 566 кДж теплоты. Вычислите
![]()
Ответ: -393,5 кДж/моль.
Определите количество теплоты, выделяющееся при гашении 100 кг извести водой: CaO(к) + H2O(ж) = Ca(OH)2(к), если стандартные теплоты образования CaO(к), H2O(ж), Ca(OH)2(к) равны соответственно -635,14; -285,84; -986,2 кДж/моль.
Ответ: -1165357,2 кДж.
Определите энтальпию разложения пероксида водорода (Н2О2) на воду и кислород, используя нижеприведенные данные:
SnCl2(р) + 2НCl(p) + H2O2(p) = SnCl4(p) + 2H2O(ж), rН°=-393,3 кДж;
SnCl2(р) + 2HCl(p) + 1/2O2(г) = SnCl4(p) + H2O(ж), rН°=-296,6 кДж.
Ответ: - 96,7 кДж.
Вычислите количество теплоты, которое выделяется при производстве 106 кг аммиака в сутки, если
N2(г) + 3Н2(г) = 2NH3(г), rН° = -92 кДж.
Ответ: -2,7.109 кДж.
Определите
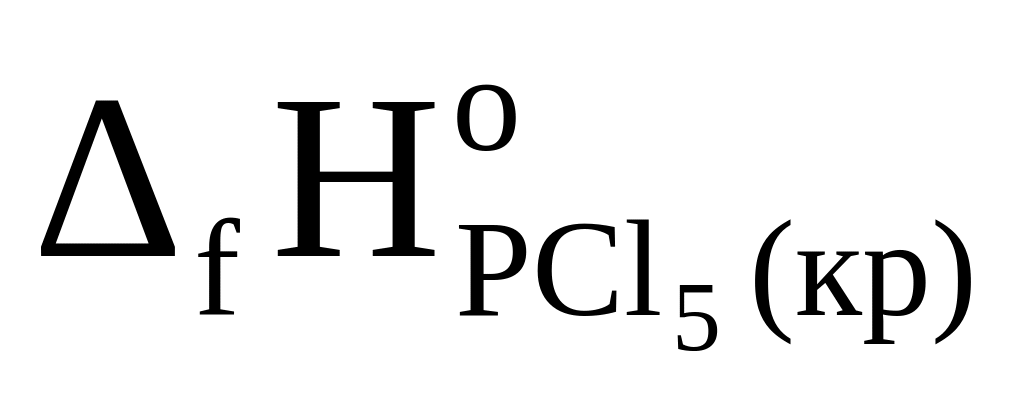 ,
исходя из следующих данных:
,
исходя из следующих данных:
Р4(кр) + 6Cl2(г) = 4РСl3(ж), rН° = -1272,0 кДж;
PCl3(ж) + Cl2(г) = PCl5(кр), rН° = -137,2 кДж.
Ответ: -455,2 кДж/моль.
15. Вычислите изменение энтальпии реакции при стандартных условиях: Н2(г) + 1/3О3(г) = Н2О(г), исходя из следующих данных:
2О3(г)=3О2(г), rН°=-288,9 кДж,
![]() кДж/моль.
кДж/моль.
Ответ: -289,95 кДж.
16. Рассчитайте стандартную энтальпию реакции образования PbO, используя следующие данные:
1) 2Pb(кр)+О2(г)=2PbO2(кр) – 553,2 кДж;
2) 2PbO2(кр)= 2PbO(кр) )+О2(г) + 117,48 кДж.
Ответ: -217,86 кДж/моль.
17. Рассчитайте стандартную энтальпию реакции образования CuCl, используя следующие данные:
1) CuCl2(кр)+Cu(кр)=2 CuCl(кр) – 63,5 кДж;
2) Cu(кр)+ Cl2(г)= CuCl2(кр) – 205,9 кДж.
Ответ: 134,7 кДж/моль.
Вычислите ΔfH° метилового спирта в жидком состоянии, зная следующие данные:
Н2(г) + 1/2О2(г) = Н2О(ж), rН° = -285,8 кДж;
С(гр) + О2(г) = СО2(г), rН° = -393,7 кДж;
СН3ОН(ж) + 3/2О2(г) = СО2(г) + 2Н2О(ж), rН° = -715,0 кДж.
Ответ: -250,3 кДж/моль.
19. Стандартные энтальпии сгорания бензола и ацетилена равны соответственно -3270 и -1302 кДж/моль. Определите rH° превращения ацетилена в бензол: 3С2Н2(г) = С6Н6(г).
Ответ: -636 кДж.
Определите стандартную энтальпию образования оксида железа (III), если при окислении 20 г железа выделилось 146,8 кДж теплоты.
Ответ: -822 кДж/моль.
Вычислите количество теплоты, которое выделяется при получении 22,4 л аммиака (н.у.), если
N2(г) + 3Н2(г) = 2NH3(г), rН° = -92 кДж.
Ответ: -46 кДж.
Определите ΔfH° этилена, используя следующие дан
ные:
С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г)-1323 кДж;
С(гр)+ О2(г) = СО2(г)-393,7 кДж;
Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: 52 кДж/моль.
23.Рассчитайте энтальпию реакции F(г)+Li(г)=F-(г)+ Li+(г),
если F(г) + е = F-(г) -322 кДж/моль;
Li(г) = Li+(г) + е +520 кДж/моль.
Ответ: 198 кДж.
24. Рассчитайте стандартную энтальпию реакции образования Hg2Br2, используя следующие данные:
1) HgBr2(кр)+ Hg(ж)= Hg2Br2 (кр) – 37,32 кДж;
2) HgBr2 (кр)= Hg (ж)+ Br2(ж) +169,45 кДж.
Ответ: -206,77 кДж/моль.
25. Рассчитайте стандартную энтальпию реакции образования гидрокарбоната натрия, используя следующие данные:
2NaНСO3(кр)= Na2СO3(кр)+ СО2(г) +Н2О(г) + 130,3 кДж,
если
![]() кДж/моль;
кДж/моль;
С(гр)+О2(г)=СО2(г)– 393,7 кДж; Н2(г)+1/2О2(г)=Н2О(г)-241,8 кДж.
Ответ: -947,4 кДж/моль.
26. Рассчитайте стандартную энтальпию реакции образования СaСO3(кр) , используя следующие данные:
Ca(OH)2(к)+ СО2(г)= СaСO3(кр)+173,9 кДж;
С(гр)+О2(г)=СО2(г) – 393,7 кДж;
![]() кДж/моль.
кДж/моль.
Ответ: -1206 кДж/моль.
Определите стандартную энтальпию образования оксида железа (III), если при реакции
2Fe + Al2O3 = Fe2O3 + 2Al
на
каждые 80 г Fe2O3
поглощается 426,5 кДж теплоты,
![]() кДж/моль.
кДж/моль.
Ответ: -823 кДж/моль.
Какое количество теплоты необходимо затратить для получения 11,2 кг железа, если в соответствии с термохимическим уравнением FeO(т) + Н2(г) = Fe(т) + Н2О(г)+ 23 кДж.
Ответ: 4600 кДж.
Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита составляет -393,51 кДж/моль, а тепло-
та фазового перехода С(графит) С(алмаз) составляет
1,88 кДж/моль.
Ответ: -395,39 кДж/моль.
Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный фосфор, если известно,
что стандартные энтальпии образования красного и чёрного фосфора составляют -18,41 и -43,20 кДж/моль соответственно.
Ответ: -800 кДж.
