
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
2.3. Лабораторная работа №1
Определение молярной массы эквивалентов металла методом вытеснения водорода
Цель работы: ознакомление с методикой определения молярной массы эквивалентов металла.
Теоретическое введение
Привести закон эквивалентов, понятия эквивалента, числа эквивалентности, фактора эквивалентности, количества вещества эквивалентов, молярной массы эквивалентов, молярного объёма эквивалентов, формулы для определения молярной массы эквивалентов простого вещества, бинарных соединений, кислот, оснований и солей. Привести примеры.
Экспериментальная часть
 Метод основан
на измерении объёма водорода, который
выделяется из кислоты при действии на
неё металла. Объём водорода и масса
металла пропорциональны их молярным
массам эквивалентов.
Метод основан
на измерении объёма водорода, который
выделяется из кислоты при действии на
неё металла. Объём водорода и масса
металла пропорциональны их молярным
массам эквивалентов.
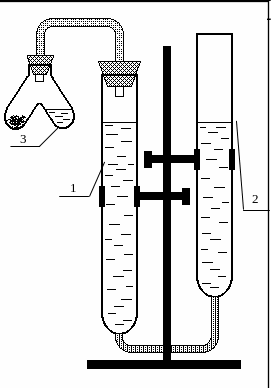
Применяемый для этой цели прибор – эвдиометр состоит из двух бюреток 1 (измерительная) и 2 (расширительная), заполненных частично водой. Бюретки укреплены на штативе, соединены резиновой трубкой и образуют два сообщающихся сосуда. Бюретка 1 закрыта пробкой с газоотводной трубкой, к которой присоединяется V-образная пробирка 3 (пробирка Оствальда).
Рис.2.1. Эвдиометр
Вначале необходимо определить цену деления измерительной бюретки. Цифры на бюретке обозначают объём в кубических сантиметрах. Показания бюретки снимаются по нижнему мениску жидкости, причем уровень жидкости и глаз наблюдателя должны быть на одной горизонтали.
Перед началом эксперимента необходимо проверить прибор на герметичность. Для этого присоедините пробирку Оствальда к измерительной бюретке и создайте разряжение, опуская расширительную бюретку на 10–20 см относительно измерительной бюретки. Если прибор герметичен, то уровень жидкости в измерительной бюретке немного опустится за счёт разряжения, а затем останется без изменений. В ином случае жидкость в бюретках 1 и 2 установится на одном уровне. Продолжать опыт на таком приборе нельзя; следует обратиться к преподавателю или инженеру.
Не присоединяя пробирку Оствальда, перемещайте расширительную бюретку и установите уровень жидкости в измерительной бюретке на нулевое деление или немного ниже.
Поместите в одно колено пробирки Оствальда навеску металла (занесите массу металла в табл. 2.1), а в другое колено налейте соляной кислоты от трети до половины объёма. Присоедините пробирку Оствальда к бюретке 1. Вновь проверьте прибор на герметичность. Приведите давление в измерительной бюретке к атмосферному. Для этого установите жидкость в бюретках на одном уровне, но не выше нулевого деления измерительной бюретки. Измерьте исходный объём газа в бюретке 1 (V1). Осторожно наклоняя пробирку Оствальда, прилейте кислоту к металлу. Произойдёт реакция с выделением водорода. По окончании реакции вновь приведите давление в измерительной бюретке к атмосферному, устанавливая жидкость в бюретках на одном уровне. Измерьте конечный объём газа в бюретке 1 (V2). Занесите объёмы V1 и V2 в табл. 2.1.
Использованную пробирку поместите в мойку. Эвдиометр приведите в исходное состояние.
Измерьте температуру в лаборатории и атмосферное давление. Результаты занесите в табл. 2.1.
Вычисления
1. Определите объем выделившегося водорода по формуле
![]() .
.
2. Определите парциальное давление водорода по
формуле
![]() ,
,
где
р – атмосферное давление;
![]() –
парциальное давление паров воды при
температуре опыта (см. прил. 2).
–
парциальное давление паров воды при
температуре опыта (см. прил. 2).
3. Найдите массу выделившегося водорода по уравнению Менделеева – Клапейрона:
→
![]() .
.
(Все величины для расчёта перевести в одну систему единиц!)
4. Найдите экспериментальную молярную массу эквивалента металла по уравнению закона эквивалентов
![]() .
.
5. Найдите значение экспериментальной молярной массы металла по формуле
![]() .
.
6. Используя периодическую таблицу, определите зна-
чение истинной молярной массы металла и вычислите значение истинной молярной массы эквивалентов металла:
![]()
7. Вычислите относительную ошибку опыта по формуле
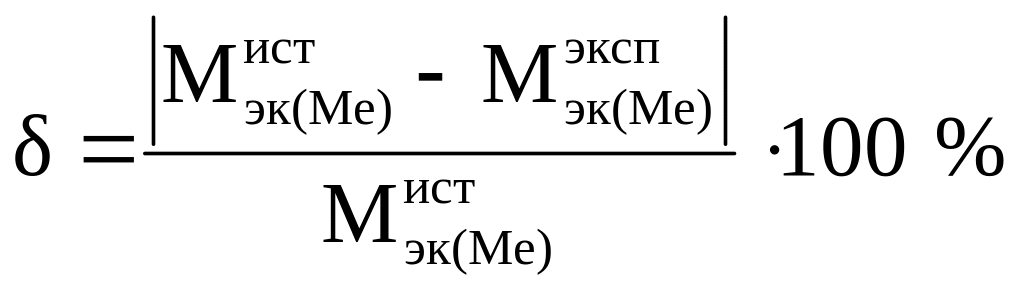 .
.
8. Все экспериментальные и расчётные результаты сведите в табл.2.1..
Таблица 2.1. Экспериментальные и расчётные результаты
№ |
Название величины |
Обозначение |
Единицы измерения |
Численное значение |
Единицы измерния в СИ |
Числен-ное зна- чение в СИ |
1 |
Масса металла |
m |
г |
|
кг |
|
2 |
Исходный объём |
V1 |
мл |
|
м3 |
|
3 |
Конечный объём |
V2 |
мл |
|
м3 |
|
4 |
Объём водорода |
|
мл |
|
м3 |
|
5 |
Температура |
t |
оС |
|
К |
|
6 |
Давление |
p |
мм Hg |
|
Па |
|
7 |
Парциальное давление пара воды |
|
мм Hg |
|
Па |
|
8 |
Парциальное давление водорода |
|
мм Hg |
|
Па |
|
9 |
Масса водорода |
|
г |
|
кг |
|
10 |
Экспериментальная молярная масса эквивалентов металла |
|
г/моль |
|
кг/моль |
|
11 |
Истинная молярная масса эквивалентов металла |
|
г/моль |
|
кг/моль |
|
12 |
Относительная ошибка опыта |
δ |
% |
|
% |
|
Выводы. Укажите возможные источники ошибки опыта.
Контрольные вопросы
Определите объём выделившегося водорода при
нормальных условиях по формуле объединённого газового закона
![]() ,
,
где верхний индекс (о) обозначает величину, соответствующую нормальным условиям.
2. Вычислите значение экспериментальной молярной массы эквивалентов металла, используя уравнение закона эквивалентов и молярный объём эквивалентов водорода. Сравните полученное значение молярной массы эквивалентов металла и ранее найденное.
