
- •А.И.Пирогов Общая химия Комплексное учебное пособие
- •Часть 1
- •Предисловие
- •Глава 1. Основные понятия химии
- •1.1. Атом, молекула. Элемент, простое вещество, соединение
- •1.2. Моль. Молярная масса. Закон Авогадро
- •1 Моль газа занимает объем 22,4 л,
- •1 Моль кислоты содержит 6,02.1023 формульных единиц h2so4,
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •98 Г h2so4 реагируют со 112 г кон,
- •1.5. Контрольные задачи
- •1.6. Строение атома
- •1.7. Периодическая система
- •1.8. Контрольные вопросы и задачи
- •1.9. Основные классы неорганических веществ
- •1.10. Электролитическая диссоциация гидроксидов и солей
- •1.11. Контрольные вопросы
- •1.12. Окислительно-восстановительные процессы
- •1.13. Контрольные задания
- •1.14. Способы выражения концентраций растворов
- •100 Г раствора содержат 5 г CuSo4,
- •160 Г CuSo4 содержатся в 250 г CuSo4.5н2о,
- •100 Г 98% раствора содержат 98 г н2so4,
- •1.15. Контрольные задачи
- •Глава 2. Основные законы химии
- •67,15 Г металла эквивалентны 32,85 г серы,
- •22, 25 Г н4р2о7 реагируют с 10 г NaOh,
- •2.1. Вопросы и задачи для самостоятельной подготовки
- •Раздел I
- •Раздел II
- •Раздел III
- •2.3. Лабораторная работа №1
- •Теоретическое введение
- •Экспериментальная часть
- •Глава 3. Энергетика химических процессов
- •3.1. Первый закон термодинамики и закон Гесса
- •3.2. Энтропия. Энергия Гиббса
- •3.3. Вопросы и задачи для самостоятельной подготовки
- •3.4. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Глава 4. Химическая кинетика
- •4.1. Скорость химических реакций
- •4.2. Вопросы и задачи для самостоятельной подготовки
- •4.3. Задания для текущих и промежуточных контролей
- •4.4. Лабораторная работа №2
- •Теоретическое введение
- •Экспериментальная часть
- •4.5. Химическое равновесие
- •4.6. Вопросы и задачи для самостоятельной подготовки
- •4.7. Задания для текущих и промежуточных контролей
- •Раздел I
- •Раздел II
- •Лабораторная работа №3
- •Теоретическое введение
- •Экспериментальная часть
- •Результаты опыта занесите в табл. 4.4.
- •5. Строение атома и периодическая система
- •5.1. Квантово-механическая модель строения атома
- •5.2. Вопросы для самостоятельной подготовки
- •5.3. Задания для текущих и промежуточных контролей
- •5.4. Периодическая система элементов д.И. Менделеева
- •5.5. Вопросы для самостоятельной подготовки
- •5.6. Задания для текущих и промежуточных контролей
- •Глава 6. Химическая связь
- •6.1. Ковалентная связь. Метод валентных связей
- •6.2. Метод молекулярных орбиталей
- •6.3. Металлическая связь
- •6.4. Межмолекулярная связь
- •6.5. Вопросы для самостоятельной подготовки
- •6.6. Задания для текущих и промежуточных контролей
- •Приложения
- •Требования безопасности в аварийных ситуациях
- •Пирогов Александр Иванович Общая химия Комплексное учебное пособие
- •Часть 1
- •153003, Г. Иваново, ул. Дзержинского, 39
67,15 Г металла эквивалентны 32,85 г серы,
Мэк(Ме) эквивалентна Мэк(S)=16 г/моль серы.
Откуда
![]() г/моль.
г/моль.
Пример 2.6. На восстановление 1 г оксида металла израсходован 421 см3 водорода (н.у.). Вычислить молярные массы эквивалентов оксида и металла.
Решение. Число эквивалентности молекулярного водорода Н2 равно двум, следовательно, молярная масса эквивалентов водорода
 г/моль.
г/моль.
В соответствии с законом Авогадро объем 1 моль водорода при н.у. составляет 22,4 л, следовательно, молярный объем эквивалентов водорода при н.у.
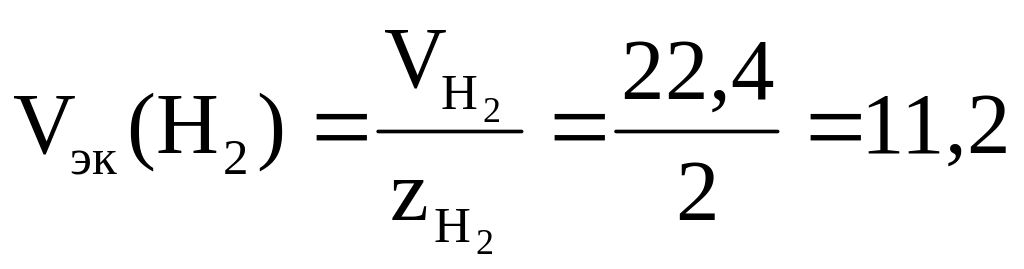 л/моль = 11200 см3/моль.
л/моль = 11200 см3/моль.
В соответствии с законом эквивалентов масса оксида и объем водорода, вступившие в реакцию, пропорциональны молярным массам (молярным объемам) их эквивалентов. Значит,
1 г оксида эквивалентен 421 см3 водорода,
Мэк(оксид) эквивалентна 11200 см3/моль водорода.
Откуда
![]() г/моль.
г/моль.
Любой оксид состоит из кислорода и другого элемента, соединенных в эквивалентных количествах. Следовательно, молярная масса эквивалента оксида равна сумме молярных масс эквивалентов кислорода и металла, образующего оксид:
Мэк(оксид)=Мэк( металл) + Мэк(О).
Число эквивалентности кислорода zO=2, значит,
![]() г/моль.
г/моль.
Таким образом, молярная масса эквивалентов металла, образующего оксид, составляет
Мэк( металл)= Мэк(оксид) - Мэк(О)= 26,6 – 8 =18,6 г/моль.
Пример 2.7. В реакцию с 10,0 г едкого натра вступило 22,25 г пирофосфорной кислоты (Н4Р2О7). Найти молярную массу эквивалента, число эквивалентности и основность кислоты в этой реакции. Записать уравнение реакции.
Решение. В соответствии с законом эквивалентов массы гидроксида натрия и пирофосфорной кислоты, вступившие в реакцию, эквивалентны. Число эквивалентности гидроксида натрия постоянно и равно единице. Следовательно, молярная масса эквивалента гидроксида натрия равна его молярной массе:
![]()
На основании закона эквивалентов запишем:
22, 25 Г н4р2о7 реагируют с 10 г NaOh,
Mэк(Н4Р2О7) - “ - 40 г NaOH,
![]()
Находим число эквивалентности пирофосфорной кислоты в данной реакции:
![]()
Число эквивалентности кислоты в реакции нейтрализации соответствует числу ионов водорода, замещённых катионами металла, т.е. основности кислоты. Следовательно, основность пирофосфорной кислоты в данном случае равна двум и уравнение реакции имеет вид
Н4Р2О7 + 2 NaOH = Na2Н2Р2О7 + 2H2O.
Закон Авогадро. Открыт в 1811 г. итальянским физиком А. Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
При
нормальных условиях (температура 0
оС=273,15
К и давление 1 атм =760 мм рт.ст.= 101325
Па=101,325 кПа) один моль любого газа содержит
6,022045•1023
![]() 6,02•1023
молекул (постоянная Авогадро) и занимает
объем 22 414 см3
22,4
дм3 .
6,02•1023
молекул (постоянная Авогадро) и занимает
объем 22 414 см3
22,4
дм3 .
Закон Авогадро позволяет определить молярную массу газа, если известна его плотность (ρ) при нормальных условиях:
МВ=22,4 ρ, (2.8)
или плотность при нормальных условиях, если известна молярная масса. Можно также определить молярную массу неизвестного газа (Мх), зная молярную массу известного газа (МВ) и отношение плотностей этих газов (ρх/ρВ):
![]() (2.9)
(2.9)
Отношение ρх/ρВ носит название относительной плотности одного газа по другому и обозначается буквой D. Например, если использовать относительную плотность неизвестного газа по водороду и воздуху, то формула (2.8) запишется следующим образом:
![]() (2.9а)
(2.9а)
![]() (2.9б)
(2.9б)
Если условия, при которых находится газ, не сильно отличаются от нормальных, то для определения молярной массы газа используют уравнение состояния идеальных газов Менделеева – Клапейрона.
Пример 2.8. Какой объем занимает 1 г углекислого газа при н.у.?
Решение. Молярная масса углекислого газа СО2 составляет 44 г/моль. Из закона Авогадро следует, что при нормальных условиях
44 г углекислого газа занимают объем 22,4 л,
1 г углекислого газа занимает объем Vo л.
Следовательно,
![]() л.
л.
Пример 2.9. Относительная плотность газа по водороду составляет 6. Какой объем будут занимать 2 г этого газа при н.у.?
Решение. Определим молярную массу газа по уравнению (2.9а):
М = 2,016.6= 12,096 г/моль.
В соответствии с законом Авогадро
12,096 г газа занимают объем 22,4 л,
2 г газа занимают объем Vо л.
Откуда
![]() л.
л.
Пример 2.10. 8,8 г вещества при температуре 22 С и давлении 500 мм рт.ст. заняло объём 3,68 дм3. Какова молярная масса этого вещества?
Решение. Применим формулу Менделеева –Клапейрона (1.2):
![]() .
.
Все величины, входящие в формулу, должны быть выражены в одной системе единиц. Используем международную систему единиц СИ: кг, Па, м3, R=8,31 Дж/(моль•К).
В этом случае масса вещества составит 8,8•10-3 кг; температура 273+22=295 К; давление (500/760).101325= =66661 Па; объём 3,68•10-3 м3. Выразим молярную массу из уравнения Менделеева – Клапейрона:
![]()
Можно также воспользоваться значением R=62,36 (л•мм рт. ст.)/(моль•К). Тогда
![]()
Рассмотренные в этом разделе законы, а также некоторые другие легли в основу атомно-молекулярной теории – основу современной химии.
Атомно-молекулярная теория. Основные положения теории были сформулированы Д. Дальтоном в начале XIX в. Они заключаются в следующем.
1. Каждый элемент состоит из мельчайших частиц, называемых атомами.
2. Все атомы одного элемента одинаковы.
3. Атомы разных элементов обладают разными свойствами.
4. Атомы не создаются и не разрушаются в химических реакциях.
5. В результате комбинации атомов двух или нескольких элементов образуются молекулы.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Для характеристики атомов и молекул используют понятия относительной атомной массы (Аr), относительной молекулярной массы (Mr) и молярной массы вещества (МВ) (см. гл. 1 (Вводный курс)).
Масса атома любого элемента (абсолютная атомная масса атома) равна произведению его относительной атомной массы и атомной единицы массы (а.е.м.):
mэ = Ar. (а.е.м.),
1 а.е.м. = 1,6606•10-27кг.
Пример 2.11. Найти массу атома кислорода (абсолютную массу атома кислорода).
Решение. Масса атома кислорода составляет
Ао = 16 • 1,66•10-27 = 2,656•10-26кг = 2,656•10-23г.
