
- •Получение
- •Описание и растворимость
- •Физические свойства
- •Химические свойства
- •Подлинность
- •2. Реакция образования комплексных соединений с куркумином.
- •Чистота
- •Количественное определение
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Соединения висмута
- •Висмута нитрат основной Bismuthi subnitras
- •Получение
- •Описание и растворимость
- •Подлинность
- •Коричнево-черный осадок
- •2 Капли черный осадок
- •Чистота
- •Количественное определение
- •Цинка оксид Zinci oxydum
- •Получение
- •Описание и растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Количественное определение
- •Хранение
- •Применение
Соединения В, Bi, Zn.
Бор является элементом главной подгруппы третьей группы периодической системы, на внешнем электронном слое содержит три электрона. В соединениях проявляет степень окисления +3. Предвнешний слой атома бора содержит 2 электрона, преобладают неметаллические свойства
Бор относится к микроэлементам организма, биологическое значение его изучено недостаточно.
Бор был получен в 1808 году французским химиком Гей – Люссаком.
В природе бор сравнительно мало распространен в виде следующих минералов, представленных преимущественно солями тетраборной кислоты
борная кислота (сассолин) – Н3ВО3
бура – Na2B4O7 · 10 H2O
кернит - Na2B4O7· 4 H2O
борокальцит – CaB4O7· 4 H2O
ашарит – B2O3 · 2 MgO · H2O
Кислота борная Acidum boricum (ЛH)
H3BO3 Boric acid (MHH)
Получение
Основным сырьем для ее получения служат минералы. Так, при разложении ашаритовых пород серной кислотой при температуре 100 – 110С образуется борная кислота:
Кислоту борную получают из борсодержащих минералов при действии минеральных кислот (при нагревании). Реакция разложения:
Na2B4O7 • 10 H2O + 2НС1 → 4Н3В03 + 2NaCl + 5Н2O
Бура
CaB4O7 • 4Н2O + 2НС1 + H2O → 4Н3В03 + 2СаС12
Борокальцит
Na2B4O7 · 4Н2O + 2НС1 + H2O → 4Н3В03 + 2NaCl
Кернит
В2О3 · 2 MgO · H2O + 2 H2SO4 → 2 MgSO4 + 2 Н3ВО3
Ашарит
При охлаждении выделяется кислота борная, которую отфильтровывают и очищают.
Описание и растворимость
Бесцветные, блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок, без запаха. Плохо растворим в холодной воде, хорошо в горячей воде, медленно в глицерине (в 25 частях воды, в 4 частях кипящей воды, в 25 частях спирта и медленно в 7 частях глицерина).
Физические свойства
При нагревании в растворах улетучивается с парами воды и спирта.
При длительном нагревании до 100°С теряет часть воды и переходит в метаборную кислоту HBO2:
Н3ВО3 → НВО2 + H2O
При более сильном нагревании борная кислота образуется тетраборная кислота H2B4O7 в виде стекловидной сплавленной массы, а при полной потере воды образуется борный ангидрид B2O3. После растворения в воде все эти соединения снова переходят в борную кислоту.

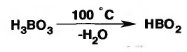
![]()
Химические свойства
1. Кислотно-основные. Кислота борная очень слабая кислота. Кдис = 6,4 •10-10 Водные растворы имеют слабокислую реакцию среды. При взаимодействии со щелочами образует соли: метабораты (NaBO2) или тетрабораты (Na2B4O7). Соли ортоборной кислоты H3BO3 не образуются.
2. Кислота борная с одноатомными алифатическими спиртами образует эфиры, с многоатомными спиртами и полифенолами - комплексные соединения.
При взаимодействии с глицерином кислота борная образует кислоту глицеринборную, которая проявляет более сильные кислотные свойства. Растворы кислоты борной в глицерине имеют кислую реакцию среды.
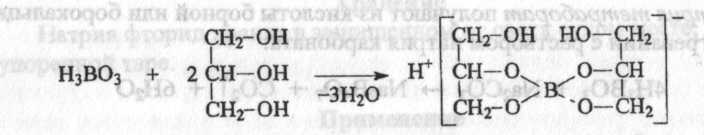
Подлинность
1.ФС Реакция образования борноэтилового эфира. Раствор кислоты борной в этаноле горит пламенем с зеленой каймой.


2. Реакция образования комплексных соединений с куркумином.
Д ля
проведения реакции используется
куркумовая бумага (фильтровальная
бумага, пропитанная раствором куркумина),
на которую наносится раствор JIB
и кислота хлороводородная разведенная.
После высушивания бумага окрашивается
в розовый цвет, при смачивании раствором
аммиака окраска переходит в
зеленовато-черную.
ля
проведения реакции используется
куркумовая бумага (фильтровальная
бумага, пропитанная раствором куркумина),
на которую наносится раствор JIB
и кислота хлороводородная разведенная.
После высушивания бумага окрашивается
в розовый цвет, при смачивании раствором
аммиака окраска переходит в
зеленовато-черную.
Куркумин – органическое вещество, получаемое из экстракта корней куркумы. Это кристаллы желто – оранжевого цвета. Исследуемый раствор борной кислоты наносят на куркумовую бумагу (фильтровальная бумага, пропитанная спиртовой настойкой куркумы), одновременно добавляя несколько капель хлороводородной кислоты. Появляется розовое или буровато – красное окрашивание, в зависимости от концентрации препарата. Если подействовать после этого раствором аммиака розовое окрашивание переходит в зеленое, затем в черное. Химизм происходящих реакций:
В куркуме содержится желтый краситель (диферулоилметан), который существует в двух таутомерных формах:


розоцианин (розовый или буровато-красный)
Методами ИК –спектроскопии установлено, что борная кислота вступает во взаимодействие с енольной формой куркумина.
Определению бора с куркумином мешают железо, вольфрам, которые в тех же условиях реагируют с куркумином с образованием подобных комплексов.
Из неофициальных реакций заслуживают внимание с α – окси и α – аминоантрохинонами. Эти органические агенты сами окрашены и дают цветные реакции с бромом.
Ализарин красный S в слабокислой среде образует с борной кислотой продукты синего цвета:
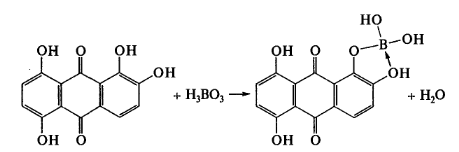
В слабо щелочной среде он переходит в соединение желтого цвета. Сам ализарин S в щелочной среде имеет фиолетовую окраску.
