
- •Херсонський національний технічний університет
- •Затверджено
- •Зав.Кафедри _______д.Г.Сарібєкова
- •Лабораторна робота № 1 Тема: аналіз води
- •Теоретичні передумови до виконання роботи
- •Дослід 5. Визначення окислювання води.
- •Записи в лабораторному журналі
- •Записи в лабораторному журналі
- •Дослід 6. Визначення рН води.
- •Записи в лабораторному журналі
- •Дослід 7. Визначення жорсткості води.
- •Контрольні питання
- •Лабораторна робота № 2 Тема: водопідготовка
- •Дослід 1. Видалення з води заліза
- •Дослід 2. Іонітна очистка води.
- •Обчислення результатів досліду.
- •Контрольні питання
- •Лабораторна робота № 3 Тема: аналіз сировини
- •Техніка визначення
- •Контрольні питання
- •Лабораторна робота № 4 Тема: сировина для одержання галогенів
- •Контрольні питання
- •Лабораторна робота № 5 Тема: мінеральна сировини для пігментів
- •Дослід 2. Синтез хром(ііі)оксиду
- •Дослід 4. Синтез смарагдової зелені із дихромату калію
- •Дослід 5. Синтез фосфата хрому СгРо4*зн2о
- •Варіанти робіт по синтезу хромових пігментів
- •Дослід 7. Визначення рН водного витягу
- •Дослід 8. Визначення маслоємкості пігментів
- •Записи у робочому журналі
- •Контрольні питання
- •Лабораторна робота № 6. Тема: аналіз вугілля – сировини для хімічної промисловості
- •Записи у робочому журналі
- •Записи у робочому журналі
- •Записи у робочому журналі
- •Записи у робочому журналі
- •Контрольні питання та розрахункові задачі
- •Лабораторна робота № 7
- •Якісне визначення води (проба на потріскування)
- •Контрольні питання
- •Лабораторна робота № 8 Тема: переробка нафти
- •Контрольні питання
- •Лабораторна робота № 9 Тема: аналіз рослинної сировини
- •Дослід 1. Визначення вологості рослинної сировини.
- •Зразок форми запису
- •Дослід 2. Визначення зольності рослинної сировини або целюлози
- •Зразок схеми запису
- •Техніка визначення
- •Vмл гідролізату - т мл глюкози
- •200Мл гідролізату - х мл глюкози
- •Лабораторна робота № 10 Тема: виділення целюлози із рослинної сировини
- •Запис у лабораторному журналі
- •Запис у лабораторному журналі
- •Висновки
- •Висновки Контрольні запитання
- •Лабораторна робота №11
- •Лабораторна робота № 12 Тема: переробка рослинної сировини
- •Дослід 1. D-Ксилоза з кукурудзяних качанів
- •Сировина і реактиви
- •100 Г кислоти містить 65,30 г
- •100 Г кислоти містить 90,05 г
- •Контрольні питання
- •Лабораторна робота №13 Тема: піроліз рослинної сировини
- •Визначення вологості деревини
- •Визначення оцтової кислоти
- •Визначення метилового спирту
- •Контрольні питання
- •Лабораторна робота №14 Тема: характеристика сировини тваринного походження
- •Контрольні питання
Дослід 1. Видалення з води заліза
Залізо у воді знаходиться у вигляді різних сполук; в поверхневих водах—у вигляді тонкодисперсної зависі гідроксиду або у складі органокомплексів; в підземних водах — найчастіше у вигляді гідрокарбонату заліза (II). З поверхневих вод залізо видаляють коагуляцією, якщо воно знаходиться у вигляді колодіїв.. Якщо залізо входить до складу органокомплексів, то комплекси спочатку руйнують хлором, озоном або іншими окислювачами і потім видаляють залізо коагуляцією або вапнуванням. З підземних вод залізо видаляють аерацією або фільтруванням, пропускаючи воду через фільтр з піску, з добавками перманганату калію.
1.1. Видалення заліза з води коагуляцією. У п'ять колб ємкістю до З наливають по 1 .досліджуваної води і добавляють насичений розчин вапна : в першу колбу — 20 , в другу — 40 , в третю — 60 , в четверту — 80 і в п'яту — 100 . Воду збовтують і залишають для відстоювання на 2 год, потім фільтрують через піщаний фільтр. Перші дві порції фільтрату (300—500 ) виливають, а в інших визначають вміст заліза і рН. Якщо рН в колбі № 5 (найбільша концентрація вапна) менше 8,35, то дослід повторюють, збільшуючи кількість вапна настільки, щоб рН було більше 8,35.
1.2. Видалення
заліза з води хлоруванням.
У п.'ять колб ємкістю до 3
наливають по 1
, досліджуваної води і додають
хлорної води з таким розрахунком, щоб
доза хлору була в першій колбі 3 мг/
,
в другій— 5 мг/
,
в третій — 8 мг/
,
четвертій — 10 мг/
і в п'ятій — 15 мг/
.
Воду в колбах перемішують і залишають
на 45 хв, після чого фільтрують через
піщаний фільтр. Перші порції фільтрату
з кожного циліндра виливають,
а наступні 100
![]() кип'ятять 20 хв і визначають в них вміст
заліза. Якщо вміст заліза в фільтраті
п'ятої колби значний, то визначення
повторюють з більшими дозами хлору.
кип'ятять 20 хв і визначають в них вміст
заліза. Якщо вміст заліза в фільтраті
п'ятої колби значний, то визначення
повторюють з більшими дозами хлору.
Результати дослідів заносять в таблицю.
Дослід 2. Іонітна очистка води.
Для тонкого очищення води від іонів кальцію, магнію, заліза та ін., а також для її знесолення застосовують метод іонного обміну. Для здійснення іонного обміну використовують іонообмінники, або іоніти.
Іонітами називають нерозчинні і неплавкі або малорозчинні речовини, що обмежено набухають у воді. Іоніти мають у своїй структурі функціональні групи кислотного або основного характеру і здатні до обміну іонів при контакті з іонами, що перебувають у розчинах. Це тверді, найчастіше високомолекулярні полікислоти і поліоснови або їх солі.
Іоніти бувають неорганічні та органічні, природні та штучні. Органічний синтетичний іоніт являє собою ви-сокомолекулярний органічний каркас, до якого приєднані іоногенні групи, здатні у водних розчинах дисоціювати на іони:
![]()
де![]() —
частина макромолекулярного каркасу
іоніту, еквівалентна одній іоногенній
групі. Кількість функціональних груп
може бути різною. Чим більше цих груп
в іонообміннику, тим більшу поглинальну
здатність він має.
—
частина макромолекулярного каркасу
іоніту, еквівалентна одній іоногенній
групі. Кількість функціональних груп
може бути різною. Чим більше цих груп
в іонообміннику, тим більшу поглинальну
здатність він має.
Іоніти поділяються на катіоніти, здатні обмінювати іони на катіони з розчину, аніоніти, здатні обмінювати іони на аніони розчину, амфотерні іоніти, здатні до обміну як катіонів, так і аніонів з розчину, і електронообмінники, здатні до реакцій окислення- відновлення.
Катіоніти мають
функціональні групи кислотного
характеру:
![]() ,
,
![]() ,
,
![]() ,
,
![]() (фенольний) та ін. До складу катіоніту
можуть входити функціональні групи
одного типу (монофункціональний катіоніт)
або різні функціональні групи
(поліфункціональний катіоніт).
(фенольний) та ін. До складу катіоніту
можуть входити функціональні групи
одного типу (монофункціональний катіоніт)
або різні функціональні групи
(поліфункціональний катіоніт).
До складу
аніонітів входять функціональні групи
основного характеру:![]() ,
,
![]() ,
,
![]() ,
,
![]() .
Аніоніти також бувають моно- і
поліфункціональні. Промислові іоніти,
як правило, поліфункціональні.
.
Аніоніти також бувають моно- і
поліфункціональні. Промислові іоніти,
як правило, поліфункціональні.
Амфотерні іоніти — це продукти конденсації амінів і фенолів, що містять первинні, вторинні і третинні аміногрупи, а також фенольні гідроксильні групи. В останньому випадку в іонітах переважає основний характер. Іоніти, які містять карбоксильні та імінні групи, мають більш виражений кислотний характер.
Іонообмінні реакції на твердих іонітах можна розглядати як рівноважні оборотні хімічні реакції.
Процес обміну на катіоніті можна показати такою схемою:
![]()
де R — частина макромолекулярного каркасу катіоніту;
К і К' — катіоніти. Катіоніти використовуються переважно в натрієвій, кальцієвій або в Н-формі.
Процес обміну на аніоніті можна представити такою схемою:
![]()
де R' — частина макромолекулярного каркасу аніоніту;
А і А' — аніони.
Аніоніти використовуються здебільшого в формі —ОН, їх застосовують для поглинання кислот або аніонів солей.
Процеси насичення на іонітах відбуваються досить повільно, тому для більш повного насичення іоніту відповідними іонами його розміщують товстим шаром у вертикальній циліндричній посудині — фільтрі. Щоб регенерувати іоніти, їх обробляють насиченими розчинами хлоридів, лугів або кислот. Швидкість, з якою досягається рівновага іонного обміну, є одним з найважливіших показників, що характеризують якість іоніту..На практиці використовують іоніти переважно у вигляді гранул з діаметром у 0,2—3 мм, або у вигляді мембран, пластин і стержнів.
Вітчизняною промисловістю випускаються іоніти таких марок. КУ-1, КУ-2, СДВ-3, КБ-4, АН-1, сульфо-вугілля, АН-2Ф, ЕДЕ-10п та ін.
Катіоніт КУ-1 — сильнокислотного типу, макромо-лекулярний каркас побудований з фенолоформальдегідних кілець. Основні функціональні групи і — ОН (фенольний). На зовнішній вигляд це чорний зернистий матеріал з розміром гранул 0,25—2 мм. Катіоніт має високу хімічну стійкість щодо кислот (за винятком азотної), але менш стійкий до дії лугів.
Катіоніти КУ-2, СДВ-3 — сильнокислотного типу, макромолекулярні каркаси яких побудовано з стирол-дивінілбензольних кілець. Основна ( і єдина ) функціональна група . Вони характеризуються найвищою ємністю поглинання, високою хімічною стійкістю. Концентровані кислоти (за винятком .азотної) навіть при нагріванні не руйнують їх. Концентровані луги без нагрівання також не змінюють їх властивостей.
Сульфовугілля
— катіоніт сильнокислотного типу.
Основна активна група —![]() .
Може мати також групи —СООН і —ОН.
Чорний зернистий матеріал розміром
гранул від 0,2 до 12 мм. Сульфовугілля має
найменші поглинальну здатність, хімічну
і механічну стійкість. Воно дешеве,
легко регенерується і тому широко
використовується для зм'якшення
води. Регенерація здійснюється
8—10%-ним розчином NаСІ.
.
Може мати також групи —СООН і —ОН.
Чорний зернистий матеріал розміром
гранул від 0,2 до 12 мм. Сульфовугілля має
найменші поглинальну здатність, хімічну
і механічну стійкість. Воно дешеве,
легко регенерується і тому широко
використовується для зм'якшення
води. Регенерація здійснюється
8—10%-ним розчином NаСІ.
Катіоніт КБ-4 – слабокислотного типу . Основна (і єдина) функціональна група—СООН.
Катіоніт СВС має основну функціональну групу — . Застосовується у виробництві антибіотіків, вітамінів, для розділення рідкісних металів, знесолювання води і очистки розчинів від іонних домішок.
Аніоніт ЕДЕ-10п — низькоосновний іоніт. Основні функціональні групи =NН і =N. Застосовується для тонкої очистки води (поглинає кремнієву кислоту) і для
очистки води парових котлів.
Аніоніт АН.-2Ф
— низькоосновний іоніт. Основні
функціональні групи =NН і
![]() ,
має також фенольні гідроксиди, які
зумовлюють амфотерність аніоніту.
,
має також фенольні гідроксиди, які
зумовлюють амфотерність аніоніту.
Аніоніт АН -1 — низькоосновний іоніт. Основні функціональні групи = NН і . Макромолекулярний каркас побудований з триазенових кілець. Поглинає аніони нейтральних солей і слабкі кислоти. Добре сорбує барвники. Перед застосуванням повинен бути регенерований содою або лугом.
Основним показником для іонітів є обмінна ємність. Іоніти мають два показники обмінної ємності.
Статична обмінна ємність (СОЄ ) характеризується кількістю іонів (у міліграм -еквівалентах на грам сухої смоли), яка поглинається в статичних умовах за умовну одиницю часу.
Динамічна обмінна ємність ( ДОЄ) характеризується кількістю іонів (у міліграм-еквівалентах на літр набухлої смоли) , які поглинаються в динамічних умовах. до проходження (проскакування) цих іонів у фільтрат.
З усіх відомих
катіонітів сульфокислотного типу
найменшою обмінною ємністю характеризується
сульфовугілля. За 0,1 н. розчином
![]() у статичних умовах (СОЄ
)
— 0,8—1,0 мг-екв/г. Динамічна обмінна
ємність за 0,01 н. розчином
(ДОЄ
)
215—360 мг-екв/
.
Для катіоніту КУ-2 СОЄ дорівнює 4,3—4,9
мг-екв/г, а ДОЄ за 0,007 розчином
—1100—1300.
мг-екв/
.
у статичних умовах (СОЄ
)
— 0,8—1,0 мг-екв/г. Динамічна обмінна
ємність за 0,01 н. розчином
(ДОЄ
)
215—360 мг-екв/
.
Для катіоніту КУ-2 СОЄ дорівнює 4,3—4,9
мг-екв/г, а ДОЄ за 0,007 розчином
—1100—1300.
мг-екв/
.
Мал. 1.
Схема установки для зм’якшення
води: а
– катіонообмінник; б
- аніонообмінник![]() .
Регенерований катіоніт відмивають
водою до повного зникнення іонів хлору,
витрачаючи на це близько 1000
води.
.
Регенерований катіоніт відмивають
водою до повного зникнення іонів хлору,
витрачаючи на це близько 1000
води.
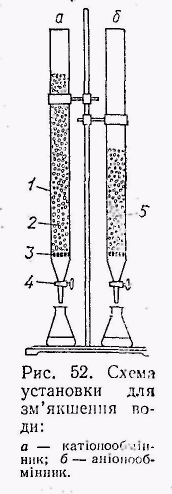 Аніоніт регенерують
2—3%-ним розчином NaОН. Повноту промивання
контролюють фенолфталеїном.
Аніоніт регенерують
2—3%-ним розчином NaОН. Повноту промивання
контролюють фенолфталеїном.
Через підготовлену
колонку з катіонітом пропускають
200—250
води,
призначеної для зм'якшення і знесолювання,
в якій попередньо визначено загальну
твердість комплексонометричним
методом, карбонатну твердість, вміст
хлору аргентометричним методом і вміст
![]() .
Швидкість пропускання води регулюють
краном 4 .
.
Швидкість пропускання води регулюють
краном 4 .
50 мл води, профільтрованої через катіоніт, пропускають з такою ж швидкістю через аніоніт. Після очищення води визначають загальну твердість води комплексонометричним способом, карбонатну і некарбонатну твердість, вміст іонів хлору та сульфату, роблять обчислення і порівн юють результати.
