
- •Многоэлектронные атомы. Спин-орбитальное взаимодействие. Состояние и термы многоэлектронного атома в схеме Рассела-Саундерса
- •Спин-орбитальное взаимодействие
- •Состояние и термы
- •Спектры атома водорода, щелочных и щелочно-земельных элементов.
- •Нормальный и аномальный эффект Зеемана. Эффект Пашена-Бака.
- •Приближение Борна-Оппенгеймера. Электронное строение молекул в простом методе молкао. Диаграммы орбитальных энергий и термы состояний двухатомных молекул
- •Симметрия молекул. Точечные группы симметрии. Таблица характеров. Применение симметрии для классификации молекулярных орбиталей
- •Электронное строение многоатомных молекул. Канонические и локализованные мо. Термы состояний.
- •Геометрия молекул. Гибридизация и валентные углы. Концепция оэпво.
- •Применение квантовохимических представлений для описания реакционной способности молекул.
- •Принцип сохранения орбитальной симметрии. Электроциклические реакции.
- •Принцип сохранения орбитальной симметрии. Реакции циклоприсоединения.
- •Строение комплексов переходных элементов. Теория кристаллического поля (ткп). Энергия стабилизации кристаллическим полем. Эффект Яна-Теллера.
- •Магнитные и спектральные свойства комплексов в теории кристаллического поля.
- •Теория поля лигандов (тпл) для октаэдрических комплексов. П-Взаимодействия в комплексах переходных элементов.
- •Электрический дипольный момент и его роль в теории строения молекул. Определение дипольных моментов молекул.
- •Деформация молекул во внешнем электрическом поле. Индуцируемый дипольный момент и поляризуемость. Определение поляризуемости.
- •Уравнение Ланжевена-Дебая. Уравнение Лорентца-Лоренца. Мольная рефракция и её применение.
- •Составляющее полной энергии молекул. Характеристика электронных, колебательных и вращательных состояний молекул. Относительная заселённость различных состояний.
- •Взаимодействие электромагнитного излучения с молекулами. Условия поглощения электромагнитного излучения.
- •Вращение молекул. Вращательные состояния и вращательные спектры двухатомных молекул и их применение.
- •Вращательные состояния и вращательные спектры молекул. Определение межатомных расстояний и валентных углов.
- •Колебания молекул. Колебательные состояния и колебательные спектры двухатомных молекул.
- •Колебательно-вращательные спектры двухатомных молекул
- •Колебания двухатомных молекул. Нормальные координаты и нормальные колебания
- •Явление комбинационного рассеяния и его применение для определения структуры молекул. Кр-спектроскопия.
- •Правила отбора в колебательной спектроскопии. Использование симметрии
- •Приближение групповых колебаний. Его обоснование и ограничения. Использование в ик-спектроскопии.
- •Электронная спектроскопия. Электронные состояния молекул и электронные переходы. Классификация электронных переходов.
- •Правила отбора в электронных спектрах и интенсивность полос поглощения. Использование симметрии в правилах отбора.
- •Принцип Франка-Кондова и колебательная структура полос в электронных спектрах.
- •Связь электронных спектров со структурой молекул. Хромофоры и акусохромы. Сопряжённые и ароматические системы.
- •Структурные и сольватационные эффекты в электронной спектроскопии поглощения.
- •Фотофизические процессы, сопровождающие поглощение электромагнитного излучения уф и видимой области (диаграмма Яблонского)
- •Магнитные моменты ядер. Взаимодействие спиновых состояний систем с внешним магнитным полем. Условия наблюдения ядерного магнитного резонанса (ямр)
- •Химический сдвиг в ямр и факторы, определяющие его величину.
- •Спин-Спиновое взаимодействие в ямр и его проявление. Понятие о спектрах первого порядка и спектрах высших порядков.
- •Понятие о спектроскопии эпр и области её применения.
Многоэлектронные атомы. Спин-орбитальное взаимодействие. Состояние и термы многоэлектронного атома в схеме Рассела-Саундерса
Спектры атома водорода, щелочных и щелочно-земельных элементов.
Нормальный и аномальный эффект Зеемана. Эффект Пашена-Бака.
Приближение Борна-Оппенгеймера. Электронное строение молекул в простом методе МОЛКАО. Диаграммы орбитальных энергий и термы состояний двухатомных молекул
Симметрия молекул. Точечные группы симметрии. Таблица характеров. Применение симметрии для классификации молекулярных орбиталей
Электронное строение многоатомных молекул. Канонические и локализованные МО. Термы состояний.
Геометрия молекул. Гибридизация и валентные углы. Концепция ОЭПВО.
Применение квантовохимических представлений для описания реакционной способности молекул.
Принцип сохранения орбитальной симметрии. Электроциклические реакции.
Принцип сохранения орбитальной симметрии. Реакции циклоприсоединения.
Строение комплексов переходных элементов. Теория кристаллического поля (ТКП). Энергия стабилизации кристаллическим полем. Эффект Яна-Теллера.
Магнитные и спектральные свойства комплексов в теории кристаллического поля.
Теория поля лигандов (ТПЛ) для октаэдрических комплексов. п-Взаимодействия в комплексах переходных элементов.
Электрический дипольный момент и его роль в теории строения молекул. Определение дипольных моментов молекул.
Деформация молекул во внешнем электрическом поле. Индуцируемый дипольный момент и поляризуемость. Определение поляризуемости.
Уравнение Ланжевена-Дебая. Уравнение Лорентца-Лоренца. Мольная рефракция и её применение.
Составляющее полной энергии молекул. Характеристика электронных, колебательных и вращательных состояний молекул. Относительная заселённость различных состояний.
Взаимодействие электромагнитного излучения с молекулами. Условия поглощения электромагнитного излучения.
Вращение молекул. Вращательные состояния и вращательные спектры двухатомных молекул и их применение.
Вращательные состояния и вращательные спектры молекул. Определение межатомных расстояний и валентных углов.
Колебания молекул. Колебательные состояния и колебательные спектры двухатомных молекул.
Колебательно-вращательные спектры двухатомных молекул
Колебания двухатомных молекул. Нормальные координаты и нормальные колебания
Явление комбинационного рассеяния и его применение для определения структуры молекул. КР-спектроскопия.
Правила отбора в колебательной спектроскопии. Использование симметрии
Приближение групповых колебаний. Его обоснование и ограничения. Использование в ИК-спектроскопии.
Электронная спектроскопия. Электронные состояния молекул и электронные переходы. Классификация электронных переходов.
Правила отбора в электронных спектрах и интенсивность полос поглощения. Использование симметрии в правилах отбора.
Принцип Франка-Кондова и колебательная структура полос в электронных спектрах.
Связь электронных спектров со структурой молекул. Хромофоры и акусохромы. Сопряжённые и ароматические системы.
Структурные и сольватационные эффекты в электронной спектроскопии поглощения.
Фотофизические процессы, сопровождающие поглощение электромагнитного излучения УФ и видимой области (диаграмма Яблонского)
Магнитные моменты ядер. Взаимодействие спиновых состояний систем с внешним магнитным полем. Условия наблюдения ядерного магнитного резонанса (ЯМР)
Химический сдвиг в ЯМР и факторы, определяющие его величину.
Спин-Спиновое взаимодействие в ЯМР и его проявление. Понятие о спектрах первого порядка и спектрах высших порядков.
Понятие о спектроскопии ЭПР и области её применения.
Многоэлектронные атомы. Спин-орбитальное взаимодействие. Состояние и термы многоэлектронного атома в схеме Рассела-Саундерса
Задача многоэлектронного атома решается не до конца. Собственно, в чём она заключается – тоже не ясно. Но Гамильтониан рассчитать нужно. В данном случае к V и T добавляется ещё энергия межэлектронного отталкивания.
 ,
где первый шлакоблок – кинетическая
энергия, второй – потенциальная, третий
– межэлектронное отталкивание.
,
где первый шлакоблок – кинетическая
энергия, второй – потенциальная, третий
– межэлектронное отталкивание.
Приближение независимых частиц: каждый электрон движется в потенциальном поле, которое складывается из поля, вызываемого ядром, и поля, создаваемого всеми остальными электронами. Суммарное потенциальное поле обладает сферической симметрией.
Орбиталь – одноэлектронная пространственно-волновая функция. Спин не учитывается. Может быть атомной и молекулярной.
Вообще задачу многоэлектронного атома решает метод самосогласованного поля. Но он не учитывает принцип Паули, и это плохо.
Спин – некоторое свойство, связанное с вращением. Спину приписывают оператор углового момента и соответствующую спиновую координату.
Принцип Паули: для частиц с полуцелочисловым спином волновая функция должна быть антисимметрична относительно перестановки двух любых частиц (???????????)
Согласно принципу суперпозиции, если волновые функции являются вырожденными, то их линейная комбинация тоже будет решением уравнения Шрёдингера.
Спин-орбитальное взаимодействие
Взаимодействие спиново-углового момента электрона и его орбитально-углового момента, которое осуществляется посредствам соответствующих магнитных моментов, называется спин-орбитальным взаимодействием. Электрон – заряженная частица, и его движение в пространстве может вызывать его угловой момент, а угловой момент заряженной частицы вызывает магнитный момент. Спиновое движение всегда сопровождается возникновением магнитного момента.
Тут пара формул важна: гиромагнитное соотношение, магнетон бора.
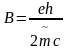 ;
;
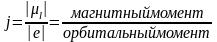
Спин-орбитальное взаимодействие зависит от заряда ядра, пропорционально ему примерно в четвёртой степени. Для тяжёлых атомов оно сравнимо с межэлектронным отталкиванием (по величине, что ли?).
Состояние и термы
Терм – значок, в котором зашифрованы основные свойства электронного состояния атома. Дохрена правил определения терма, главное что помнить – это таблица, которую пилил Сева у доски ещё на квантах Матулиса.
Правила Хунда (напишу одно) (в скобках – то, что соотв. наименьшей энергии):
Для одной и той же электронной конфигурации, мультиплетности (больше), L (больше), наименьшая энергия будет соответствовать уровню с наименьшей/наибольшей j если оболочка заполнена меньше/больше чем наполовину. Например, 3P0 – самый низкий по энергии терм.
Спектры атома водорода, щелочных и щелочно-земельных элементов.
Сперва нужно определить, какие термы есть у атома водорода и элементов.
У щелочных: 2S1/2, 2P3/2, 2P1/2, 2D3/2, 2D1/2.
У земельных: 1S0, 1P1, 1D2, 3S1, 3P0, 3P1, 3P2, 3D3, 3D2, 3D1.
Надо помнить правило отбора: L=+-1, спин не изменяется, j=+- 1.
т.е. электрон с S-орбитали может перейти только на P-орбиталь. с Р-орбитали либо на S-орбиталь либо на D-орбиталь
что касается j. к примеру электрон может переместиться с P1/2 на D3/2, но не может переместиться на D5/2
уточню: j может изменяться на -1 и +1 или не измениться. но если j = 0, то он не может перейти на другой терм где j=0
j - суммарный спиновый и орбитальный момент
