
Metod_Dipl_bak_2017_РВЦ (3)
.pdfУ підрозділі 3.2 (Розрахунок потужності виробництва) наводяться дані про випуск продукції в Україні (перелік підприємств), а також дані щодо імпорту. З врахуванням розрахованої річної потреби у цільовому продукті і даних щодо його випуску та імпорту, обґрунтовується необхідна потужність виробництва.
Виконання підрозділів 3.3 (Розрахунок об’єму ферментера та кількості виробничих циклів) та 3.4 (Розрахунок кількості стадій підготовки посівного матеріалу) здійснюється як у курсовій роботі (дисципліна «Технології мікробного синтезу лікарських засобів» [5], 3-й курс) та курсовому проекті (дисципліна «Основи проектування біотехнологічних виробництв» [2], 4-й курс).
При розрахунку кількості виробничих циклів обов’язково наводиться тривалість кожної операції циклу роботи ферментера.
Приклад 11. Наведення опису циклу роботи ферментера.
Підготовка ферментера включає: миття та огляд (2 год), перевірка на герметичність (2 год), стерилізація (2 год), охолодження (до 2 год), завантаження середовища (1 год), засів (0,5 год), вивантаження культуральної рідини (1 год).
Зверніть увагу! Залежно від об’єму ферментатора тривалість підготовчих робіт буде різною.
Розділ 4. Біосинтез цільового продукту Зверніть увагу! Вимоги до виконання цього розділу наведено у
методичних рекомендаціях до виконання курсової роботи з дисципліни «Біохімічні основи мікробного синтезу» [6].
Підрозділ 4.1. Шляхи катаболізму ростового субстрату у біологічного агента.
У цьому підрозділі студент на основі даних підрозділу 2.1, що стосуються складу обраного поживного середовища, використовуючи електронну базу
KEGG (Kyoto Encyclopedia of Genes and Genomes) повинен навести і описати схему катаболізму ростового субстрату у біологічного агента із зазначенням ключових ферментів з їх класифікаційними номерами у дужках. За відсутності певного штаму або виду в базі KEGG описують метаболізм близькоспорідненого мікроорганізму (наприклад, представника того самого роду).
Приклад 12. Шляхи катаболізму глюкози у Corynebacteruim. glutamicum
АТСС13032
Джерелом вуглецю та енергії (ростовим субстратом) у поживному середовищі (для біосинтезу метіоніну є глюкоза [12].
Згідно Kyoto Encyclopedia of Genes and Genomes [14] катаболізм глюкози у C. glutamicum АТСС13032 відбувається за шляхом Ембдена–Мейєргофа–Парнаса (гліколіз), про що свідчить наявність відповідного ключового ферменту 6-фосфофруктокінази 1 (КФ.2.7.1.11).
Гліколізу у C. glutamicum АТСС13032 притаманні певні особливості, пов’язані з ферментами, що функціонують у даному метаболічному шляху. Так, перетворення α-D-
21
глюкозо-1-фосфату на α-D-Глюкозо-6-фосфат відбувається під дією ферменту фосфоглюкомутази (КФ.5.4.2.2). Фермент глюкозо-6-фосфатізомераза (КФ.5.3.1.9) каталізує взаємне перетворення α-D-глюкозо-6-фосфату, β-D-Фруктозо-6-фосфату і β-D- глюкозо-6-фосфату. З β-D-Фруктозо-6-фосфату під дією 6-фосфофруктокінази 1 (КФ.2.7.1.11) утворюється β-D-фруктозо-1,6-дифосфат, частина якого за допомогою фруктозо-1,6-біфосфатази ІІ (КФ.3.1.3.11) зворотно перетворюється на попередню сполуку.
Фермент фруктозобіфосфатальдолаза, клас ІІ (КФ.4.1.2.13) здійснює перетворення β- D-фруктозо-1,6-дифосфату на дві сполуки: гліцеральдегід-3-фосфат та дигідроксиацетонфосфат. Ізомеризація 3-фосфогліцерату відбувається під дією двох ферментів: 2,3-біфосфатзалежної фосфогліцератмутази (КФ 5.4.2.11) та фосфогліцератмутази (КФ 5.4.2.12). Заключною реакцією гліколізу є перетворення фосфоенолпірувату на піруват, що каталізується ферментом піруваткіназою. Далі піруват залучається до метаболізму за участю специфічної піруватдегідрогенази Е1 (КФ 1.2.4.1) або дигідроліпоаміддегідрогенази (КФ 1.8.1.4).
Схему катаболізму глюкози за шляхом Ембдена – Мейєргофа – Парнаса наведено на рис. 4.1.
Підрозділ 4.2. Біотрансформація ростового субстрату у цільовий продукт.
У цьому підрозділі на одному аркуші (формат А3 і більше) студент повинен навести, а в пояснювальній записці описати схему біосинтезу цільового продукту, починаючи з реакцій метаболізму ростового субстрату (джерела вуглецю і енергії у середовищі культивування). В описі схеми необхідно обов’язково вказувати, які ферменти здійснюють ті чи інші перетворення із зазначенням їх класифікаційних номерів. У процесі складання схеми біосинтезу необхідно враховувати конкретні шляхи катаболізму певного субстрату, які функціонують у клітинах даного біологічного агента.
Приклад 13. Біосинтез метіоніну C. glutamicum АТСС13032 з глюкози
Під час росту C. glutamicum АТСС13032 на середовищі 2 глюкоза (джерело вуглецю) перетворюється на піруват у гліколізі [14]. Далі піруват під дією дигідроксиліпоаміддегідрогенази (КФ 1.8.1.4) перетворюється на ацетил-КоА, який залучається до циклу трикарбонових кислот (ЦТК).
Метіонін належить до аспартатної родини амінокислот, попередником якої є оксалоацетат (інтермедіат ЦТК). Оксалоацетат перетворюється на аспартат, який відновлюється через 4-аспартилфосфат (фермент аспартаткіназа, КФ 2.7.2.4) до напівальдегіду аспарагінової кислоти (фермент аспартатнапівальдегіддегідрогеназа, КФ 1.2.1.11) [14]. Напівальдегід аспарагінової кислоти через гомосерин перетворюється на О- ацетилгомосерин. Необхідно зазначити, що такий інтермедіат характерний саме для C. glutamicum, у той час як у більшості мікроорганізмів утворюється О-сукцинілгомосерин [9].
У продуцентів метіоніну є два шляхи включення сірки до структури амінокислоти: транс-сульфурування та пряме сульфідування. У багатьох мікроорганізмів функціонує лише один шлях, у той час як у C. glutamicum – обидва. Під час транс-сульфурування сірка з цистеїну залучається до метаболізму на рівні цистатіоніну, а за функціонування прямого сульфідування – у вигляді сульфіду при перетворенні О-ацетилгоморесину на гомоцистеїн [1, 5, 9]. Заключною реакцією, в результаті якої утворюється метіонін, є трансформація
22
гомоцистеїну під дією гомоцистеїнметилтрансфераз (КФ 2.1.1.13; КФ 2.1.1.14).
Пул оксалоацетату у C. glutamicum поповнюється карбоксилюванням фосфоенолпірувату та пірувату. Ці анаплеротичні реакції каталізують ферменти фосфоенолпіруваткарбоксилаза (КФ 4.1.1.31) та піруваткарбоксилаза (КФ 6.4.1.1) [14].
Схему перетворення ростового субстрату глюкози на кінцевий продукт метіонін наведено на рис. 4.2 [14].
Розділ 5. Обґрунтування вибору технологічної схеми
Уданому розділі викладення матеріалу має бути за принципом «не як , а чому» (не описувати способи реалізації певної стадії, а акцентувати увагу на причини вибору однієї з них).
Підрозділ 5.1.1. Обґрунтування способу культивування.
Уцьому підрозділі студент повинен обґрунтувати вибір способу культивування (глибинне, твердо-фазне, періодичне, безперервне, напівбезперервне) конкретного біологічного агента для забезпечення максимальної ефективності процесу біосинтезу. Підставою для вибору параметрів біосинтезу (рН, температура, аерація, перемішування тощо є інформація з розділу «Характеристика біологічного агента», а також відомості про фізико-хімічні властивості цільового продукту.
Так, наприклад, відомо, що у процесі безперервного культивування продуцентів мікробних екзополісахаридів можливе виникнення варіантів, які синтезують цільовий продукт із зміненими реологічними характеристиками, тому зазвичай одержання цих метаболітів здійснюють під час періодичного культивування продуцентів.
Якщо оптимум рН для продуцента цільового продукту перебуває у межах 4,0−4,5, або біологічний агент є термофілом (оптимальна температура 45−55°С), можлива реалізація процесу біосинтезу у нестерильних умовах.
На підставі інформації про відношення біологічного агенту до кисню та їх потреб у розчиненому кисні обґрунтовується вибір режимів перемішування та інтенсивності аерації для забезпечення необхідної інтенсивності масопереносу кисню під час проведення аеробного біосинтезу.
Так, наприклад, під час біосинтезу мікробних екзополісахаридів спостерігається підвищення в’язкості культуральної рідини, що супроводжується зниженням ефективності масообміну, тому для культивування продуцентів цих мікробних метаболітів доцільніше використовувати ферментер
зрегульованою кількістю обертів перемішуючого пристрою (наприклад, від 100 до 400 об/хв на початку і в кінці процесу культивування відповідно). Крім того, збільшення в’язкості культуральної рідини у процесі синтезу полісахаридів необхідно враховувати і під час вибору типу перемішуючого пристрою.
Приклад 14. Обґрунтування способу культивування Amycolatopsis mediterranei NCH − продуцента антибіотика рифампіцину.
Оскільки оптимальною температурою для культивування аеробного штаму A. mediterranei NCH є 30 °С, а оптимальним значенням рН нейтральне, то можливий ризик
23
контамінації сторонніми мезофільними і нейтрофільними мікроорганізмами. Це зумовлює необхідність забезпечення асептичних умов під час біосинтезу, чого неможливо досягти при поверхневому (твердо-фазному) культивуванні. Асептичні умови забезпечуються стерилізацією обладнання і комунікацій, поживного середовища, аераційного повітря, піногасників. Для запобігання контамінації в ферментері створюється надлишковий тиск.
У зв’язку з викладеним вище, культивування A. mediterranei NCH для біосинтезу рифампіцину здійснюють глибинним способом.
Незважаючи на суттєві переваги безперервного культивування перед періодичним, біосинтез рифампіцину здійснюється у періодичному процесі, оскільки максимальний синтез антибіотика відбувається у стаціонарній фазі росту продуцента. Отже, «підтримання» штаму-продуцента в експоненційній фазі росту є недоцільним, так як у цьому разі спостерігатиметься зниження концентрації антибіотику у культуральній рідині
Підрозділ 5.1.3. Вибір мийних та дезінфікуючих засобів
Вибір мийних та деззасобів часто ґрунтується або на вартості за 1 л концентрату, або 1 л робочого розчину. Це не завжди правильно, оскільки витрати робочого розчину різних мийних та деззасобів на обробку певної площі можуть бути різними. Очевидно, що об’єктивним критерієм вибору є вартість певного об’єму розчинів, необхідних для обробки однакової певної площі.
Дані щодо вибору мийних та дезінфікуючих засобів доцільніше наводити у вигляді узагальнюючої таблиці (приклад 15).
Підрозділ 5.1.4. Особливості підготовки та стерилізації поживного середовища
Повинні бути представлені дані розрахунку об’ємів середовищ, певних композицій і на основі цього здійснено вибір способу стерилізації (автоклав, безпосередньо інокуляторі чи ферментаторі, УБС тощо). На основі цього робиться висновок про необхідність наявності у технологічній і апаратурній схемі відповідних збірників, реакторів для приготування розчинів, композицій тощо:
−підготовка розчинів титрувальних агентів. Якщо у процесі культивування змінюється рН, або передбачається стерилізація розчину всіх солей (як фосфорних, так і солей кальцію, і магнію) безпосередньо у ферментаторі, то необхідною є наявність збірників для приготування розчинів кислоти та лугу;
−підготовка підживлювальних розчинів (якщо реалізується культивування з дробним внесенням субстрату) здійснюється в окремих реакторах;
−освітлення меляси потребує не тільки приготування розчину сірчаної кислоти, а й центрифуги для відділення осаду сульфату кальцію і збірника для фугату.
Зверніть увагу! Освітлення меляси передбачено у технології одержання хлібопекарських дріжджів, оскільки наявні у мелясі катіони кальцію інгібують ріст Saccharomyces cerevisiae. Термін «освітлення меляси» не треба плутати з поняттям «гідроліз меляси». Гідролізована меляса використовується для вирощування біологічних агентів, які не здатні асимілювати сахарозу. Стадія одержання гідролізованої меляси після добавлення до розбавленої удвічі
24
Приклад 15. Узагальнана характеристика витрат мийних та дезінфікувальних засобів
|
|
|
Загальна |
Кількість |
|
|
Загальна |
|
|
|
|
площа (об’єм) |
|
|
вартість |
||
|
|
|
робочого |
Вартість 1 л/кг |
Вартість 1 л |
|||
|
Об’єкт миття |
Концентрація |
обробки |
миття та/або |
||||
Назва |
розчину за |
мийного або |
робочого |
|||||
та/або |
робочого |
об’єкту за весь |
дезинфекції |
|||||
засобу |
весь період |
дезинфікувального |
розчину |
|||||
дезинфекції |
розчину, % |
період |
за весь період |
|||||
|
виробництва, |
засобу, грн |
засобу, грн |
|||||
|
|
|
виробництва, |
виробництва, |
||||
|
|
|
л |
|
|
|||
|
|
|
м2 (м3) |
|
|
грн |
||
|
Обладнання, |
|
|
|
|
|
|
|
Каустична сода [1] |
інвентар, |
2 |
432 |
129 000 |
22 |
0,44 |
56 760 |
|
|
комунікації |
|
|
|
|
|
|
|
|
Обладнання, |
|
|
|
|
|
|
|
Датонал-12 н/н [2] |
інвентар, |
2 |
432 |
129 000 |
31,8 |
0,64 |
82 560 |
|
|
комунікації |
|
|
|
|
|
|
|
|
Обладнання, |
|
|
|
|
|
|
|
Лойран – про 12 [3] |
інвентар, |
2 |
432 |
129 000 |
23,5 |
0,47 |
60 630 |
|
|
комунікації |
|
|
|
|
|
|
|
Ексан-про-дез [4] |
Стіни, підлога, |
2 |
6 230 |
623 |
38,3 |
0,72 |
449 |
|
вікна, двері. |
||||||||
|
|
|
|
|
|
|
||
Гембар [5] |
Стіни, підлога, |
0,5 |
6 230 |
623 |
150 |
0,75 |
467 |
|
вікна, двері |
||||||||
|
|
|
|
|
|
|
||
Хлорамін Б [5] |
Стіни, підлога, |
3,0 |
6 230 |
1 869 |
20 |
0,6 |
1121 |
|
вікна, двері |
||||||||
|
|
|
|
|
|
|
||
Лойран – про 13 [6] |
Стіни, підлога, |
2 |
6 230 |
623 |
24.7 |
0,49 |
305 |
|
вікна, двері |
||||||||
|
|
|
|
|
|
|
Примітка: * - ціни наведено, станом на листопад 2016 р.
Джерела:1 – http://promlabchem.com.ua/kausticheskaya-soda 2 – http://dp.prom.ua/p10889952-dezinfektsionnoe-sredstvo- datonal.html?no_redirect=1; 3 – http://novahim.com.ua/lojran-pro-12-mojushchee-sredstvo-s-antimikrobnym-dejstviem-i-ponizhennym- penoobrazovaniem-2; 4 – http://novahim.com.ua/eksan-pro-dez-mojushchee-sredstvo-dlja-udalenija-zhirovyh-zagrjaznenij-6; 5 – http://www.attis.com.ua/site/liquid/gembar.html/ 6 – http://novahim.com.ua/lojran-pro-13-mojushchee-sredstvo-s-antibakterialnym-dejstviem-dlja- udalenija-organicheskih-zhir-belok-2
25
меляси розчину сірчаної кислоти до досягнення рН 4−4,5 передбачає стерилізацію при 112 °С, проте не потребує відділення осаду сульфату кальцію.
− попереднє розварювання різних видів борошна і крохмалю
здійснюється в окремих реакторах.
Особливості стерилізації термолабільних компонентів середовища
(залежно від об’єму необхідно передбачити використання або стерилізуючої фільтрації, або ультра- (мікро-)фільтраційної установки).
Зверніть увагу!
1.Якщо стерилізація середовища відбувається у ферментері, то безпосередньо у ньому не можна готувати середовища. Для приготування
середовища перед ферментером має бути збірник.
2.Для унеможливлення утворення осаду фосфатів кальцію і магнію у збірник завантажують всі солі (разом), потім воду, розчиняють солі, після чого подають у ферментер, доводять рН до 4…4,5 і стерилізують. Використовувати
для підкислення треба нестерильний розчин соляної кислоти.
3.Якщо перед стерилізацію середовища здійснювали підкислення до рН 4…4.5, то перед внесенням посівного матеріалу необхідно підлужнити середовище (стерильним розчином лугу) до оптимального рівня рН.
4.Об’єм середовища у качалочних колбах геометричним об’ємом 750 мл має становити 100-250 мл.
5.Для стерилізації в установці безперервної стерилізації (УБС) всі компоненти середовища (і фосфорні солі, і кальцієві, і магнієві, і термолабільні компоненти) можуть готуватися як один розчин (в одному збірнику). Компоненти поживного середовища, які потребують попереднього розварювання (крохмаль, борошно), готують в окремих реакторах і подають у збірник УБС, де проходить змішування усіх компонентів поживного середовища.
5.2.Обгрунтування стадій виділення і очищення цільового продукту
У цьому підрозділі насамперед наводяться етапи виділення та очищення
цільового продукту, а потім здійснюється обґрунтування вибору кожного з них.
Приклад 16. Етапи віділення рифампіцину
Культуральна рідина містить як цільовий продукт (позаклітинний антибіотик рифампіцин), так і залишки поживного середовища, продукти метаболізму та клітини продуцента. Виділення і очищення цільового продукту включає такі етапи:
1.Відділення біомаси.
2.Підкислення супернатанту.
3.Екстракція рифампіцину.
4.Концентрування
5.Сушіння.
Незалежно від способу локалізації цільового продукту (внутрішньоклітинно чи у культуральній рідині) першою стадією є відділення біомаси.
26
Приклад 17. Обгрунтування вибору способу відділення біомаси у виробництві бактеріоцину.
Першим етапом виділення бактеріоцину є відділення клітин продуцента (Е. faecium DSH20) та індуктора (L. plantarum 1 LVP7) від культуральної рідини та отримання супернатанту, що містить бактеріоцин. Для відділення бактеріальних клітин використовують вакуум-фільтри, флотацію, центрифугування тощо [77].
Фільтрування на вакуум-фільтрах бактеріальних суспензій пов'язане з великими труднощами, які зумовлені малим розміром клітин, високою в'язкістю суспензій і наявністю великої кількості домішок мікрочастинок. Тому стадії фільтрування зазвичай передує попередня обробка суспензій з метою максимально можливої коагуляції клітин і домішок в більші частинки, що легко фільтруються. Застосовуються кілька видів коагуляції: теплова, органічними і неорганічними кислотами, неорганічними сольовими електролітами. У процесах виділення бактеріоцину неможливо використовувати коагуляцію, оскільки є висока ймовірність значного зниження активності антимікробних пептидів, а фільтрування культуральної рідини на вакуум-фільтрах без попередньої обробки є економічно невигідним, громіздким та неефективним процесом, оскільки відбувається закупорювання пор у фільтрі
[71, 81].
Для відділення клітин від культуральної рідини використовують також флотацію. Застосування даного способу для відділення клітин продуцента (Е. faecium DSH20) та індуктора (L. plantarum 1 LVP7) від культуральної рідини є недоцільним, оскільки він призначений для згущення більших і важчих клітин дріжджів і мікроміцетів. Крім того, ступінь очищення культуральної рідини від клітин за допомогою даного способу невисокий, що унеможливлює його використання у технології отримання препарату на основі бактеріоцину [81].
Найбільш доцільним у технології виробництва бактеріоцинів є застосування методу центрифугування. Центрифугування – осадження зважених в рідині частинок із застосуванням відцентрової сили. Даний метод потребує більш дорогого устаткування, ніж фільтрування. Тому він виправдовує себе, якщо: а) суспензія фільтрується повільно; б) поставлене завдання максимального звільнення культуральної рідини від клітин; в) необхідно налагодити безперервний процес сепарації в умовах , коли фільтри розраховані тільки на періодичне дію [77, 81].
Центрифугування і фільтрація іноді реалізуються в комбінації, у фільтраційних центрифугах. Перспективні для осадження біомаси центрифуги-сеператори, в яких біомаса осідає на стінках циліндра, що обертається. Даний метод найбільш доцільний для реалізації процесу відділення біомаси від культуральної рідини у виробництві препарату на основі бактеріоцину, оскільки відсутній негативний вплив фізичних та хімічних факторів на активність антимікробного пептиду, а також здійснюється максимальне звільнення від клітин продуцента та індуктора синтезу [81].
Залежно від локалізації цільового продукту наступні стадії виділення приблизно такі:
Внутрішньоклітинний цільовий продукт: дезінтеграція клітин,
виділення цільового продукту з дезінтеграту (видалення уламків клітин, екстракція, осадження, концентрування, кристалізація тощо), сушіння.
Позаклітинний цільовий продукт: попередня обробка супернатанту
(за потреби), виділення цільового продукту з супернатанту (екстракція, осадження, концентрування, кристалізація тощо), сушіння.
27
Зверніть увагу! У даному підрозділі викладення матеріалу має бути за принципом «не як, а чому» (не описувати способи реалізації певної стадії, а акцентувати увагу на причини вибору однієї з них).
Приклад 18. Обґрунтування вибору способу дезінтеграції дріжджових клітин.
Злітератури відомі такі способи обробки клітин, що містять ергостерин:
1.Обробка клітин гідроксидом калію при кип’ятінні [45, 46]. Недоліками цього методу є низький вихід цільового продукту, довга тривалість сольволізу (не менше 6 год) та необхідність фільтрації від неомиленних залишків дріжджів;
2.Обробка дріжджових клітин гідроксидом калію та 60 %-м розчином етанолу при температурі 80 ºС упродовж 2 годин [24]. Недоліками є велика витрата етилового спирту, необхідність його ректифікації та підтримка сталої температури;
3.Гідроліз клітин продуцента соляною кислотою при температурі 110 ºС та потім етанолом при температурі 75–78 ºС [30, 11]. Недоліки: дуже затратний та економічно невигідний процес, що потребує великої кількості реагентів та часу, соляна кислота – екологічно небезпечна речовина;
4.Сольволіз біомаси сумішшю, що містить 25–50 % ізопропілового спирту, 15–50 % води та 25–35 % їдкого натру при 4-х годинному кип’ятінні (не більше 80 ºС [47]) та постійному перемішуванні [48].
Переваги цього методу:
продукт містить 88 – 92 % ергостерину;
застосування такої суміші дає змогу, на відміну від використання етилового спирту, створити двофазну систему, що дозволяє виключити стадію фільтрації і втрати ергостерину;
на відміну від використання вищих спиртів, наприклад бутилового, дана суміш унеможливлює емульгування і піноутворення.
Отже, використовуємо останній спосіб дезінтеграції дріжджових клітин, що містять ергостерин, оскільки він має суттєвих переваг перед іншими наведеними способами [48].
Для проведення дезінтеграції клітин використовуємо збірник, оснащений мішалкою, для постійного перемішування, та рубашкою, для подавання спочатку глухої пари, а потім холодної води. У цьому ж апараті буде здійснюватися і екстракція ергостерину з подальшим відстоюванням суміші. Тому об’єм збірника буде залежати від кількості біомаси (≈ 106 кг) та кількості використовуваного розчинника (≈ 21 л суміші та 70 л технічного ізопропанолу) [48]
істановитиме 250 л (збірник з запасом та коефіцієнтом заповнення 0,8). Чим інтенсивніше буде проходити процес змішування фаз, тим продуктивнішим є сольволіз та екстрагування. Проте для ефективного процесу достатньо швидкості перемішування не більше 200 об/хв.
Приклад 19. Обґрунтування вибору способу екстракції ергостерину.
Злітератури відомі такі способи екстракції ергостерину:
1.Екстракція дихлоретаном або бензолом [45]. Недоліком цього методу є токсичність реагентів;
2.Вилучення за допомогою петролейного ефіру [24]. Недоліком є застосування цього методу тільки в лабораторних умовах через високу вартість ефіру (62 грн/кг);
3.Екстракція етанолом [46, 30, 11]. Недоліки: велика витрата етилового спирту, необхідність його ректифікації та низький вихід ергостерину;
4.Додавання технічного ізопропілового спирту або його відгону [48].
Переваги цього методу:
як розчинник на стадії екстракції може використовуватися як товарний ізопропіловий спирт, так і його суміш з відгоном, отриманим після сольволізу (містить 80 – 84 % ізопропанолу);
28

застосування для екстракції відгону ізопропанолу спрощує технологічний процес і підвищує вихід ергостерину до 85 – 90 %;
зниження вартості цільового продукту.
Отже, використовуємо останній спосіб екстракції ергостерину, адже він має велику кількість суттєвих переваг над іншими наведеними способами [48].
Охолоджену суміш дезінтегрованої біомаси та водно-спиртового розчину екстрагують технічним ізопропанолом з розрахунку 0,6 об’ємів спирту на 1 об’єм вихідної (до дезінтеграції) біомаси дріжджів. Замість технічного ізопропанолу можуть використовувати його відгін або суміш технічного ізопропанолу та відгону (1:1). При цьому збільшується вихід та вміст ергостерину (89 %, 91 % та 90 %, 92,2 % відповідно) [48].
Приклад 20. Вибір способу проведення екстракції рифампіцину та відповідного обладнання.
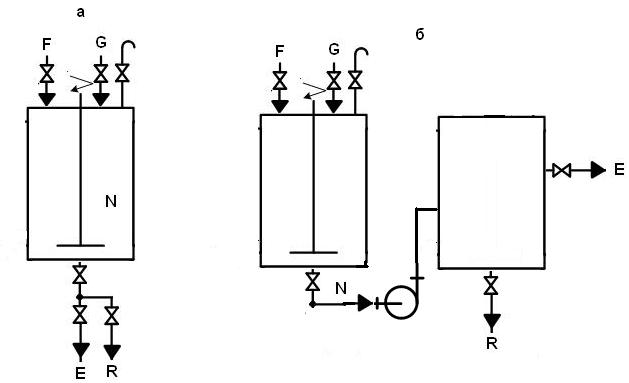
Екстракція буває однота багатоступеневою [26]. Враховуючи вартість і кількість розчинника (13 м3 етилацетату на одну екстракцію антибіотика з супернатанту культуральної рідини), доцільніше проводити одноразову екстракцію, що суттєво знизить вартість цільового продукту. Ефективність одноступеневої екстракції підвищується за рахунок встановленого в екстракторі перемішуючого пристрою. Зазначимо, що під час екстракції передбачається контроль вмісту рифаміцину у водній фазі і можливе коригування умов цього процесу (тривалість екстракції, швидкість перемішування тощо) залежно від одержаних результатів.
Одноступенева екстракція поділяється на періодичну і безперервну [26]. Обидва варіанти зображені на рис. 5.2.
Безперервний спосіб забезпечує вищу швидкість процесу та можливість використання невеликих за розміром апаратів, проте періодичний спосіб є більш простим та ефективним. До того ж, застосувати на практиці безперервний спосіб екстракції є складним завданням через неможливість ефективного протікання процесу відстоювання і розшарування систем, тому процес екстракції необхідно проводити одноступеневим періодичним способом [26,
27].
Отже, для здійснення одноступеневої екстракції можна використовувати один апарат з перемішуючим пристроєм. Об’єм екстрактора повинен дорівнювати сумі об’єму супернатанту, що містить антибіотик, та розчинника з урахуванням запасу (коефіцієнт заповнення 0,8), тобто (13,5+13,5)/0,8 ≈ 35 м3. Після розділення органічний екстракт міститься у верхній фазі, а водна фаза – у нижній. Після завершення процесу водна фаза зливається першою (R, як зображено на рис. 5.2), після чого через інший трубопровід органічний екстракт подається до збірника [26].
Приклад 21. Вибір способу концентрування рифампіцину та відповідного обладнання.
Існують два основні способи концентрування речовин − фільтрація, до якої відносять ультрафільтрацію, зворотній осмос, тощо, та упарювання розчинів. Застосування фільтрації в даному випадку не є доцільним через високу вартість процесу, низьку швидкість та відносно низьку ефективність. Натомість процес випарювання є доцільним через свою простоту, швидкість, ефективність та легкість випарювання органічного розчинника. Існує три види випарювання [26]:
під надлишковим тиском; при атмосферному тиску; під вакуумом.
При використанні вакуумного способу знижується температура кипіння розчину, що дозволяє ефективно проводити видалення вологи з розчинів термолабільних речовин.
Найбільше поширення в промисловості отримали випарні апарати, які нагріваються
29
водяною парою, оскільки водяній парі притаманна висока питома теплота конденсації й високий коефіцієнт тепловіддачі [26, 32].
Вакуум-випарні установки класифікують за способом дії (безперервної і періодичної дії), за кількістю корпусів (одно- і багатокорпусні).
Використання багатокорпусних випарних апаратів має деякі переваги перед однокорпусними, проте дана технологія дозволяє використовувати більш прості випарні установки. Тому дешевше і доцільніше використовувати однокорпусний випарний апарат
[32].
На промислових підприємствах використовують два типи вакуум-випарних апаратів: вертикальні та горизонтальні. Найтиповішим є вертикальний апарат з центральною циркуляційною трубою (рис. 5.3).
Основним критерієм потужності випарних апаратів є їхня випарна спроможність – кількість випареного розчинника за годину. Потужність випарювачів залежить від об’єму випарної камери в ньому. На ринку представлені найбільші вакуум-випарні апарати з робочим об’ємом до 2 м3. Випарна потужність апарату даного типу досягає 2,5-2,8 м3/год.
Рис. 5.2. Схема одноступеневої екстракції, проведеної періодичним (а) або безперервним (б) способом: G – супернатант культуральної рідини, що подається на екстракцію; F – екстрагент; N суміш екстрагенту з супернатантом культуральної рідини; R – водна фаза; Е – екстракт цільового продукту.
Приклад 22. Вибір способу очищення та концентрування бактеріоцину.
Очищення бактеріоцину від домішок (баластних низькомолекулярних домішок та макрочастинок) зумовлене низкою технічних складностей, пов'язаних, в основному, з нестабільністю (лабільністю) ферментів, втратою активності під впливом незначних змін зовнішніх умов. Тому при виборі технології концентрування і очищення ферментних препаратів шукають рішення, що дозволяють здійснювати ці процеси в безперервному режимі, з високою швидкістю, в "м'яких" умовах і забезпечують максимальне зневоднення утворюваного концентрату [34].
30
