- •Конспект лекцій з дисципліни “Фізика”
- •Частина 1
- •Фізика Конспект лекцій
- •6.050801 “Мікро- та наноелектроніка”,
- •6.050802 “Електронні пристрої та системи”,
- •6.050701 “Електротехніка та електротехнології”,
- •6.050201 “Системна інженерія”
- •Частина 1
- •Передмова
- •Розділ 1 Фізичні основи класичної механіки Тема 1 Кінематика §1 Простір і час. Система відліку. Матеріальна точка. Радіус-вектор. Траєкторія, шлях, переміщення [7]
- •§2 Середня й миттєва швидкість. Визначення переміщення і шляху тіла за його швидкістю [4]
- •§3 Прискорення. Визначення швидкості тіла за його прискоренням. Швидкість та координати тіла під час рівноприскореного руху [1]
- •§4 Тангенціальне й нормальне прискорення. Радіус кривизни [1]
- •§5 Вектор кутового зміщення. Кутові швидкість і прискорення. Зв’язок між кутовими й лінійними величинами [1]
- •Тема 2 Динаміка матеріальної точки §6 Перший закон Ньютона. Інерціальні системи відліку [12]
- •§7 Інертність. Маса. Сила. Другий закон Ньютона [7]
- •§8 Третій закон Ньютона. Приклади, що ілюструють третій закон Ньютона [4]
- •§9 Одиниці вимірювань фізичних величин. Основні й похідні одиниці вимірювань. Розмірність [4,13]
- •§10 Закон всесвітнього тяжіння. Сила тяжіння і вага тіла. Вага тіла, що рухається з прискоренням [4]
- •§11 Сила тертя спокою, коефіцієнт тертя спокою. Сила тертя ковзання, коефіцієнт тертя ковзання [4]
- •§12 Сила пружності. Закон Гука. Розтягування і стискування стержнів, модуль Юнга [4]
- •Тема 3 Закони збереження §13 Закон збереження імпульсу для системи матеріальних точок [4]
- •§14 Центр мас системи матеріальних точок. Швидкість і прискорення центра мас [4]
- •§15 Робота змінної сили. Теорема про кінетичну енергію для системи матеріальних точок [7]
- •§16 Робота сили тяжіння, сили всесвітнього тяжіння, сили пружності. Консервативні сили [4,7]
- •§17 Потенціальна енергія. Взаємний зв’язок потенціальної енергії і консервативної сили [4,7]
- •§18 Повна механічна енергія системи матеріальних точок. Закон збереження повної механічної енергії для системи матеріальних точок. Робота неконсервативних сил [4]
- •§19 Зіткнення тіл. Швидкості тіл після центрального абсолютно пружного та абсолютно непружного ударів [4]
- •Тема 4 Тверде тіло в механіці §20 Момент сили і момент імпульсу. Рівняння моментів для матеріальної точки [7]
- •§21 Рівняння моментів для системи матеріальних точок. Закон збереження моменту імпульсу [1]
- •§22 Швидкість довільної точки твердого тіла під час його плоского руху. Кутова швидкість обертання твердого тіла. Миттєва вісь обертання [4]
- •§23 Рух центра мас твердого тіла. Прискорення центра мас твердого тіла [4]
- •§24 Обертання твердого тіла навколо нерухомої осі. Рівняння динаміки обертального руху відносно нерухомої осі [4]
- •§25 Момент інерції циліндра (диска) відносно осі симетрії [4]
- •§26 Момент інерції стержня [4]
- •§27 Теорема Гюйгенса-Штейнера [7]
- •§28 Робота тіла, що обертається навколо нерухомої осі [4]
- •§29 Кінетична енергія твердого тіла за умови плоского руху [4]
- •§30 Рівняння руху і рівноваги твердого тіла. Прискорення циліндра, який котиться без ковзання з похилої площини [1,7]
- •Тема 5 Неінерційні системи відліку §31 Неінерціальні системи відліку. Сили інерції. Поступальна сила інерції [7]
- •§32 Відцентрова сила інерції [4]
- •§33 Сила Коріоліса [4]
- •Тема 6 Механіка рідин §34 Методи Лагранжа та Ейлера для опису течії рідини. Трубка течії [4,14]
- •§35 Теорема про нерозривність потоку [4]
- •§36 Рівняння Бернуллі [4]
- •§37 Витікання рідини з малого отвору. Формула Торрічеллі [4]
- •§38 Сила внутрішнього тертя. Формула Ньютона для сили внутрішнього тертя. В’язкість. Ламінарна і турбулентна течія рідини. Число Рейнольдса [1]
- •§39 Рух тіл у рідинах та газах. Сила лобового опору. Піднімальна сила. Парадокс д’Аламбера. Вплив в’язкості на характер обтікання тіла рідиною. Сила Стокса [4]
- •Тема 7 Елементи спеціальної теорії відносності §40 Принцип відносності Галілея. Перетворення Галілея [4]
- •§41 Постулати спеціальної теорії відносності. Відносність одночасності [4,7]
- •§42 Перетворення Лоренца [4]
- •§43 Перетворення швидкостей у спеціальній теорії відносності [4]
- •§44 Лоренцеве скорочення довжини [4]
- •§45 Релятивістське уповільнення ходу часу [4]
- •§46 Інтервал і його інваріантність. Швидкість світла як гранична швидкість поширення довільного сигналу [4]
- •§47 Закон збереження імпульсу в спеціальній теорії відносності. Релятивістське рівняння динаміки [4]
- •§48 Кінетична енергія в спеціальній теорії відносності [4]
- •§49 Енергія спокою. Повна енергія. Взаємозв'язок маси й енергії спокою [4]
- •Розділ 2 Основи молекулярної фізики і термодинаміки Тема 8 Макроскопічний стан §50 Статистичний і термодинамічний підходи до вивчення теплових властивостей макроскопічних тіл [4]
- •§51 Термодинамічна система. Параметри стану системи. Рівноважні та нерівноважні стани. Термодинамічний процес. Квазистатичний процес [4]
- •§52 Температура. Термометр. Загальний (нульовий) закон термодинаміки. Основна властивість температури. Шкала температур Цельсія. Абсолютна температура [8]
- •§53 Основні положення молекулярно-кінетичної теорії речовини. Броунівський рух [4,15]
- •§54 Рівняння стану термодинамічної системи. Рівняння стану ідеального газу як результат узагальнення експериментальних досліджень [4]
- •§55 Барометрична формула [4]
- •§56 Тиск ідеального газу з точки зору молекулярно-кінетичної теорії [8]
- •§57 Молекулярно-кінетичний зміст абсолютної температури [4]
- •§58 Ступені вільності механічної системи. Теорема про рівномірний розподіл кінетичної енергії за ступенями вільності. Середня енергія молекули [4]
- •Тема 9 Перший закон термодинаміки §59 Внутрішня енергія термодинамічної системи [4]
- •§60 Робота, що виконується тілом при змінах його об'єму [4,8]
- •§61 Кількість теплоти. Перший закон термодинаміки. Вічний двигун першого роду [8]
- •§62 Теплоємність. Питома й молярна теплоємність. Теплоємність при постійному тиску, при постійному об'ємі. Внутрішня енергія ідеального газу. Рівняння Майєра. Стала адіабати [4]
- •§63 Рівняння адіабати ідеального газу [4]
- •§64 Політропічні процеси. Показник політропи. Рівняння політропи [4]
- •§65 Робота, що виконується газом при ізопроцесах [4]
- •§66 Класична теорія теплоємності ідеального газу [4]
- •Тема 10 Другий закон термодинаміки §67 Будова і принцип дії теплової машини. Коефіцієнт корисної дії теплової машини [8]
- •§68 Вічний двигун другого роду. Другий закон термодинаміки. Формулювання другого закону термодинаміки Томсона і Клаузіуса [8]
- •§69 Оборотні і необоротні процеси. Цикл Карно. Перша і друга теореми Карно [8]
- •§70 Нерівність і рівність Клаузіуса. Ентропія. Закон зростання ентропії [8]
- •§71 Ентропія ідеального газу [8]
- •Тема 11 Статистичні розподіли §72 Функція розподілу ймовірності. Функції розподілу молекул за швидкостями Максвелла [4,8]
- •§73 Середні швидкості молекул. Число ударів молекул об одиничну поверхню за одиницю часу [8]
- •§74 Розподіл Больцмана [4]
- •Тема 12 Явища перенесення §75 Довжина вільного пробігу молекул [8]
- •§76 Емпіричні рівняння, що описують дифузію, теплопровідність, внутрішнє тертя. Якісне пояснення явищ перенесення в газах [4]
- •Тема 13 Реальні гази та рідкий стан §77 Реальні гази. Рівняння Ван-дер-Ваальса [4,8]
- •§78 Ізотерми Ван-дер-Ваальсівського газу. Критичні температура, тиск, об'єм і їх зв'язок із сталими Ван-дер-Ваальса [4]
- •§79 Експериментальні ізотерми [4]
- •§80 Фаза в термодинаміці. Фазове перетворення першого і другого роду. Приклади фазових перетворень. Діаграма станів [4]
- •§81 Будова рідин. Поверхневий натяг рідин. Коефіцієнт поверхневого натягу. Крайовий кут [4]
- •§82 Формула Лапласа. Капілярні явища. Висота піднімання й опускання рідини в капілярах [4]
- •Розділ 3 Електрика Тема 14 Електричне поле у вакуумі §83 Явище електризації. Електричний заряд. Елементарний електричний заряд. Дискретність заряду. Закон збереження електричного заряду [5,16]
- •§84 Закон Кулона. Принцип суперпозиції електричних сил. Одиниці вимірювання заряду [5]
- •§85 Електричне поле. Напруженість електричного поля. Напруженість електричного поля точкового заряду. Принцип суперпозиції електричних полів [5]
- •§87 Зв’язок між напруженістю електростатичного поля і потенціалом. Силові лінії та еквіпотенціальні поверхні. Перпендикулярність силових ліній і еквіпотенціальних поверхонь [5]
- •§88 Поле електричного диполя [5]
- •§89 Потік вектора. Теорема Гаусса для вектора напруженості електричного поля [9]
- •§90 Напруженість електричного поля нескінченної однорідно зарядженої пластини [2]
- •§91 Напруженість електричного поля однорідно зарядженої циліндричної поверхні [2]
- •§92 Напруженість електричного поля об’ємно зарядженої кулі [2]
- •§93 Диференціальна форма електростатичної теореми Гаусса. Значення теореми Гаусса в теорії електрики [9]
- •Тема 15 Електричне поле у діелектриках §94 Поляризація діелектриків. Зв’язані заряди. Механізми поляризації [9]
- •§95 Вектор поляризації. Поверхнева густина зв’язаних зарядів. Зв’язаний заряд усередині діелектрика [9]
- •§96 Вектор електричної індукції. Теорема Гаусса для діелектриків [9]
- •§97 Поляризованість і діелектрична проникність [9]
- •§98 Умови на межі поділу двох діелектриків [17]
- •Тема 16 Провідники в електричному полі §100 Умови рівноваги зарядів на провіднику. Електричне поле усередині провідника. Напруженість електричного поля біля поверхні провідника [9]
- •§101 Електроємність відокремленого провідника. Ємність кулі [5]
- •§102 Конденсатор. Ємність конденсатора. Ємність плоского і циліндричного конденсатора. Ємність системи, що складається з послідовно та паралельно з’єднаних конденсаторів [5]
- •Тема 17 Енергія електричного поля §103 Енергія системи точкових зарядів [5]
- •§104 Енергія зарядженого провідника. Енергія зарядженого конденсатора [5]
- •§105 Енергія електричного поля [5]
- •Тема 18 Постійний електричний струм §106 Електричний струм. Густина електричного струму з мікроскопічної точки зору. Рівняння неперервності для електричного заряду [5,9]
- •§107 Сторонні сили. Електрорушійна сила. Робота над електричним зарядом на ділянці кола [5]
- •§108 Закон Ома для однорідної ділянки кола. Залежність опору від геометричних розмірів провідника. Закон Ома в диференціальній формі. Провідність [5]
- •§109 Закон Ома для неоднорідної ділянки кола в диференціальній і інтегральній формі. Закон Ома для замкненого кола [5]
- •§110 Правила Кірхгофа [5]
- •§111 Потужність струму. Закон Джоуля-Ленца в інтегральній і диференціальній формі [5]
- •§112 Процеси встановлення струму під час заряду і розряду конденсатора [9]
- •§113 Природа носіїв струму в металах. Дослід Рікке. Ідея Лоренца визначення відношення заряду до маси носія електричного струму в металах. Дослід Толмена і Стюарта [2]
- •§115 Електричний струм у газах. Процеси, що приводять до виникнення носіїв струму при самостійному газовому розряді. Самостійний та несамостійний розряди [5]
- •Список літератури
- •Предметний покажчик
- •Фізика Конспект лекцій
- •Частина 1
§71 Ентропія ідеального газу [8]
1. Обчислимо зміну ентропії ідеального газу. Спочатку розглянемо один моль речовини. Для будь-якого нескінченно малого квазистатичного процесу для ідеального газу згідно з першим законом термодинаміки можемо записати
![]() .
.
Тут
використали, що
![]() (індекс «
»
показує, що величина характеризує один
моль речовини) та у відповідності до
рівняння Менделєєва-Клапейрона для
одного моля газу
(індекс «
»
показує, що величина характеризує один
моль речовини) та у відповідності до
рівняння Менделєєва-Клапейрона для
одного моля газу
![]() .
Далі згідно до визначення ентропії
.
Далі згідно до визначення ентропії
![]() .
.
Теплоємність
ідеального газу
![]() не залежить від температури. Тоді
не залежить від температури. Тоді
![]() . (71.1)
. (71.1)
Якщо газ містить
![]() молей, то зміну ентропії для цієї
кількості газу знайдемо, помноживши
(71.1) на
(ентропія адитивна величина),
молей, то зміну ентропії для цієї
кількості газу знайдемо, помноживши
(71.1) на
(ентропія адитивна величина),
![]() . (71.2)
. (71.2)
Потрібно мати на увазі, що цей вираз був отриманий у припущенні, що число молекул у газі залишається сталим.
2. Коли квазистатичний
процес є адіабатним, то
,
а отже,
![]() .
Таким чином, будь-який квазистатичний
адіабатичний процес є процес, що
відбувається при сталій ентропії. Тому
його можна також назвати ізоентропійним
процесом.
.
Таким чином, будь-який квазистатичний
адіабатичний процес є процес, що
відбувається при сталій ентропії. Тому
його можна також назвати ізоентропійним
процесом.
Тема 11 Статистичні розподіли §72 Функція розподілу ймовірності. Функції розподілу молекул за швидкостями Максвелла [4,8]
Розглянемо ряд питань з теорії ймовірності. Вони будуть нам потрібними при вивченні елементів статистичної фізики.
1. Нехай деяка величина може набувати ряд дискретних значень:
![]()
Якщо
провести
вимірів величини
,
то виявиться, що величина
набуває значення
![]()
![]() раз, значення
раз, значення
![]() –
–
![]() раз, …, значення
раз, …, значення
![]() –
–
![]() раз і т.д. Зрозуміло, що
раз і т.д. Зрозуміло, що
![]() .
Величина
.
Величина
![]() за умови, що
за умови, що
![]() (72.1)
(72.1)
називається ймовірністю того, що величина має значення .
Ймовірність має таку властивість
 . (72.2)
. (72.2)
Тут
використали, що
![]() .
Таким чином, сума ймовірностей всіх
можливих значень величини
дорівнює одиниці. Про цю властивість
говорять як про умову нормування.
.
Таким чином, сума ймовірностей всіх
можливих значень величини
дорівнює одиниці. Про цю властивість
говорять як про умову нормування.
2. Знайдемо,
використовуючи поняття ймовірності,
середнє значення величини
.
Згідно до визначення середнє значення
![]() знаходимо як суму усіх результатів
експериментів, що поділена на кількість
експериментів
знаходимо як суму усіх результатів
експериментів, що поділена на кількість
експериментів
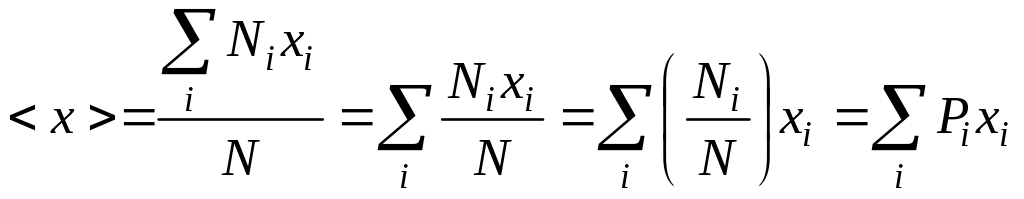 .
.
Тут взяли
до уваги, що величина
![]() під час вимірів з’являлася
під час вимірів з’являлася
![]() раз. Таким чином, середнє значення
величини
знаходимо за допомогою співвідношення
раз. Таким чином, середнє значення
величини
знаходимо за допомогою співвідношення
![]() . (72.3)
. (72.3)
Отримана нами формула дозволяє, знаючи ймовірності різних величин , знайти середнє значення цієї величини.
Розглянемо деяку
функцію
![]() ,
аргументом у якої є величина
.
Будемо вважати, що ймовірність
,
аргументом у якої є величина
.
Будемо вважати, що ймовірність
![]() того, що величина
набуде значення
нам відома. Тоді середнє значення
функції
того, що величина
набуде значення
нам відома. Тоді середнє значення
функції
![]() ,
як це отримано в теорії ймовірності,
визначається за допомогою співвідношення
,
як це отримано в теорії ймовірності,
визначається за допомогою співвідношення
![]() . (72.4)
. (72.4)
Бачимо, що формули (72.3) та (72.4) подібні.
3. Тепер розглянемо
випадок, коли величина
може набувати неперервний ряд значень
від
до
(зокрема,
і
можуть дорівнювати
![]() й
й
![]() ).
Прикладами таких величин можуть служити
модуль поступальної швидкості або
кінетична енергія молекули. У цьому
випадку число можливих значень
нескінченно велике, а кількість молекул
хоча й дуже велика, але скінченна. Тому
питання про те, яка кількість молекул
має точно задане значення величини
не має змісту, ця кількість дорівнює
нулю.
).
Прикладами таких величин можуть служити
модуль поступальної швидкості або
кінетична енергія молекули. У цьому
випадку число можливих значень
нескінченно велике, а кількість молекул
хоча й дуже велика, але скінченна. Тому
питання про те, яка кількість молекул
має точно задане значення величини
не має змісту, ця кількість дорівнює
нулю.
У розглянутому випадку
правомірним є питання про те, яка
ймовірність
![]() того, що величина
має значення, які належать малому
інтервалу
того, що величина
має значення, які належать малому
інтервалу
![]() .
Зрозуміло, що при малому
ця ймовірність буде пропорційною
.
Крім того, вона повинна в загальному
випадку залежати від того, у якому місці
осі
розміщений цей інтервал, тобто є функцією
.
Таким чином,
.
Зрозуміло, що при малому
ця ймовірність буде пропорційною
.
Крім того, вона повинна в загальному
випадку залежати від того, у якому місці
осі
розміщений цей інтервал, тобто є функцією
.
Таким чином,
![]() . (72.5)
. (72.5)
Тут індекс
біля
![]() вказує на значення
,
біля якого розміщений інтервал шириною
.
Функція
,
що входить у формулу (72.5), називається
функцією розподілу ймовірності
або густиною ймовірності .
вказує на значення
,
біля якого розміщений інтервал шириною
.
Функція
,
що входить у формулу (72.5), називається
функцією розподілу ймовірності
або густиною ймовірності .
Помноживши
на повне число молекул
,
отримаємо кількість молекул
![]() ,
що мають значення
,
яке знаходяться в межах інтервалу
:
,
що мають значення
,
яке знаходяться в межах інтервалу
:
![]() . (72.6)
. (72.6)
Інтеграл від , узятий по всім можливим значенням (тобто «сума» ), повинен дорівнювати повному числу молекул :
![]() .
.
Звідси випливає, що
![]() . (72.7)
. (72.7)
Формула (72.7) є аналогом формули (72.2) і її також називають умовою нормування.
4. Вираз
![]() дає суму значень
,
яку мають
молекул, а «сума» таких виразів, тобто
дає суму значень
,
яку мають
молекул, а «сума» таких виразів, тобто
![]() , (72.8)
, (72.8)
дає суму значень всіх молекул. Розділивши цю суму на , отримаємо середнє (за всіма молекулами) значення величини :
![]() . (72.9)
. (72.9)
Ця формула є аналогом формули (72.3).
Підставивши у формулу
(72.9) замість
деяку функцію цієї величини
![]() ,
прийдемо до формули
,
прийдемо до формули
![]() , (72.10)
, (72.10)
яка дозволяє знайти середнє значення
довільної функції
![]() за відомою густиною ймовірності
за відомою густиною ймовірності
![]() .
За допомогою цієї формули можна обчислити,
наприклад, середнє значення
.
За допомогою цієї формули можна обчислити,
наприклад, середнє значення
![]() :
:
![]() . (72.11)
. (72.11)
5. Розглянемо ідеальний газ, який знаходиться у стані теплової рівноваги. Ми знаємо, що в цьому випадку молекули газу рухаються хаотично. Тобто різні молекули мають різні швидкості як за напрямком, так і за модулем. При цьому з часом через зіткнення ці швидкості змінюються. Поставимо перед собою задачу: описати розподіл молекул за швидкостями.
Для того, щоб розв’язати
поставлену задачу скористаємося таким
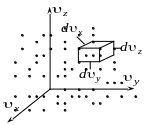
прийомом. Уведемо уявний простір
швидкостей (
-простір),
у якому будемо відкладати уздовж
прямокутних координатних осей значення
компонент швидкостей
![]() окремих молекул (рис. 72.1). Тоді кожній
молекулі буде відповідати у просторі
швидкостей точка.
окремих молекул (рис. 72.1). Тоді кожній
молекулі буде відповідати у просторі
швидкостей точка.
Визначимо кількість
молекул
![]() ,
компоненти швидкості
яких лежать в інтервалі
,
компоненти швидкості
яких лежать в інтервалі
![]() .
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малій
.
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малій
![]() ця кількість буде пропорційною ширині
інтервалу
.
Крім того,
повинна в загальному випадку залежати
і від величини швидкості
.
Узагальнюючи сказане вище, можемо
записати
ця кількість буде пропорційною ширині
інтервалу
.
Крім того,
повинна в загальному випадку залежати
і від величини швидкості
.
Узагальнюючи сказане вище, можемо
записати
![]() . (72.12)
. (72.12)
|
Рисунок 72.1 |
![]() . (72.13)
. (72.13)
Порівнюючи
формулу (72.13) з (72.5), можемо стверджувати,
що
![]() є густиною ймовірності розподілу молекул
за компонентою швидкості
.
є густиною ймовірності розподілу молекул
за компонентою швидкості
.
Визначимо кількість
молекул
![]() ,
модулі швидкості
яких лежать в інтервалі
,
модулі швидкості
яких лежать в інтервалі
![]() .
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малій
ця кількість буде пропорційною ширині
інтервалу
.
Крім того,
повинна в загальному випадку залежати
і від величини модуля швидкості
.
У результаті отримуємо
.
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малій
ця кількість буде пропорційною ширині
інтервалу
.
Крім того,
повинна в загальному випадку залежати
і від величини модуля швидкості
.
У результаті отримуємо
![]() . (72.14)
. (72.14)
Формулу
(72.14) визначає функція
![]() ,
яка називається функцією розподілу
молекул за абсолютними значеннями
швидкостей
.
Як і в попередньому випадку, неважко
показати, що ця функція є густиною
ймовірності розподілу молекул за
абсолютними значеннями швидкостей
молекул
.
,
яка називається функцією розподілу
молекул за абсолютними значеннями
швидкостей
.
Як і в попередньому випадку, неважко
показати, що ця функція є густиною
ймовірності розподілу молекул за
абсолютними значеннями швидкостей
молекул
.
Визначимо кількість
молекул
![]() ,
компоненти швидкостей
,
,
компоненти швидкостей
,
![]() ,
,
![]() яких лежать в інтервалах
яких лежать в інтервалах
![]() ,
,
![]() ,
,
![]() .
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малих
.
Зрозуміло, що
буде залежати прямо пропорційно від
загальної кількості молекул
.
При малих
![]() ця кількість буде пропорційною об’єму
у просторі швидкостей
ця кількість буде пропорційною об’єму
у просторі швидкостей
![]() (див. рис. 72.1). Крім того,
повинна в загальному випадку залежати
і від значень компонент швидкостей
,
,
.
Таким чином, отримуємо
(див. рис. 72.1). Крім того,
повинна в загальному випадку залежати
і від значень компонент швидкостей
,
,
.
Таким чином, отримуємо
![]() . (72.15)
. (72.15)
Формулу
(72.15) визначає функція
![]() ,
яка називається функцією розподілу
молекул за компонентами швидкостей
,
,
.
Ця функція є густиною ймовірності
розподілу молекул за компонентами
швидкостей молекул
,
,
.
,
яка називається функцією розподілу
молекул за компонентами швидкостей
,
,
.
Ця функція є густиною ймовірності
розподілу молекул за компонентами
швидкостей молекул
,
,
.
Таким чином, задача опису молекул газу у стані теплової рівноваги зводиться до пошуку функцій , , , які називаються функціями розподілу молекул за швидкостями Максвелла.
6. Вигляд функцій , , було встановлено Максвеллом. Для цього він використав рівноправність усіх напрямків руху та незалежність швидкостей , , . У результаті розрахунків було отримано
![]() , (72.16)
, (72.16)
![]() , (72.17)
, (72.17)
![]() . (72.18)
. (72.18)
Формули (72.16)–(72.18) називаються Максвеллівським розподілом молекул ідеального газу за швидкостями. У цих формулах – маса однієї молекули газу; – стала Больцмана; – абсолютна температура.