
- •Перечень сокращений
- •Раздел I. Организация генетического материала…………………… 12 Глава 1 . Генный уровень организации генетического материала ….12
- •Глава 2. Хромосомный уровень генетического материала…………40
- •Глава 3. Геномный уровень организации
- •Раздел II. Матричный синтез информационных макромолекул……. 97
- •Глава 4. Перенос генетической информации……………………… 97
- •Глава 5. Общий перенос информации……………………………. 101
- •Глава 6. Экспрессия генетического материала……………………. 129
- •Раздел I. Организация генетического материала
- •Глава 1. Генный уровень организации генетического материала
- •1.1. Классификация генов
- •1.2. Основные свойства гена
- •1.4. Структура генов прокариот
- •Транскрипции
- •Лидерная м-рнк uuuuuuuu- он 3′
- •1.5. Гены эукариотических организмов
- •1.5.1. Кластер генов гемоглобина
- •1.5.2. Кластер генов гистонов
- •1.5.3. Кластер рибосомных генов
- •Глава 2. Хромосомный уровень генетического материала
- •2.1. Хромосомы прокариот и вирусов
- •Льтате осмотического шока).
- •2.2. Хромосомы эукариот
- •2.2.1. Нуклесомная нить.
- •(Из: Клаг, 2009)
- •2.2.2. Наднуклеосомная укладка днк
- •Фибрилла – нуклеомер (Из: Жимулев.2007).
- •(Из: Фаллер, 2003)
- •2.2.3. Морфология метафазных хромосом
- •Уровни компактизации хроматина
- •2.2.4. Кариотип
- •Классификация хромосом согласно Денверовской классификации
- •2.2.5. Политенные хромосомы и хромосомы типа ламповых щеток
- •Глава 3. Геномный уровень организации наследственного
- •3.1. Геном вирусов
- •«Ламповых щеток» (Callan, 1941- из:Жимулев, 2007).
- •3.2. Геном прокариот
- •Размеры геномов прокариот
- •Состав сложных геномов бактерии
- •Тремя генами; б-сложный транспозон Тn10 с двумя
- •3.3. Геном эукариот
- •Размер геномов некоторых эукариот
- •7 Хромосомы человека и кукурузы (Из: Клаг,2009).
- •Количество и плотность генов в 5 отсеквенированных эукариотических геномах
- •3.3.1. Простые тандемные повторы (сателлиты).
- •3.3.2Диспергированные повторы
- •Классификация мобильных элементов.
- •Мобильные элементы
- •3.3.3. Геном цитоплазматических днк
- •3.3.4. Геном человека
- •Хромосомы 21 человека (Из: Клаг.2009).
- •Раздел II. Матричный синтез информационных макромолекул.
- •Глава 4. Перенос генетической информации
- •Глава 5. Общий перенос информации
- •5.1. Воспроизведение генетической информации. Репликация днк.
- •Параметры репликации днк у прокариот и эукариот (Из: Жимулев, 2007).
- •Включается в растущую цепь дочерней днк
- •5.1.1. Инициация репликации днк
- •5.1.4. Репликация теломерных отделов днк
- •5.1.5. Метилирование днк
- •Глава 6. Экспрессия генетического материала
- •6.1. Транскрипция днк (синтез рнк)
- •6.1.1.Транскрипция у прокариот
- •6.1.2. Транскрипция у эукариот
- •6.1.3. Процессинг пре-рнк
- •6.2. Принципы кодирования генетической информации Генетический код и его свойства
- •6.3. Трансляция мРнк
- •6.3.1.Структура и функции мРнк
- •6.3.2. Структура и функции тРнк
- •6.3.3. Структура и функции рРнк
- •4 Домена (Из: Коничев, 2003)
- •6.3.4. Рибосомы.
- •6.3.6. Активация аминокислот
- •3.3.7. Инициация трансляции
- •6.3.8. Элонгация трансляции
- •6.3.9. Терминация трансляции
- •Проверочные задания
- •2. Укажите какие из следующих утверждений правильные, а какие - нет. Если утверждение не верно, объясните почему.
- •3. Одна цепь участка днк, выделенной из е.Coli, имеет следующую последовательность оснований: 5′ gтаgсстасссатаgg 3′
- •Раздел II. Организация генетического материала
- •Глава 4. Генный уровень организации генетического материала
- •4.1. Классификация генов
- •4.2. Основные свойства гена
- •4.4. Структура генов прокариот
- •4.5. Гены эукариотических организмов
- •4.5.1. Кластер генов гемоглобина
- •4.5.2. Гены гистонов
- •4.5.3. Кластер рибосомных генов
- •Глава 5. Хромосомный уровень генетического материала
- •5.1. Хромосомы прокариот и вирусов
- •Льтате осмотического шока).
- •5.2. Хромосомы эукариот
- •(Из: Клаг, 2009)
- •5.2.1. Нуклесомная нить.
- •5.2.2. Наднуклеосомная укладка днк
- •Фибрилла – нуклеомер (Из: Жимулев.2007).
- •5.2.3. Морфология метафазных хромосом
- •Из: Жимулев, 2007).
- •Уровни компактизации хроматина
- •5.2.4. Кариотип
- •Классификация хромосом согласно Денверовской классификации
- •5.2.5. Политенные хромосомы и хромосомы типа ламповых щеток
- •Глава 6. Геномный уровень организации наследственного
- •2.3.1. Геном вирусов
- •«Ламповых щеток» (Callan, 1941- из:Жимулев, 2007).
- •2.3.2. Геном прокариот
- •Размеры геномов прокариот
- •Состав сложных геномов бактерии
- •(В тнп) кольцевой днк у е.Соli.
- •Тремя генами; б-сложный транспозон Тn10 с двумя
- •Характеристика некоторых транспозонов (Из: Айяла-Кайгер, 1988)
- •Антибиотикам: tеtr, саmr, kаnr, strr и аmpr; точками обозна- чены гены конъюгации,штриховкой – мобильные элемен-
- •2.3.3. Геном эукариот
- •Размер геномов некоторых эукариот
- •Количество и плотность генов в 5 отсеквенированных эукариотических геномах
- •2.3.3.1. Простые тандемные повторы (сателлиты).
- •2.3.3.2. Тандемно организованные кластеры генов
- •Классификация мобильных элементов.
- •2.3.3.3. Геном цитоплазматических днк.
- •2.3.3.4. Геном человека
- •Хромосомы 21 человека (Из: Клаг.2009).
4.4. Структура генов прокариот
Гены прокариот состоят из регулирующей и кодирующей частей. Регуляторная часть гена обеспечивает первые этапы реализации наследственной информации. К ней относится: промотор и терминатор (рис.86).
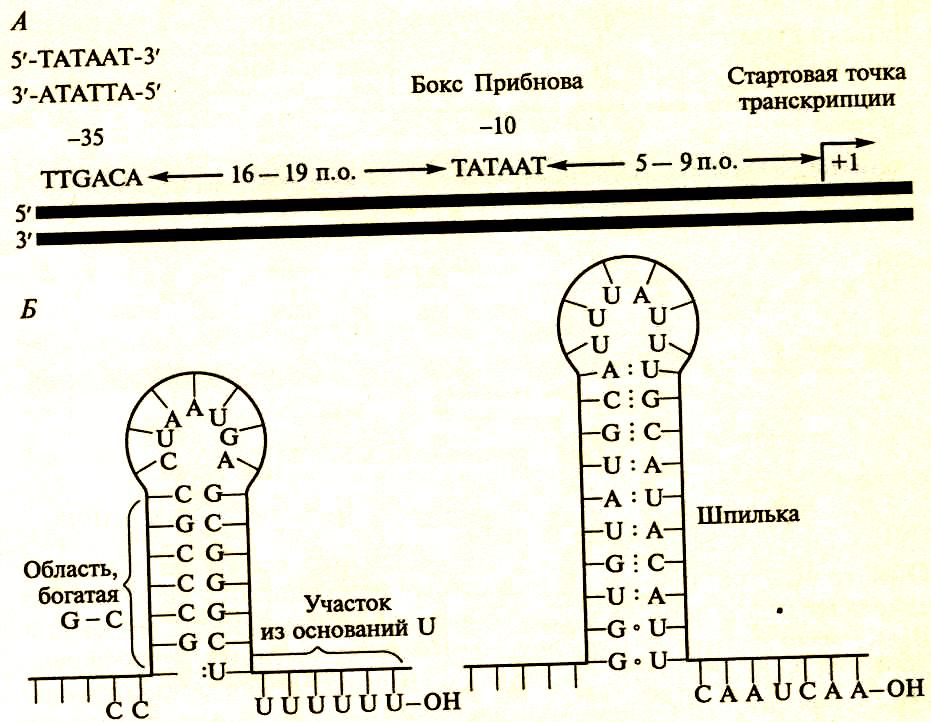
Рис.155. Структура промотора и терминатора прокариотических генов: А-промоторы; Б-терминаторные «шпильки».
Все последовательности левее стартовой точки транскрипции называется минус-последовательности, правее плюс-последовательности. Промотор (рис.86,А) находится на 5'-конце прокариотического гена и имеет две регуляторные последовательности: 1 – первая последовательность находится на расстоянии – 10 оснований от стартовой точки (+1) инициации и называется бокс (или ящик) Прибнова. В боксе Прибнова РНК-полимераза начинает раскручивание спирали ДНК и создает условие для начала синтеза РНК. Бокс Прибнова состоит из 6 нуклеотидов:
5' - Т А Т А А Т - 3'
3' - А Т А Т Т А - 5'
2 – вторая последовательность находится на расстоянии 35 нуклеотидов от стартовой точки, является участком связывания РНК-полимеразы и состоит из 6 нуклеотидов – ТТГТАЦА – и называется областью - 35. Расстояние между этими двумя последовательностями составляет 16-18 нуклеотидов, редко 15 или 20. Это расстояние зависит от формы молекулы РНК-полимеразы.
Транскрипционные терминаторы – это последовательности ДНК, являющиеся сигналами остановки транскрипции (стоп-сигналы). Они находятся на 3'-конце гена (рис.86,Б), содержат участки богатые – ГЦ – и - АТ – последовательностями, которые в синтезируемой и-РНК образуют вторичные структуры типа «шпилек» за счет формирования водородных связей между комплементарными – ГЦ- и –АТ- парами. Вслед за шпилькой на молекуле транскрибируемой и-РНК находится несколько остатков урацила, соответственно, в гене это последовательность А-А-А-А ….-А. Участок РНК, содержащий остатки урацила обеспечивает слабое связывание РНК с молекулой ДНК. Это и облегчает терминацию транскрипции. Промотор и терминатор не транскрибируется в РНК. Участок ДНК между промотором и терминатором (рис.87) называется транскриптон или единица транскрипции.
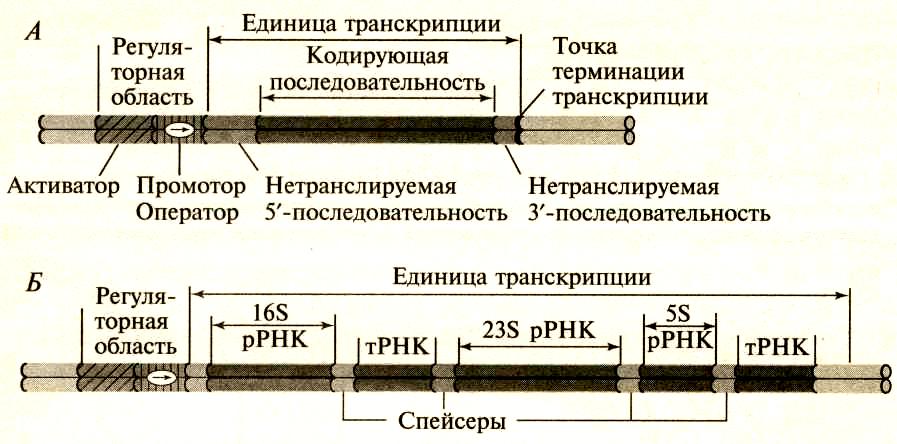
Рис.156. Транскриптон прокариот: А- ген, кодирующий один белок; Б - транскриптон, состоящий из генов р-РНК и т-РНК
В состав транскриптона входят кодирующая часть гена и два некодирующих участка: 5'- нетранслируемый последовательности (5'-НТП) и 3'- нетранслируемый последовательности (3'-НТП). Кодирующая часть гена состоит из последовательности нуклеотидов, несущих информацию о структуре белка. В процессе транскрипции именно кодирующая часть гена переписывается на молекулу РНК.
Гены всех видов прокариотических РНК (рис.87,Б) расположены в кодирующей части, но перемежаются спейсерами, которые после транскрипции будут вырезаны в ходе процессинга РНК.
Бактериям необходимо быстро реагировать на постоянно изменяющиеся условия среды. Их выживаемость зависит от способности переключать метаболизм с одного субстрата на другой. При этом они могут в любое время начинать синтез ферментов необходимых в данный момент. Для быстрого реагирования на меняющийся субстрат гены, кодирующие белки, одного и того же метаболического пути или определяющие родственные функции у прокариот объединены в кластеры, таким образом, что находятся под общим контролем, т.е. объединены в оперон (рис.88).
Оперон включает:
1 - кластер структурных генов, кодирующих ферменты, чьи функции связаны. Кластер (англ. cluster - скопление) – группа нескольких однородных элементов, которая может рассматриваться как самостоятельная единица, обладающая определенными свойствами;
2 –оператор - участок ДНК, расположенный перед кластером генов и связы- вающий белок-репрессор;
3 – промотор – участок ДНК, связывающий РНК-полимеразу.
Рис.157. Схема lас-оперона (Из: Клаг, 2009).
Белок репрессор кодируется специальным геном-регулятором, который в состав оперона не входит; он может регулировать один оперон или группу оперонов.
Принцип регуляции активности оперона основан на том, что белок-репрессор может включать или выключать транскрипцию кластерных генов, связываясь с оператором оперона. Способность связывания белка-репрессора с оператором зависит от наличия веществ цепи реакций, ферменты которой кодируются данным опероном. При этом различают два типа оперона: индуцибельные и репрессибельные. Индуцибельные опероны – это опероны, которые в отсутствии начального субстрата цепи контролирующих реакции репрессированы, и ферменты его метаболизма не синтезируется. Субстрат является индуктором, активизирующим оперон. Одним из таких оперонов является лактозный (lac) оперон, который регулирует синтез ферментов утилизации лактозы кишечной палочки E.coli. При появлении в клетке лактозы (индуктора) в клетке появляются ферменты его утилизации. Модель Lac-оперона была предложена в 60-х годах прошлого века Ф.Жакобом и Ж.Моно. Lac-оперон является моделью негативного контроля экспрессии и регуляции работы группы генов. В этом опероне происходит быстрое увеличение активности ферментов за счет их синтеза под действием субстрата. Такое увеличение активности ферментов называется индукцией.
Lac-оперон (рис.89) состоит из 3 структурных генов lac Z, lac Y и lac A, которые транскрибируются в одну полицистронную м-РНК, с которой транслируется одновременно три фермента, кодируемые этим опероном.
Лактоза – главный питательный дисахарид, на котором растут бактерии. Ген lac Z кодирует фермент -галактозидазу, расщепляющий лактозу на глюкозу и галактозу. Ген lac Y кодирует фермент пермеазу необходимый для
проникновения лактозы через клеточные мембраны. Ген lac A кодирует фермент трансацетилазу, функция которого в опероне не ясна. Промотор (рис.90) lac-оперона составляет 40 п.н., оператор 27 п.н. Lac-оперон регулируется геном lac Y, продукт которого белок-репрессор состоит из 4-х субъединиц, является гомотетрамером с двумя сайтами связывания: с оператором и лактозой.

Рис.158. Структурные гены lас-оперона (Из: Клаг,2009).
При достаточной концентрации глюкозы и в отсутствии лактозы белок-репрессор (рис.90,б) связывается с оператором оперона и блокирует присоединение РНК-полимеразы, фермента обеспечивающего транскрипцию. В этом случае транскрипция генов lac Z, lac Y и lac A не происходит; оперон репрессируется. Такая регуляция индуцибельного оперона называется негативным контролем транскрипции, при котором экспрессия генов прерывается регуляторными молекулами.
При появлении лактозы при отсутствии глюкозы молекулы лактозы связываются с субъединицами белка-репрессора (рис.90, с.). Молекулы белка-репрессора при взаимодействии с молекулами лактозы изменяют свою конформацию, что резко снижают его способность связываться с оператором. В результате этого белок-репрессор отсоединяется от оператора, позволяя тем самым РНК-полимеразе связываться с промотором и начать транскрипцию структурных генов. Оперон «включается» и начинается синтез ферментов, расщепляющих лактозу. Молекулы лактозы в этом случае является индуктором оперона, исходным субстратом, стимулирующим синтез ферментов, расщепляющих молекулы лактозы. Когда вся молекула лактозы расщепляется, репрессор освобождается и снова связывается с оператором, блокируя транскрипцию.
Максимально эффективная транскрипция происходит при участии особого белка САР (катоболит – активирующий белок) (рис.90,а). Этот белок связывается с САР-связывающим сайтом промотора, что облегчает связывание РНК-полимеразы с полимераза связывающим сайтом промотора и активизирует транскрипцию. Этот механизм активации называется позитивным контролем транскрипции, при котором транскрипция стимулируется только в присутствии регуляторных молекул.
Рис.159. Схема функционирования lас-оперона (Из: Клаг, 2009).
В случае, когда клетка попадает в среду богатую и глюкозой и лактозой, ей энергетически более выгодно использовать уже готовую глюкозу, а не расщеплять лактозу до глюкозы. В этом случае «предпочтения» отдается глюкозе, lac-оперон не активируется даже в присутствии лактозы. Это регуляция называется ингибированием lac-оперона или катоболитная репрессия. Выяснилось, что САР-белок перед связыванием с промотором образует комплекс с циклическим АМФ. Уровень последнего зависит от активности фермента аденилатциклазы, превращающей АТФ в АМФ. Глюкоза подавляет активность аденилатциклазы, снижая ее концентрацию в клетке. Образование цАМФ затруднено и связывание ее с САР-белком нарушается, что приводит к нарушению позитивного контроля транскрипции. Lac-оперон не функционирует и клетка использует в качестве питательного субстрата глюкозу (рис.90,в).
Репрессибельные опероны были открыты Ф.Жакобом и Ж.Моно. Репрессибельные опероны – это опероны в которых регуляторами является конечные продукты цепи контролируемых реакций. Если этот продукт отсутствует, белок-репрессор не соединяется с оператором; РНК-полимераза транскрибирует гены оперона (оперон «включен») и синтезируется ферменты, обеспечивающие образование этого конечного продукта. При накоплении этого конечного продукта, его молекулы связываются с белком репрессором, что повышает способность белка-репрессора связываться с оператором и «выключить» оперон. Синтез ферментов и образование конечного продукта прекращается.
Примером репрессибельного оперона является модель регуляции генов триптофанового (trp) оперона у E.coli.
Бактерии E.coli синтезирует ферменты, необходимые для биосинтеза аминокислоты триптофана с участием фермента триптофансинтетазы. Было обнаружено, что при наличии в питательной среде достаточного количества триптофана ферменты, участвующие в синтезе этой аминокислоты клеткой не синтезируется. Такая репрессия синтеза триптофана энергетически выгодна клетки.
Триптофановый (trp - оперон) оперон состоит из регуляторной области и структурных генов (рис.91). Регуляторная область включает промотор, оператор, лидерную последовательность, которая заканчивается аттенюатором. Промотор (trp Р) имеет сайт связывания с РНК-полимеразой, оператор (trp О) связывается с белком репрессором; лидерная последовательность (1.61 п.н.) кодирует лидерный пептид, входящий в состав фермента Е, синтез которого контролирует данный оперон. Аттенюатор (ослабитель), завершающий лидерную последовательность находятся в положении 123 – 150 п.н. и является, по сути, терминатором, заканчивающий транскрипцию.
Структурная часть оперона включают 5 генов: trp Д, trp С, trp В, trp А, которые контролирует синтез 4 ферментов (гены trp В и trp А кодируют 2 субъединицы), участвующих в заключительном этапе биосинтеза триптофана и транскрибирующихся в виде одной полицистронной и-РНК.
Триптофановый (trp - оперон) оперон имеет двойной механизм регуляции. Он регулируется оператором и аттенюатором.
. Первый уровень регуляции trp – оперона осуществляется оператором и аналогичен lac-оперона; обеспечивает глубокое подавление активности trp – оперона. Отличие заключается в том, что в trp – опероне регулятором является конечные продукты синтеза, катализируемого ферментами-продуктами структурных генов оперона. Активность trp-оперона регулируется белком-репрессором, кодируемым геном trp R, расположенным достаточно далеко от оперона (рис.91,а). Молекулы белка
Рис.160. Схема работы триптофонового (trр) оперона.
репрессора имеют сайт связывания с молекулой триптофана и образуют регуляторный комплекс триптофан-репрессор. В результате этого связывания молекула белка-репрессора меняет свою конформацию, становится активной и получает возможность связываться с оператором. Так как, промотор и оператор перекрывают друг друга, то, связавшись с оператором комплекс, триптофан-репрессор не позволяет РНК-полимеразе связываться с промотором. Транскрипция репрессируется (оперон «выключен»).
Таким образом, при наличии высокой концентрации конечного продукта цепи биосинтеза контролируемой данным опероном – триптофана, оперон репрессирован, гены не транскрибируются и ферменты не синтезируются. Триптофан выступает в данном случае корепрессором, т.к. входит в состав регуляторного комплекса.
Эта репрессибельная система находится под негативным контролем, поскольку регуляторный комплекс молекул репрессирует транскрипцию и полностью блокирует trp-оперон.
В случае отсутствия триптофана (рис.91,в), белок-репрессор не активен, связывание его с оператором не происходит; промоторная область свободна и может присоединять РНК-полимеразу (оперон «включен»). Начинается транскрипция поли-и-РНК, содержащей информацию 5 структурных генов, продукты которых ферменты принимает участие в синтезе триптофана.
. Второй уровень регуляции trp-оперона осуществляется аттенюатором при высокой концентрации триптофана в клетке. Аттенюа- тор содержит участки богатые ГЦ и АТ – последовательностями и дополняет роль оператора в регуляции trp-оперона, обеспечивая прекращение транскрипции и-РНК на аттенюаторе (рис.92). Аттенюатор обеспечивает регуляции транскрипции при изменении концентрации триптофана или отсутствии белка-репрессора (мутация гена trp В). При изобилии триптофана trp-оперон блокируется связыванием комплекса триптофан-репрессор с оператором. При снижении концентрации триптофана или отсутствии белка-репрессора регуляция trp-оперона осуществляется аттенюатором.
GC-богатые пары АТ-богатые пары
│ │ │
││
│
5′ ACCCCGCCTAATGA GCGCGCTTTTTTTTGAACAAAATTAGAGA 3′
3′ TGGGGCGGATTACTCGCGCGAAAAAAAACTTGTTTTAATCTCT 5′
│ | | | | | | | | | | | | | | | | | | | | | │
лидерная м-РНК UUUUUUUU- ОН 3′
Рис.161. Последовательность оснований на аттенюаторе trр-оперона.
Процессы транскрипции и трансляции у бактерий тесно связаны по времени и идут практически одновременно. Важная роль в этом механизме регуляции принадлежит рибосомам (рис.93). Опероны, регулируемые аттенюатором, контролирует синтез аминокислот, особенно редких: триптофана, гистидина и фенилаланина.
Процесс транскрипции полицистронной и-РНК в оперонах такого типа начинается с лидерного отдела; в результате образуется лидерный участок и-РНК, который тут же связывается с рибосомой и начинает трансляцию лидерного пептида, состоящего из 14 аминокислот, в том числе двух остатков триптофана.
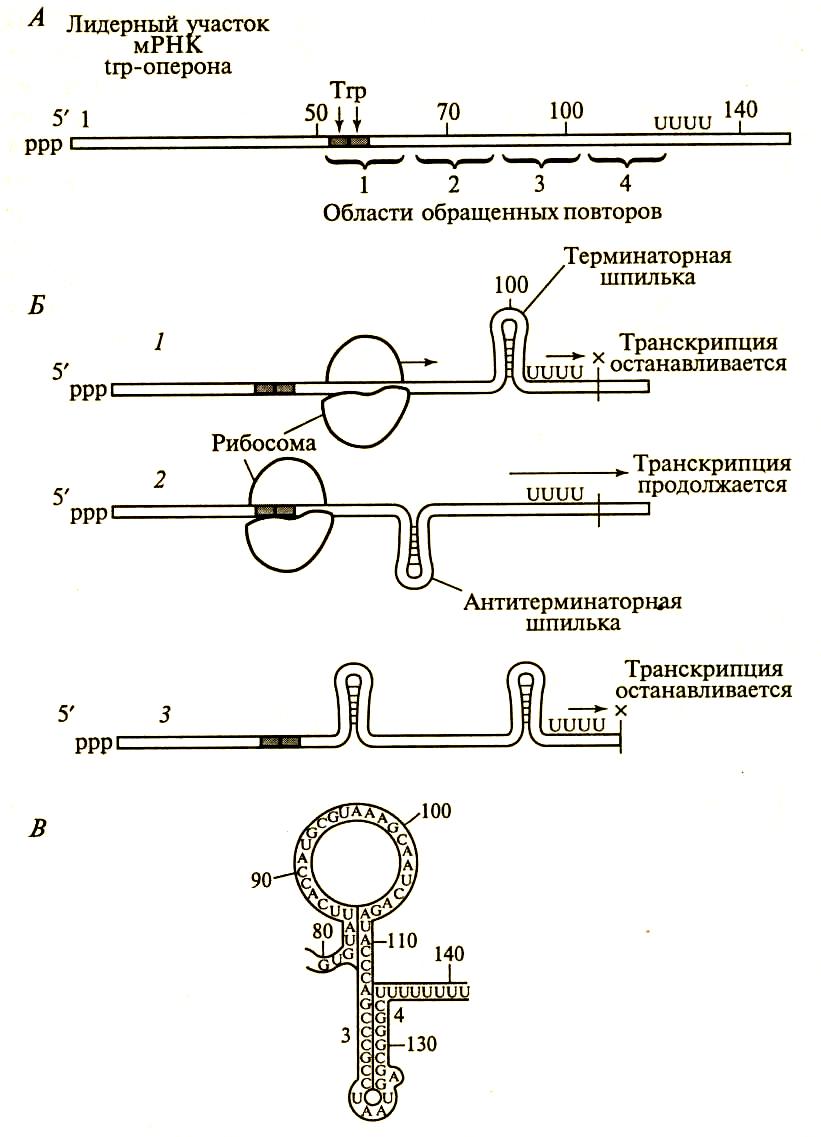
Рис.162. Процесс регуляции транскрипции с участием рибосом: А-лидерный участок мРНК, Б-схема регуляции; В-«шпилька» на мРНК.
В условиях избытка триптофана транскрипция начинается с синтеза лидерного участка и-РНК; последний тут же связывает рибосому, на которой начинается синтез лидерного пептида. Лидерный пептид состоит из 14 аминокислот, включая два остатка триптофана. При наличии большого количества триптофана в клетке, синтез лидерного пептида идет без задержки; рибосома плавно и быстро движется за РНК-полимеразой по и-РНК. В этом случае под влиянием рибосомы на м-РНК на участке лидерного отдела образуется терминаторная шпилька (рис.94). Ее образование объяс-
няется тем, что на аттенюаторе имеются области, которые богаты ГЦ – и АТ-последовательностями. Их особенность заключается тем, что они симметричны и выполняют функцию стоп-кодонов. РНК-полимераза, достигнув ГЦ- и АТ- богатые участки, задерживается, а и-РНК, синтезируемая с такого участка и комплементарная ему, способна так же спаривать основания и образовывать шпильку. За шпилькой следует участок и-РНК, содержащий серию остатков урацила.
Рис.163. Образование «шпильки» на 3′-конце м-РНК.
Образование терминаторной шпильки вызывает остановку транскрипции на участке, содержащий подряд несколько остатков урацила. Остановка транскрипции на участке аттенюаторе называется аттенуацией. РНК-полимераза отсоединяется от ДНК и гены не считывается.
Таким образом, большая концентрация триптофана в клетке, позволяет этой аминокислоте быстро включаться в лидерный пептид и, обеспечив быстрое и плавное движение рибосомы по и-РНК, блокировать транскрипцию генов, контролирующих ее собственный синтез через аттенюаторный механизм.
В условиях низкой концентрации триптофана или его отсутствии (триптофановое голодание) при синтезе лидерного пептида рибосома задерживается на двух рядом расположенных кодонах УГГ (рис.95-96).

Рис.164. Последовательность аминокислот в лидерном пептиде trр и
последовательность оснований в мРНК.
Застрявшая рибосома, отстает от РНК-полимеразы. Это отставание влияет на синтезируемую и-РНК так, что формируется антитерминаторная шпилька, которая препятствует образованию терминаторной шпильки и РНК-полимераза проскакивает аттенюатор, продолжая транскрипцию генов; активно синтезируются ферменты необходимые для пополнения запаса триптофана в клетке.
Итак, синтез триптофана может регулироваться trp-опероном через аттенюаторный механизм, который чутко реагирует на изменение концентрации этой аминокислоты в клетке.
Рис.165. Схема аттенюации trр-оперона Е.соli при низкой
концентрации триптофана
